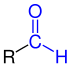
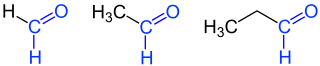
Aldehyde
Aldehyde (aus neulateinisch alcoholus dehydrogenatus, „dehydrierter Alkohol“ oder „Alkohol, dem Wasserstoff entzogen wurde“) sind chemische Verbindungen mit der funktionellen Gruppe –CHO, die Aldehydgruppe oder auch Formylgruppe genannt wird. Die Carbonylgruppe der Aldehyde trägt im Unterschied zu den Ketonen einen Wasserstoff- und einen Kohlenstoffsubstituenten. Eine Ausnahme bildet der einfachste Aldehyd Methanal (Formaldehyd), der zwei Wasserstoffsubstituenten trägt. Aldehyde mit einem Alkylrest (also Alkan-Derivate) werden als Alkanale bezeichnet; deren homologe Reihe leitet sich nomenklatorisch entsprechend von der homologen Reihe der Alkane ab. Weiter existieren Mehrfachaldehyde – wie beispielsweise das Glyoxal, der einfachste Dialdehyd.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Acetaldehyd wurde zum ersten Mal 1774 von Carl Wilhelm Scheele durch Oxidation von Ethanol mit Mangandioxid hergestellt. 1835 stellte Justus von Liebig Acetaldehyd durch Oxidation von Ethanol mit Chromsäure her und führte den Stoffgruppennamen Aldehyde, abgeleitet von alcoholus dehydrogenatus, ein.[1] Liebig fand heraus, dass Acetaldehyd eine Zwischenstufe in der Reaktion von Ethanol zu Essigsäure ist und entdeckte die Silberspiegelprobe, mit der Aldehyde nachgewiesen werden können.[2]
Einige Reaktionen der Aldehyde sind schon sehr lange bekannt. In den 1860er-Jahren beschrieb Hugo Schiff die Herstellung von Iminen aus Aldehyden und primären Aminen, die deshalb auch Schiff-Basen genannt werden. Zu dieser Zeit kamen gerade erst die ersten grundlegenden Erkenntnisse zur Struktur organischer Moleküle auf, beispielsweise die Vierbindigkeit des Kohlenstoffs und die Struktur des Benzolrings.[3][4]
Nomenklatur
[Bearbeiten | Quelltext bearbeiten]Im einfachsten Fall erhalten Aldehyde nach der IUPAC-Nomenklatur den Namen des Alkans mit dem Suffix -al. Dementsprechend heißt der vom Methan abgeleitete Aldehyd Methanal, der vom Ethan abgeleitete Ethanal.[5] Da die Aldehydfunktion nur am Kettenanfang stehen kann, ist es nicht nötig, mit einem Lokanten seine Position anzugeben.[6] In der Prioritätenrangfolge der funktionellen Gruppen kommen Aldehyde nach den Carbonsäuren und deren Derivaten (z. B. Ester, Amide und Nitrile), aber vor den Ketonen. Kommt eine ranghöhere funktionelle Gruppe im Molekül vor, muss die Aldehydfunktion mit einem Präfix benannt werden. Ist sie Teil des Stammsystems, wird das Präfix „Oxo-“ verwendet, z. B. 3-Oxopropansäure. Andernfalls wird das Präfix „Formyl-“ verwendet, das für die Aldehydgruppe inklusive des Kohlenstoffatoms gilt, z. B. 4-Formylbenzoesäure.[7] Ist die Aldehydfunktion die funktionelle Gruppe mit der höchsten Priorität, wird aber nicht zum Stammsystem gerechnet, weil sie beispielsweise an einen Ring gebunden ist, dann muss analog zur Endung „-carbonsäure“ bei Carbonsäuren die Endung „-carbaldehyd“ angehängt werden. Dabei wird durch die Endung ebenfalls die komplette Formylgruppe beschrieben, während bei der Endung „-al“ das Kohlenstoffatom dem Stammsystem zugerechnet wird.[8]
Der Trivialname leitet sich von der lateinischen Bezeichnung für die Carbonsäure der gleichen Kettenlänge her. Für das Methanal (H–CHO) ist das die Methansäure (lat. acidum formicum, H–COOH), daher Formaldehyd, für das Ethanal die Ethansäure (lat. acidum aceticum, CH3–COOH), daher Acetaldehyd. Die Trivialnamen der einzelnen Aldehyde sind grammatikalisch oft maskulin, z. B. der Acetaldehyd, aber laut Duden auch sächlich, also das Acetaldehyd. Dagegen sind die Vertreter der Alkanale immer Neutra, z. B. das Ethanal. Entsprechend leiten sich die anderen Trivialnamen ab. Dicarbonsäuren, bei denen eine Carbonsäuregruppe zu einer Aldehydgruppe reduziert wurde, werden gelegentlich Semialdehyde genannt.[9]
Abgrenzung zu verwandten Verbindungen
[Bearbeiten | Quelltext bearbeiten]Der einfachste Aldehyd ist Formaldehyd, bei dem zwei Wasserstoffatome an die Carbonylgruppe gebunden sind. Bei anderen Aldehyden sind an die Carbonygruppe ein Wasserstoffatom und ein organischer Rest gebunden.[10] Verbindungen in denen an beiden Seiten der Carbonylgruppe ein organischer Rest gebunden ist (kein Wasserstoffatom) sind Ketone.[11] Eine Formylgruppe kommt außer in Aldehyden auch in der Ameisensäure und ihren Derivaten vor, die eine Carbonylgruppe mit einem Wasserstoffatom und einem Heteroatom (beispielsweise Sauerstoff) enthalten. Daher weist Ameisensäure einige Eigenschaften auf, die eigentlich für Aldehyde typisch sind. Beispielsweise wirkt sie im Gegensatz zu anderen Carbonsäuren reduzierend.[12] Verbindungen, die einen organischen Rest und ein Heteroatom an der Carbonylgruppe tragen werden allgemein als Carbonsäuren und Carbonsäurederivate (Ester, Amide und so weiter) bezeichnet.[13] Trägt die Carbonylgruppe zwei Heteroatome, handelt es um Kohlensäure beziehungsweise deren Derivate (Phosgen, Carbonate, Harnstoff und so weiter).[14]
Vertreter und Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die C=O-Doppelbindung in Aldehyden ist kurz und stark, beispielsweise bei Acetaldehyd mit einer Länge von 120,4 pm und einer Bindungsenergie von etwa 732–753 kJ/mol. Die Bindung ist außerdem polarisiert, Kohlenstoff- und Sauerstoffatom tragen Partialladungen.[6] Zwischen den Aldehydgruppen von Alkanalen kommt es zu Dipol-Dipol-Kräften, da die C=O-Doppelbindung sehr polar ist. Wasserstoffbrückenbindungen bilden sich nicht, weil kein sauerstoffgebundenes Wasserstoffatom vorhanden ist. Deswegen liegen die Siedepunkte der Aldehyde zwischen denen der Alkohole und Alkane. Mit Wasser können Aldehyde Hydrate bilden und Wasserstoffbrückenbindungen eingehen, weil das Sauerstoffatom zwei freie Elektronenpaare hat und negativ polarisiert ist. Deswegen sind kurzkettige Aldehyde gut wasserlöslich. Bei längerkettigen Aldehyden mit sechs oder mehr Kohlenstoffatomen überwiegt die Wirkung der unpolaren Alkylreste, was die Verbindungen praktisch unlöslich in Wasser macht. Viele Aldehyde haben einen charakteristischen und intensiven Geruch. So hat zum Beispiel Acrolein einen stechenden Geruch (wahrnehmbar beim Anbrennen von Fetten), wogegen Vanillin, Anisaldehyd und Zimtaldehyd angenehm riechen.[15]
Spektroskopische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In IR-Spektren von Aldehyden und Ketonen findet man die intensive charakteristische Bande der C=O-Valenzschwingung im Bereich von 1690–1750 cm−1. Gesättigte aliphatische Aldehyde haben diese Bande bei 1740–1720 cm−1, Arylaldehyde bei 1715–1585 cm−1 und andere Aldehyde im Bereich von etwa 1790–1625 cm−1. Daneben liefern Aldehyde auch weniger intensive Bänder, zum Beispiel im Bereich 2900–2800 cm−1.[16]
In 13C-NMR-Spektren findet man das Signal des Carbonylkohlenstoffatoms von Aldehyden und Ketonen in einem Bereich von 195 und 210 ppm. Das dazugehörige Proton der Aldehydgruppe ist in 1H-NMR-Spektren als scharfes Signal bei etwa 10 ppm zu finden. Diese Eigenschaft macht die Identifikation mittels NMR-Spektroskopie besonders einfach, da in diesem hohen Bereich nur wenige Protonen eine Resonanz aufweisen.[6]
Vertreter
[Bearbeiten | Quelltext bearbeiten]Die Alkanale, also gesättigte, lineare Aldehyde, bilden eine homologe Reihe. Die allgemeine Summenformel der lautet CnH2nO (n = 1, 2, 3, 4, …). Die ersten vierzehn Vertreter sind in der folgenden Tabelle aufgelistet.
| Anzahl (C-Atome) |
IUPAC- Bezeichnung |
Trivialnamen | Summenformel | Strukturformel | Siedepunkt in °C[17] |
|---|---|---|---|---|---|
| 1 | Methanal | Formaldehyd | CH2O | −19,1 | |
| 2 | Ethanal | Acetaldehyd | C2H4O | 20,1 | |
| 3 | Propanal | Propionaldehyd Propylaldehyd |
C3H6O | 48 | |
| 4 | Butanal | n-Butyraldehyd | C4H8O | 74,8 | |
| 5 | Pentanal | Valeraldehyd Amylaldehyd n-Pentaldehyd |
C5H10O | 103 | |
| 6 | Hexanal | Capronaldehyd n-Hexaldehyd |
C6H12O | 131 | |
| 7 | Heptanal | Önanthaldehyd Heptylaldehyd n-Heptaldehyd |
C7H14O | 152,8 | |
| 8 | Octanal | Caprylaldehyd n-Octylaldehyd |
C8H16O | 171 | |
| 9 | Nonanal | Pelargonaldehyd n-Nonylaldehyd |
C9H18O | 191 | |
| 10 | Decanal | Caprinaldehyd n-Decylaldehyd |
C10H20O | 208,5 | |
| 11 | Undecanal | Hendecanal n-Undecylaldehyd |
C11H22O | 117(18 mbar) | |
| 12 | Dodecanal | Laurinaldehyd Dodecylaldehyd |
C12H24O | 238 | |
| 14 | Tetradecanal | Myristylaldehyd Tetradecylaldehyd |
C14H28O | 260 |
Neben den Alkanalen gibt es auch viele weitere Gruppen von Aldehyden, für die meistens historische Namen benutzt werden:
- Acrolein leitet sich von Propen – einem Alken – ab.
- Benzaldehyd leitet sich vom Benzol ab, ist also ein Arylaldehyd.
- Furfural (Furfurol, Furan-2-carbaldehyd) leitet sich von Furan ab, ist also ein Heteroarylaldehyd.[18]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Acetaldehyd ist kanzerogen und verursacht Mund-, Speiseröhren- und Magenkrebs. Unter anderem ist er bezogen auf die Menge ein wichtiger Inhaltsstoff in Tabakrauch und das wichtigste Karzinogen. Es spielt außerdem eine wichtige Rolle für die negativen gesundheitlichen Auswirkungen von Alkoholkonsum. Ethanol wird durch verschiedene Mikroorganismen durch Alkoholdehydrogenasen zu Acetaldehyd oxidiert. Viele Mikroorganismen sind aber weniger effizient im Abbau von Acetaldehyd, weshalb sich dieser anreichern kann.[19]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Allgemeine biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Einige Aldehyde übernehmen wichtige Funktionen biologische Funktionen bei Tieren inklusive Menschen. Pyridoxalphosphat (Vitamin B6) ist ein Cofaktor, der insbesondere eine wichtige Rolle im Metabolismus von Aminosäuren spielt. Bei diesen Reaktionen, zu denen Transaminierungen, Racemisierungen und Decarboxylierungen gehören, wird in der Regel zunächst aus einer Pyridoxalverbindung und einer Aminosäure ein Imin gebildet.[20]
Retinal ist eine essentielle Verbindung in der Lichtwahrnehmung von Tieren und Mikroorganismen, inklusive der Sehfähigkeit des Menschen. Die Lichtwahrnehmung basiert auf Proteinen, sogenannten Rhodopsinen, an die das Retinal in Form eines Imins gebunden ist. Das gebundene Retinal kann ein Photon aufnehmen, die dabei ausgelöste (E)/(Z)-Isomerisierung setzt dann eine Signalkaskade in Gang, die die Reizverarbeitung ermöglicht.[21]
Vorkommen in Pflanzen
[Bearbeiten | Quelltext bearbeiten]Ein wichtiger Prozess mit dem Pflanzen auf widrige Umgebungsbedingungen reagieren, ist der Lipoxygenase-Pathway. Dabei werden ungesättigte Fettsäuren, insbesondere Linolsäure und α-Linolensäure durch eine Lipoxygenase in Position 9 oder 13 zu einem Hydroperoxid oxidiert, wobei mehr Enzyme bekannt sind, die 13-Hydroperoxide bilden. Diese Hydroperoxide reagieren dann weiter zu diversen oxygenierten Verbindungen, sogenannten Oxylipinen. Dazu gehören beispielsweise Jasmonate oder oxygenierte Fettsäuren. Oxylipine erfüllen verschiedene biologische Funktionen, unter anderem zur Abwehr von Pathogenen. Durch Hydroperoxid-Lyasen werden die Hydroperoxide unter anderem zu Aldehyden und Alkoholen umgesetzt.[22] Zu den aus den 13-Hydroperoxiden gebildeten Verbindungen gehören die grünen Blattduftstoffe. Dabei handelt es sich um C6-Aldehyde, -alkohole sowie deren Ester, die für den typischen Geruch beispielsweise beim Schneiden von Blättern verantwortlich sind. Oxidation von Linolensäure ergibt beispielsweise 13-Hydroperoxy-9,11,15-octadecatriensäure, dessen Spaltung durch eine Hydroperoxid-Lyase (Z)-3-Hexenal ergibt, das sich leicht zu (E)-2-Hexenal umlagert. Ausgehend von Linolsäure wird Hexanal gebildet. Die 9-Hydroperoxide der Fettsäuren werden zu je zwei C9-Verbindungen gespalten, wobei neben anderen Oxidationsprodukten ebenfalls Aldehyde anfallen. Die meisten der auf diesem Weg gebildeten Oxylipine sind stark bakterizid, insbesondere (E)-3-Hexenal und (Z)-3-Hexenal.[23]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Aliphatische Aldehyde können auch durch Reduktion von Säurechloriden (zum Beispiel Rosenmund-Saizew-Reaktion) oder Nitrilen hergestellt werden. Aromatische Aldehyde können auch durch Oxidation der am aromatischen Kern gebundenen Methylgruppe (ein Beispiel ist die Darstellung von Benzaldehyd aus Toluol), durch eine Etard- oder Kröhnke-Reaktion oder aus Arylmethylhalogeniden dargestellt werden. Auch die direkte Formylierung aromatischer Verbindungen zu aromatischen Aldehyden, wie zum Beispiel die Gattermann-, Gattermann-Koch- oder Vilsmeier-Synthese bzw. die Reimer-Tiemann-Formylierung, sind möglich.[15]
Oxidation primärer Alkohole
[Bearbeiten | Quelltext bearbeiten]In der organischen Synthese ist die Oxidation primärer Alkohole die häufigste Synthese für Aldehyde.[24] Weit verbreitete Oxidationsmethoden zur Herstellung von Aldehyden basieren auf Chrom(VI)-verbindungen, Mangan(IV)-oxid, aktivierten Derivaten von Dimethylsulfoxid, hypervalenten Iod-Verbindungen, Ruthenium-Verbindungen und Nitroxylradikalen.[25][26]
Oxidationen mit Chrom(VI)
[Bearbeiten | Quelltext bearbeiten]Verschiedene Chrom(VI)-Reagenzien eignen sich für die Oxidation von Alkoholen zu Aldehyden und Ketonen. Die selektive Oxidation von primären Alkoholen zu Aldehyden gelingt dabei nur unter wasserfreien Bedingungen. In Anwesenheit von Wasser bilden sich nach dem ersten Oxidationsschritt Aldehydhydrate, die zur Carbonsäure weiteroxidiert werden, während die Aldehyde selbst gegenüber den Chrom(VI)-Reagenzien stabil sind.[6] Eine geeignete Verbindung ist der Komplex aus einem Molekül Chrom(VI)-oxid mit zwei Molekülen Pyridin. Wird Pyridin auch als Lösungsmittel verwendet, wird die Reaktion als Sarett-Reaktion bezeichnet, mit Dichlormethan als Collins-Reaktion. Neuer ist die Ratcliffe-Variante, wobei der Komplex in situ erzeugt wird, indem Chrom(VI)-oxid unter Rühren zu einer Lösung von Pyridin in Dichlormethan gegeben wird. Dadurch wird das direkte Arbeiten mit dem Komplex vermieden, wobei es leicht zu Explosionen kommen kann. Weitere Chrom(VI)-Reagenzien sind Pyridiniumdichromat und Pyridiniumchlorochromat, die beide in wässriger Lösung hergestellt werden, dabei jedoch ausfallen und in getrockneter Form unter wasserfreien Bedingungen in Dichlormethan eingesetzt werden können. Die Jones-Oxidation mit Chrom(VI)-oxid und Schwefelsäure ist wegen der Anwesenheit von Wasser oft nicht zur Herstellung von Aldehyden geeignet, kann jedoch zur Herstellung flüchtige Aldehyde verwendet werden, wenn das Produkt während der Reaktion abdestilliert wird.[25] Beispielsweise kann 1-Propanol so oxidiert werden und das entstehende Propanal abdestilliert werden.[26]
Oxidationen mit aktiviertem Dimethylsulfoxid
[Bearbeiten | Quelltext bearbeiten]Bei der Pfitzner-Moffatt-Oxidation greift Dimethylsulfoxid (DMSO) über das Sauerstoffatom ein protoniertes Dicyclohexylcarbodiimid (DCC) an und bildet eine Sulfoniumverbindung. Bei einer anschließenden Substitution durch den Alkohol am Schwefel wird das DCC als Dicyclohexylharnstoff wieder abgespalten, wobei ein Schwefel-Ylid entsteht. Als diesem bildet sich durch intramolekulare Eliminierung von Dimethylsulfid der Aldehyd. Eine Weiterentwicklung der Pfitzner-Moffatt-Oxidation mit sehr verbreiteter Anwendung ist die Swern-Oxidation, bei der statt DCC Oxalylchlorid verwendet wird. Nachteile sind hier die Bildung von hochgiftigem Kohlenmonoxid und dass die Reaktion zum Erzielen einer guten Selektivität nur bei niedrigen Temperaturen durchgeführt werden kann. Dafür werden mit der Swern-Oxidation meist sehr gute Ausbeuten erzielt. Andere Varianten sind die Albright-Goldman-Oxidation (mit Acetanhydrid statt DCC), die Parikh-Doering-Oxidation (mit Schwefeltrioxid-Pyridin-Komplex statt DCC), die Albright-Onodera-Oxidation (mit Phosphorpentoxid statt DCC), sowie eine Variante mit Trifluoressigsäureanhydrid statt DCC. Viele weitere Elektrophile können DMSO aktivieren, dazu gehören beispielsweise Mesylchlorid, Phosphortrichlorid, Phosphorylchlorid, Triphenylphosphindichlorid, Triphenylphosphindibromid und Acetylbromid. Auch bei der Corey-Kim-Reaktion findet ein aktiviertes Derivat von DMSO Verwendung, allerdings wird dieses nicht aus DMSO selbst hergestellt, sondern durch Oxidation von Dimethylsulfid mit elementarem Chlor, wobei Chlordimethylsulfoniumchlorid entsteht (dieselbe Verbindung wie bei der Swern-Oxidation). Eine Variante, die die gefährliche Verwendung von gasförmigem Chlor vermeidet, ist die Oxidation von Dimethylsulfid mit N-Chlorsuccinimid (NCS), wobei das reaktive Intermediat statt einem Chloratom eine Succinimid-Gruppe trägt.[25]
Oxidationen mit hypervalenten Iod-Verbindungen
[Bearbeiten | Quelltext bearbeiten]Ein verbreitetes Oxidationsmittel zur Herstellung von Aldehyden sind hypervalente Iodverbindungen, bei denen ein Iodatom in einer hohen Oxidationsstufe vorliegt. Früher bekannte hypervalente Iodverbindungen waren sehr instabil und zudem meist kaum bis gar nicht in organischen Lösungsmittel löslich, was ihre Anwendung stark einschränkte. Das im Jahr 1983 präsentierte Dess-Martin-Periodinan ist eine Verbindung, die beide Probleme löst, weshalb sie oft für die Herstellung von Aldehyden verwendet wird. Die Reaktion wird oft in Dichlormethan durchgeführt. Als Nebenprodukt entsteht aus dem Oxidationsmittel auch Essigsäure, die aber mittels Pyridin oder Natriumhydrogencarbonat neutralisiert werden kann. Eine weitere hypervalente Iodverbindung, Iodoxybenzoesäure ist schon deutlich länger bekannt, ist aber in den meisten organischen Lösungsmitteln unlöslich. Geeignete Reaktionsbedingungen, insbesondere der Einsatz von Dimethylsulfoxid als Lösungsmittel, wurden erst nach der Entdeckung des Dess-Martin-Periodinans entwickelt.[25]
Oxidationen mit Mangan(IV)-oxid
[Bearbeiten | Quelltext bearbeiten]Mangan(IV)-oxid als Oxidationsmittel kann durch Umsetzung von Mangan(II)-sulfat mit Kaliumpermanganat und Natriumhydroxid gewonnen werden. Es ist ein selektives Oxidationsmittel für Hydroxygruppen in allylischer oder benzylischer Position. So können Hydroxymethylgruppen an Doppelbindungen und aromatischen Ringen zu Aldehyden oxidiert werden.[26]
Andere Oxidationsreaktionen
[Bearbeiten | Quelltext bearbeiten]Durch Hydratisierung von Alkinen werden Enole gebildete, die sich zu Aldehyden oder Ketonen umlagern. Aldehyde speziell werden durch die Anti-Markovnikov-Hydratisierung terminaler Alkine erhalten, was mittels Hydroborierung und anschließender Oxidation möglich ist. Bei der Ozonolyse von Alkenen werden Aldehyde erhalten, wenn die Aufarbeitung mit einem milden Reduktionsmittel erfolgt, beispielsweise elementares Zink oder Dimethylsulfid.[6]
Hydroformylierung oder Oxo-Synthese
[Bearbeiten | Quelltext bearbeiten]Das technisch wichtigste Verfahren zur Herstellung von Aldehyden ist die Oxo-Synthese, auch Hydroformylierung genannt. Dabei wird ein Alken mit einem Gemisch aus Kohlenmonoxid und Wasserstoff in Gegenwart eines geeigneten Katalysators (zum Beispiel ein Cobaltkatalysators) zur Reaktion gebracht:[15]

und des i-Aldehyds (rechts).
Reduktionsreaktionen
[Bearbeiten | Quelltext bearbeiten]Bei der Reduktion von Carbonsäurederivaten kommt es leicht zur Überreaktion unter Bildung eines primären Alkohols. Eine verbreitete Methode, um dies zu vermeiden, ist die Reduktion eines Weinreb-Amids. Dieses wird aus einem Carbonsäurederivat mit N,O-Dimethylhydroxylamin-Hydrochlorid gebildet. Wird ein Hydrid an ein Weinreb-Amid addiert, entsteht ein stabiles tetraedrisches Intermediat. Da zunächst kein Aldehyd ausgebildet wird, ist auch keine weitere Hydrid-Addition und Überreaktion möglich. Bei der wässrigen Aufarbeitung erfolgt dann die Hydrolyse zum Aldehyd, dabei wird auch das eingesetzte Reduktionsmittel zerstört, sofern es nicht vollständig reagiert hat. Die Reduktion eines Weinreb-Amids ist mit Lithiumaluminiumhydrid oder DIBAL möglich.[27] Carbonsäuren können auch mit DIBAL zu Aldehyden reduziert werden, indem sie zuvor in situ mit Trimethylsilylchlorid zu einem Trimethylsilylester umgesetzt werden.[28] Mit DIBAL können außerdem Nitrile zu Iminen reduziert werden, wodurch nach Hydrolyse ebenfalls Aldehyde erhalten werden.[29] Eine andere Methode für die Reduktion von Nitrilen zu Aldehyden ist die Stephen-Reduktion. Dabei wird das Nitril mit Zinn(II)-chlorid und Chlorwasserstoff in Ether umgesetzt.[30]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Die C=O-Bindung der Carbonylgruppe in Aldehyden ist stark polar mit der positiven Partialladung (δ+) am Kohlenstoffatom, an dem nukleophil angegriffen werden kann.[6] Nach Angriff des Nukleophils geht das π-Elektronenpaar gänzlich zum inzwischen negativ geladenen Sauerstoff. Im protischen Lösungsmittel wird dies durch Protonenaufnahme ausgeglichen, wodurch eine OH-Gruppe anstelle der Carbonylgruppe entsteht.[31]
Bildung von Hydraten und Acetalen
[Bearbeiten | Quelltext bearbeiten]Aldehyde stehen in wässriger Lösung mit dem entsprechenden Aldehydhydrat (gem-Diol), das heißt einem Kohlenwasserstoff mit zwei Hydroxygruppen an einem Kohlenstoffatom, im Gleichgewicht. In der Regel liegt das Gleichgewicht auf der Seite des Aldehyds. Im Falle des Trichloracetaldehyds liegt das Gleichgewicht jedoch auf der Seite des geminalen Diols.[32]
Aldehyde reagieren auch mit Alkoholen zu Acetalen.[32]
Reaktionen über Enole und Enolate
[Bearbeiten | Quelltext bearbeiten]

Aldehyde mit einem Wasserstoffatom, gebunden an das α-Kohlenstoffatom direkt neben der Carbonylgruppe, können in der Keto- und der Enolform vorliegen – siehe dazu Keto-Enol-Tautomerie.[33] Bei Aldehyden beobachtet man, dass Wasserstoffatome am zur Carbonylgruppe benachbarten C-Atom deutlich acider sind als Wasserstoffatome an „normalen“ C-Atomen. Dies liegt zum einen daran, dass der Carbonylkohlenstoff sehr elektronenarm ist und einen −I-Effekt auf benachbarte Bindungen ausübt, zum anderen kann nach Deprotonierung die negative Ladung auf den Sauerstoff der Carbonylgruppe delokalisiert werden (−M-Effekt).[34]
Im Gegensatz zu Ketonen und Estern werden Aldehyde selten in Enolate überführt, um diese zu alkylieren, da die Zugabe von Base typischerweise zu Aldolreaktionen führt. Dies kann vermieden werden, wenn die Enoaltbildung zügig und quantitativ erfolgt, was beispielsweise mit Kaliumhydrid in Tetrahydrofuran oder mit Kaliumamid in flüssigem Ammoniak möglich ist. Allgemein können solche Reaktionen jedoch durchgeführt werden, indem Aldehyde zunächst in ein Enamin oder ein Enamin-Anion (durch Deprotonierung eines Imins) überführt werden.[26] Bei der Aldoladdition wird das CH-acide Wasserstoffatom in der α-Position durch eine Base abgespalten. Das entstandene Enolatanion addiert an den Carbonylkohlenstoff eines weiteren Aldehyd-Moleküls. Es entsteht ein Aldol, ein Additionsprodukt aus Alkohol (OH-Gruppe) und Aldehyd. Auf diese Weise können C-C-Bindungen geknüpft werden. Wird das gebildete Aldol anschließend dehydratisiert, spricht man von Aldolkondensation, dabei entstehen α,β-ungesättigte Aldehyde.[32]
Herstellung von Iminen und verwandten Verbindungen
[Bearbeiten | Quelltext bearbeiten]Auch mit Stickstoff-Nukleophilen reagieren Aldehyde.[32]
Herstellung von Carbonsäuren und deren Derivaten
[Bearbeiten | Quelltext bearbeiten]Aldehyde sind reaktive Verbindungen und lassen sich sehr leicht zur Carbonsäure oxidieren.[32]
In der Tischtschenko-Reaktion werden Aldehyde zu symmetrischen Carbonsäureestern dimerisiert. Beispielsweise kann Benzylbenzoat aus Benzaldehyd hergestellt werden. Als Katalysator kommen Aluminiumalkoholate wie Aluminiumtriethanolat zum Einsatz.[35] Die Corey-Gilman-Ganem-Oxidation ist eine Methode um α,β-ungesättigte Aldehyde zu oxidieren und direkt in entsprechende Carbonsäuremethylester umzusetzen. Dazu wird das Edukt in Methanol in Gegenwart von Cyanwasserstoff mit Mangan(IV)-oxid zur Reaktion gebracht. Es entsteht ein Cyanhydrin, das zu einem Acylcyanid oxidiert wird und dann mit Methanol zum Ester reagiert.[36]
Die Herstellung von Nitrilen aus Aldehyden verläuft in der Regel über Aldoxime (siehe Abschnitt Herstellung von Iminen und verwandten Verbindungen). Diese werden durch Reaktion des Aldehyds mit Hydroxylaminhydrochlorid hergestellt und anschließend beispielsweise mit Oxalylchlorid dehydratisiert.[37] Die direkte Umsetzung von Aldehyden zu Nitrilen ist unter anderem mit Hydroxylamin-O-sulfonsäure[38] möglich oder indem die Reaktion mit Hydroxylamin in Gegenwart von Titan(IV)-chlorid durchgeführt wird.[39]
Durch die Reaktion mit tert-Butylhypochlorit können Aldehyde direkt in Carbonsäurechloride überführt werden.[40] In Gegenwart von Natriumazid können so auch Carbonsäureazide hergestellt werden.[41]
Herstellung von Alkoholen
[Bearbeiten | Quelltext bearbeiten]Mit geeigneten Reduktionsmitteln wie Natriumborhydrid können Aldehyde zu primären Alkoholen reduziert werden. Als Lösungsmittel für diese Reaktion eignen sich Wasser und Alkohole wie Methanol und Ethanol. Aldehyde lassen sich leichter reduzieren als Ketone, sodass Natriumborhydrid in Gegenwart eines Ketons selektiv einen Aldehyd reduzieren kann.[42] Die umgekehrte Selektivität wird in der Luche-Reduktion erzielt, bei der ein Keton mit Cer(III)-chlorid aktiviert wird und dann in Gegenwart eines Aldehyds selektiv mit Natriumborhydrid reduziert werden kann.[43] Das hochreaktive Lithiumaluminiumhydrid reagiert schon bei Raumtemperatur schnell und im Wesentlichen quantitativ mit den meisten Carboxyl- und Carbonylverbindungen inklusive Aldehyden.[44] Ein hochselektives Reagenz, das Aldehyde sehr leicht, Ketone jedoch nur in Ausnahmen reduziert, ist das Natriumtriacetoxyborhydrid.[45] Aldehyde können außerdem zu primären Alkoholen hydriert werden, beispielsweise unter Katalyse mit Mangan, Rhenium oder Ruthenium.[46][47]
Die Addition von Grignard-Reagenzien an Aldehyde ergibt ebenfalls Alkohole. Im Fall von Formaldehyd entsteht dabei ein primärer Alkohol, bei anderen Aldehyden ein sekundärer Alkohol.[48] In der Reformatzki-Reaktion werden α-halogenierte Carbonsäureverbindungen mit elementarem Zink umgesetzt und an Aldehyde addiert, wodurch eine Alkoholgruppe in einem β-Hydroxyderivat gebildet wird.[49] Durch Addition von Allyltributylzinn, meist unter Katalyse einer Lewis-Säure, können aus Aldehyden Homoallylalkohole hergestellt werden.[50]
In der Meerwein-Ponndorf-Verley-Reduktion wird ein Aldehyd durch Reaktion mit Aluminiumisopropanolat reduziert. Dabei werden die Isopropanolat-Gruppen zu Aceton oxidiert. Es handelt sich um eine Gleichgewichtsreaktion, jedoch kann das Gleichgewicht verschoben werden, indem während der Reaktion das entstehende Aceton abdestilliert wird.[51]
In der Pinakol-Kupplung bilden zwei Aldehyde eine C-C-Bindung aus, wodurch ein Diol entsteht. Setzt man Aldehyde mit einem Alkalimetall (Beispiel: Natrium) um, so bildet sich ein Radikal-Anion, das schnell dimerisiert. Die Hydrolyse liefert ein Pinakol (traditionelle Bezeichnung für ein 1,2-Diol, also ein Diol mit vicinalen Hydroxygruppen). Ausgehend von einem α,ω-Dialdehyd erhält man analog durch eine intramolekulare Reaktion cyclische 1,2-Diole.[52]
Herstellung von Carbonylverbindungen
[Bearbeiten | Quelltext bearbeiten]Aldehyde können über ein Dithioacetal in Ketone überführt werden. Dabei wird der Aldehyd zunächst mit 1,3-Propandithiol umgesetzt. Das entstandene Thioacetal kann mittels Butyllithium deprotoniert werden und wird zu einem guten Nucleophil, im Gegensatz zum Aldehyd selbst, der ein Elektrophil ist. Man spricht von einer Umpolung, diese ist das Prinzip der Corey-Seebach-Reaktion. Umsetzung mit Alkylhalogeniden und Entfernung der Dithioacetalgruppe ergibt ein Keton. Zur Spaltung des Thioacetals eignen sich beispielsweise Quecksilber(II)-chlorid oder N-Bromsuccinimid.[53] In einer zweistufigen Reaktion können auch Cycloalkanone hergestellt werden, beispielsweise Cyclobutanon aus Formaldehyd (das umgepolt wird) und 1-Brom-3-chlorpropan. Durch Reaktion mit Kohlenstoffdioxid wird eine α-Oxocarbonsäure erhalten.[54]
In der Stetter-Reaktion werden Aldehyde an α,β-ungesättigte Ketone, Ester oder Nitrile addiert, wodurch eine entsprechende 4-Oxoverbindung erhalten wird. Katalysiert wird die Reaktion durch N-Heterocyclische Carbene, die durch Deprotonierung von Thiazolen und Imidazolen erhalten werden.[55] Alternativ kann auch Cyanid (beispielsweise als Natriumcyanid) als Katalysator eingesetzt werden, wodurch als Intermediat das Cyanhydrin des Aldehyds entsteht.[56]
Reduktion zu Alkanen
[Bearbeiten | Quelltext bearbeiten]Durch einige Methoden kann die Aldehyd-Funktion zu einer Methylgruppe reduziert werden. Eine solche Methode ist die Wolff-Kishner-Reduktion. Hierzu muss der Aldehyd in ein Hydrazon umgewandelt werden, dies ist jedoch auch in situ möglich. In dem Fall wird das Edukt mit Hydrazinhydrat und einer Base (Natriumhydroxid oder Kaliumhydroxid) in einem hochsiedenden Lösungsmittel (beispielsweise Diethylenglycol) für mehrere Stunden auf 180 °C bis 200 °C erhitzt.[57] Eine verwandte Methode ist die Clemmensen-Reduktion, bei der die Aldehydgruppe mit Zinkamalgam und Salzsäure reduziert wird. Wolff-Kishner-Reduktion und Clemmensen-Reduktion sind komplementär, da im einen Fall im Basischen und im anderen im Sauren gearbeitet wird.[58] Eine weitere Methode, die Thioketal-Reduktion, verläuft über die Thioacetale, meist mit Ethandithiol. Diese können durch diverse Reduktionsmittel reduziert werden, ursprünglich mit Raney-Nickel. Andere geeignete Reagenzien sind Komplexe aus Nickel(II)-acetat, Natriumhydrid und tert-Amylalkohol sowie Dinickelborid, das aus Nickel(II)-chlorid und Natriumborhydrid hergestellt wird.[59] Eine neuere Methode verwendet Amminboran mit Titanocendichlorid und Lithiummethanolat.[60] Durch Decarbonylierung von Aldehyden wird ebenfalls eine Kohlenwasserstoff-Verbindung erhalten. Durch die Abspaltung von Kohlenmonoxid besitzt diese jedoch ein Kohlenstoffatom weniger als das Edukt. Die Decarbonylierung ist beispielsweise durch Reaktion mit dem Wilkinson-Katalysator, einem Rhodium-Komplex, möglich.[61]
Herstellung von Alkenen
[Bearbeiten | Quelltext bearbeiten]Die Wittig-Reaktion ist eine sehr bedeutende Methode der organischen Synthese, bei der ein Aldehyd oder Keton mit einem Phosphor-Ylid zu einem Alken umgesetzt wird. Ein Aldehyd kann mit dem Phosphor-Ylid ein Oxaphosphetan, einen Vierring mit P-O-Bindung, als Zwischenstufe bilden. Dieses zerfällt dann in ein Alken und Triphenylphosphanoxid. Einen wichtigen Beitrag zur Triebkraft der Reaktion stellt die Ausbildung einer Phosphor-Sauerstoff-Bindung.[62] Die nötigen Ylide werden allgemein ausgehend von Triphenylphosphin und einem Alkylhalogenid hergestellt. Durch nukleophile Substitution wird zunächst ein Phosphoniumsalz hergestellt. Die Deprotonierung mit einer starken Base, oft eine Organolithium-Verbindung, ergibt dann das Ylid.[63] Eine abgeleitete Methode mit der ebenfalls Aldehyde zu Alkenen umgesetzt werden, ist die Wittig-Horner-Reaktion. Hier ist das Reagenz ein Phosphanoxid mit zwei Phenylgruppen und einer Alkylgruppe, die übertragen wird. Dieses wird beispielsweise mit Butyllithium zu einem Carbanion deprotoniert. Das Nebenprodukt ist ein Salz der Diphenylphosphinsäure.[64] Eine wesentlich wichtigere Weiterentwicklung ist die Horner-Wadsworth-Emmons-Reaktion (HWE-Reaktion). Hier ist das Reagenz ein Phosphonat, das mittels Arbusow-Reaktion hergestellt werden kann und durch Deprotonierung ebenfalls ein Carbanion bildet. Als Base eignen sich Natriumhydrid, Kaliumhydrid, Lithium-, Natrium- und Kaliumhexamethyldisilazid oder Kalium-tert-butanolat. Gegenüber der ursprünglichen Wittig-Reaktion hat diese Methode insbesondere den Vorteil, dass als Nebenprodukt ein Phosphorsäureester entsteht, der im Gegensatz zum Triphenylphosphanoxid wasserslöslich ist und leicht entfernt werden kann.[65]
In der Julia-Lythgoe-Olefinierung kommt als Olefinierungsreagenz ein Sulfon zum Einsatz. Dieses wird mit einer Organometallverbindung wie Butyllithium deprotoniert und kann dann einen Aldehyd unter Bildung einer C-C-Einfachbindung angreifen. Die aus dem Aldehyd gebildete Alkoholat-Gruppe wird acyliert, beispielsweise mit Acetanhydrid. Im letzten Schritt wird mit einem Reduktionsmittel wie Natriumamalgam eine reduktive Eliminierung durchgeführt, wobei Sulfon- und Estergruppe entfernt werden und trans-selektiv eine C=C-Doppelbindung gebildet wird.[66] Bei der verwandten Julia-Kociensky-Olefinierung wird ein Sulfon verwendet, das eine Arylgruppe mit Elektronenakzeptor-Eigenschaften trägt, beispielsweise Benzothiazol. Wird ein solches Sulfon deprotoniert und mit einem Aldehyd umgesetzt, sind keine weiteren Reaktionsschritte nötig. Es kommt zu einer Umlagerung der Arylgruppe auf das Sauerstoffatom, das zu Aldehyd gehörte und diese Gruppe wird durch Eliminierung abgespalten. Daneben entsteht Schwefeldioxid.[67] In der Peterson-Olefinierung wird das α-Carbanion einer Silylverbindung an einen Aldehyd addiert. Durch Eliminierung bildet sich ein Alken und ein Silanol, das Sauerstoffatom wird auf das Siliciumatom übertragen.[68]
Für die Methylenierung von Aldehyden, das heißt den Austausch des Sauerstoff-Atoms gegen eine CH2-Gruppe sind eine große Zahl an Reagenzien beziehungsweise Reaktionen bekannt. Besonders bekannt ist das Tebbe-Reagenz.[69][70] Verwandt mit dem Tebbe-Reagenz beziehungsweise davon abgeleitet sind das Grubbs-Reagenz und das Petasis-Reagenz.[70] Bei der Takai-Lombardo-Reaktion wird Dibrommethan mit elementarem Zink und Titan(IV)-chlorid verwendet. Ein Carben des Molybdäns, das aus Molybdän(V)-chlorid und Methyllithium hergestellt wird, ist besonders selektiv für Aldehyde.[69]
Eine neuere Method ist die Takeda-Olefinierung. Dabei wird ein Dithioacetal mit einem Derivat des Titanocens zu einem Carbenkomplex umgesetzt. Dieser reagiert dann mit einer Carbonylgruppe, beispielsweise in einem Aldehyd, unter Ausbildung einer C=C-Doppelbindung. Auch das Dithioacetal kann aus einem Aldehyd hergestellt werden.[70] Mit der McMurry-Reaktion können zwei Aldehyd-Moleküle durch Reaktion mit Titan(III)-chlorid direkt über eine C=C-Doppelbindung verbunden werden.[71]
Herstellung von Alkinen
[Bearbeiten | Quelltext bearbeiten]Es sind mehrere Reaktionen bekannt, durch die aus Aldehyden Alkine hergestellt werden können, wobei jeweils ein zusätzliches Kohlenstoffatom eingeführt wird. In der Corey-Fuchs-Reaktion wird aus dem Aldehyd ein gem-Dibromolefin hergestellt, indem es mit Triphenylphosphin und Tetrabrommethan umgesetzt wird. Reaktion mit Butyllithium ergibt ein Lithiumacetylid, aus dem durch Hydrolyse ein terminales Alkin entsteht. Alternativ kann das Lithiumaceylid durch Reaktion mit einem Elektrophil wie Kohlenstoffdioxid, einem Alkylhalogenid, einem weiteren Aldehyd oder einem Epoxid weiter modifiziert werden.[72][73][74]
Bei der Seyferth-Gilbert-Homologisierung wird das zusätzliche Kohlenstoffatom mittels Dimethyldiazomethylphosphonat (DAMP) eingeführt. Als Base kommt hier Kalium-tert-butanolat zum Einsatz. Bei der Weiterentwicklung nach Ohira und Bestmann wird das Ohira-Bestmann-Reagenz eingesetzt. Aus diesem wird durch Reaktion mit Kaliumcarbonat in situ DAMP hergestellt.[72]
Weitere Additionsreaktionen
[Bearbeiten | Quelltext bearbeiten]Neben Sauerstoff- und Stickstoff-Nucleophilen sowie Hydrid-Ionen und Organometallverbindungen können weitere Stoffgruppen als Nucleophile an die Carbonylgruppe von Aldehyden addieren.
Analog zur Bildung von Acetalen mit Alkoholen können Aldehyde Dithioacetale (S,S-Acetale) bilden, indem sie mit Thiolen beziehungsweise Dithiolen reagieren. Symmetrische Dithioacetale werden problemlos erhalten, indem Aldehyde und Thiole unter Säurekatalyse zur Reaktion gebracht werden. Unsymmetrische Vertreter, die Gruppen aus zwei unterschiedlichen Thiolen enthalten, sind schwieriger herzustellen. Sind die Thiole in ihren Eigenschaften ausreichend verschieden, ist jedoch eine vergleichsweise selektive Reaktion zu unsymmetrischen Acetalen möglich, indem Camphersulfonsäure als Katalysator eingesetzt wird.[75] Einfache, symmetrische Dithioacetale sind wichtige Intermediate in diversen Umsetzungen von Aldehyden. Dazu gehören beispielsweise die Takeda-Olefinierung (siehe Abschnitt Herstellung von Alkenen), die Thioketal-Reduktion (siehe Abschnitt Reduktion zu Alkanen) und die Umpolung beziehungsweise Corey-Seebach-Reaktion (siehe Abschnitt Herstellung von Carbonylverbindungen).
In der Bisulfit-Reaktion mit Natriumhydrogensulfit bilden Aldehyde wasserlösliche Addukte, die von einem Gemisch abfiltriert werden können. Durch Reaktion mit Natriumcarbonat oder Salzsäure können die Aldehyde dann zurückgewonnen werden.[76] Die Addukte sind strukturell die α-hydroxylierten Derivate von Sulfonsäuren.[77]
Durch Addition von Cyanid (beispielsweise aus Natriumcyanid) im Sauren (beispielsweise in Essigsäure) können aus Aldehyden Cyanhydrine hergestellt werden.[78] Anderes Reagenzien zur Herstellung von Cyanhydrinen sind Diethylaluminiumcyanid[79] und Acetoncyanhydrin, dessen Cyanwasserstoff-Einheit auf andere Aldehyde und Ketone übertragen werden kann.[80] Cyanhydrine kommen als Intermediate bei der Stetter-Reaktion (siehe Abschnitt Herstellung von Carbonylverbindungen) und bei der Corey-Gilman-Ganem-Oxidation von Aldehyden (siehe Abschnitt Herstellung von Carbonsäuren und deren Derivaten) vor.
Auch in der Strecker-Synthese wird Cyanwasserstoff beziehungsweise Cyanid an Aldehyde addiert, in diesem Fall in Gegenwart von Ammoniak. Dabei entsteht zunächst ein α-Aminonitril, das zu einer Aminosäure hydrolysiert werden kann. Aminosäuren sind sowohl in biologischen Prozessen als auch in der Industrie sehr wichtige Verbindungen, was die historische Bedeutung der Methode begründet. Allerdings wird die Reaktion nach wie vor verbreitet verwendet.[81]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Aldehyde sind eine wichtige Verbindungsklasse in diversen Anwendungsbereichen. Viele andere Chemikalien werden ausgehend von Aldehyden hergestellt. Außerdem werden viele Aldehyde als Duftstoffe und Aromen verwendet. Eine mengenmäßig sehr wichtige Anwendung ist die Herstellung von Polymeren aus Formaldehyd.
Intermediate in der chemischen Industrie
[Bearbeiten | Quelltext bearbeiten]Die wichtigste Anwendung von Acetaldehyd ist als Zwischenprodukt bei der Herstellung anderer Chemikalien, unter anderem Pyridin und seine Derivate, sowie Pentaerythrit und Peressigsäure.[82] Pentaerythrit wird aus Acetaldehyd und Formaldehyd unter basischer Katalyse hergestellt.[83] Als Basen eignen sich beispielsweise Natriumhydroxid oder Calciumhydroxid.[1] Verschiedene Pyridine werden aus Acetaldehyd und Ammoniak sowie jeweils einem weiteren Aldehyd nach der Tschitschibabin-Pyridinsynthese hergestellt.[84] Eine Herstellungsmethode von Ethylacetat ist durch Tischtschenko-Reaktion von Acetaldehyd. Die Bedeutung von Acetaldehyd als chemisches Intermediat hat aber insgesamt nachgelassen; für einige Verbindungen, beispielsweise Essigsäure und Acetanhydrid, die früher aus Acetaldehyd hergestellt wurden, gibt es heute andere bevorzugte Verfahren, beispielsweise den Monsanto-Prozess für Essigsäure.[1] Formaldehyd ist ein sehr wichtiger C1-Baustein und dient unter anderem zur Herstellung von 1,4-Butandiol, Nitrilotriessigsäure und EDTA, Pentaerythrit und Methylendiphenyldiisocyanat.[85]
Butanal wird insbesondere zu 1-Butanol reduziert,[86] der wiederum zu Butylacrylat, Butylacetat und Weichmachern weiterverarbeitet wird oder als Lösungsmittel eingesetzt wird, z. B. in Farben.[87] Ein weiteres wichtiges Folgeprodukt von Butanal ist 2-Ethylhexanol.[86] 2-Ethylhexanol wird vor allem zu Weichmachern weiterverarbeitet.[88] Zu den 2-Ethylhxylestern, die als Weichmacher verwendet werden, gehören z. B. Bis(2-ethylhexyl)phthalat, Bis(2-ethylhexyl)terephthalat und Bis(2-ethylhexyl)adipat.[89] Neben Butanal werden auch diverse andere Aldehyde zur Herstellung von Alkoholen durch Reduktion verwendet. Aus Pentanalen hergestellte Pentanole dienen ebenfalls als Lösungsmittel sowie zur Herstellung von Weichmachern und anderen Estern. Auch längerkettige Aldehyde werden zu Weichmacheralkoholen umgesetzt, beispielsweise Isooctanal zu Isooctanol. Citral ist der Ausgangsstoff für die synthetische Herstellung von Vitamin A.[1] Phenylacetaldehyd wird zur Herstellung von Phenylalanin über die Strecker-Synthese verwendet, das wiederum zu dem Süßstoff Aspartam umgesetzt wird.[1] Eine weitere Aminosäure, die in großen Mengen hergestellt und insbesondere als Zusatz in Tierfutter verwendet wird, ist Methionin. Es wird durch Strecker-Synthese aus Acrolein, Schwefelwasserstoff und Cyanwasserstoff hergestellt.[90][91]
Kunststoffe
[Bearbeiten | Quelltext bearbeiten]Die Produktionsmenge von Formaldehyd betrug 2022 etwa 23 Millionen Tonnen. Der Hauptanwendungsbereich von Formaldehyd ist die Herstellung von Polymeren: Harnstoffharze (Aminoplaste), Phenolharze (Phenoplaste) und Polyoxymethylen (POM).[92] Aminoplaste werden überwiegend durch Polykondensation von Formaldehyd und Harnstoff hergestellt. Ihre Hauptanwendung ist als Klebstoff für die Herstellung von Spanplatten und Sperrholz.[93] Aus POM werden beispielsweise Bauteile für Autos hergestellt, um deren Gewicht zu reduzieren.[85]
Butanal wird in der Herstellung von Polyvinylbutyral eingesetzt.[86] Polyvinylbutyral wird durch Polymerisation von Vinylacetat zu Polyvinylacetat, Hydrolyse zu Polyvinylalkohol und anschließende Acetalbildung mit Butanal hergestellt. Verwendet wird es hauptsächlich als Zwischenschicht in Sicherheitsglas, die für Bruchfestigkeit und Splitterschutz sorgt. Verwendet wird solches Glas für diverse Anwendungen inklusive Autofenstern, Glastüren und Duschwänden.[94]
Aromen und Duftstoffe
[Bearbeiten | Quelltext bearbeiten]Acetaldehyd wird als Aromastoff verwendet.[95] Citronellal wird als Duftstoff beispielsweise in Seife und Waschmitteln eingesetzt. Citral wird selbst als Duftstoff eingesetzt, aber auch zu Acetalen weiterverarbeitet, die ebenfalls als Duftstoffe dienen. Längerkettige Alkanale wie Octanal werden insbesondere als Duftstoffe für Zitrusnoten verwendet. Phenylacetaldehyd hat einen Duft nach Rosen oder Hyazinthen, (E)-2-Hexenal einen blumigen Duft.[1]
Sonstige Verwendung
[Bearbeiten | Quelltext bearbeiten]Formaldehyd wird weit überwiegend in der Herstellung von anderen Chemikalien und Kunststoffen verwendet (siehe oben). Die wichtigste Anwendung ohne Weiterverarbeitung ist als Desinfektions- und Konservierungsmittel, beispielsweise im medizinischen Bereich.[85] In der Medizin werden Formaldehyd und Glutaraldehyd als Flächen- und Instrumentendesinfektionsmittel eingesetzt. Beide Aldehyde haben eine gute Wirksamkeit gegen viele verschiedene Mikroorganismen. Insbesondere unbehüllte Viren und sporenbildende Bakterien (z. B. Milzbrand), die nur wenigen Desinfektionsmitteln zugänglich sind, können so erreicht werden. Da Aldehyde irritierend auf Haut und Schleimhäute wirken und gelegentlich Allergien auslösen, muss mit diesen Mitteln sorgfältig umgegangen werden.[96] Formaldehyd selbst wird als Konservierungsmittel in Kosmetika praktisch nicht mehr verwendet. Stattsdessen kommen Formaldehyd-Abspalter, beispielsweise 2-Brom-2-nitropropan-1,3-diol, zum Einsatz, die länger wirken, aber nur eine geringe Konzentration an Formaldehyd erzeugen.[97] Eine standardmäßig als Fixierungsmittel verwendete Lösung ist 10%iges Formalin, was einer wässrigen Lösung mit 3,7 % Formaldehyd und 1 % Methanol entspricht.[98]
Nachweise
[Bearbeiten | Quelltext bearbeiten]Obwohl die NMR-Spektroskopie und anderer spektroskopischer Methoden chemische Nachweise funktioneller Gruppen zu Seltenheiten hat werden lassen, wird diese in Spezialfällen noch verwendet.[6] Aldehyde können mit der Tollensprobe, der Fehlingprobe und der Schiffsche Probe nachgewiesen werden.[99] Der Nachweis per Tollens- und Fehlingprobe beruht darauf, dass sie (im Gegensatz zu Ketonen) schon mit schwachen Oxidationsmitteln zu Carbonsäuren oxidieren.[15] Aromatische Aldehyde sind sich in ihrem chemischen Verhalten sehr ähnlich, sodass die Bestimmung einzelner Aldehyde mit den klassischen analytischen Methoden schwierig ist, wenn mehrere in der Probe vorhanden sind.[100]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Fritz Ullmann: Ullmann's encyclopedia of industrial chemistry. 5th ed Auflage. Band 1. VCH, Weinheim Deerfield beach (Fla.) 1985, ISBN 3-527-20101-7.
- ↑ Ira Remsen: Justus von Liebig, His Life and Work (1803-1873). By W. A. Shenstone, F. I. C., Lecturer on Chemistry in Clifton College. New York, Macmillan & Co. 1895. Pp. 220 + vi. In: Science. Band 3, Nr. 53, 3. Januar 1896, S. 62–63, doi:10.1126/science.3.53.24.
- ↑ Holde Puchtler, Susan N. Meloan, Barbara R. Brewton: On the history of basic fuchsin and aldehyde-schiff reactions from 1862 to 1935. In: Histochemistry. Band 41, Nr. 3, 1975, S. 185–194, doi:10.1007/BF00497682.
- ↑ Chérifa Boulechfar, Hana Ferkous, Amel Delimi, Amel Djedouani, Abdesalem Kahlouche, Abir Boublia, Ahmad S. Darwish, Tarek Lemaoui, Rajesh Verma, Yacine Benguerba: Schiff bases and their metal Complexes: A review on the history, synthesis, and applications. In: Inorganic Chemistry Communications. Band 150, April 2023, S. 110451, doi:10.1016/j.inoche.2023.110451.
- ↑ Willi Melber, Peter Böhm: Einführung in die Nomenklatur organisch-chemischer Verbindungen für Studium und Berufsausbildung. Springer Berlin Heidelberg, 1987, ISBN 3-642-93370-X, S. 75 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g Kurt Peter C. Vollhardt, Neil Eric Schore: Organische Chemie. Haupbd. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2020, ISBN 978-3-527-34582-3.
- ↑ Karl-Heinz Hellwich: Chemische Nomenklatur: die systematische Benennung organisch-chemischer Verbindungen; ein Lehrbuch für Pharmazie- und Chemiestudenten. 3., überarb. Auflage. Govi-Verl, Eschborn 1998, ISBN 3-7741-1095-6.
- ↑ Karl-Heinz Hellwich: Chemische Nomenklatur: die systematische Benennung organisch-chemischer Verbindungen; ein Lehrbuch für Pharmazie- und Chemiestudenten. 3., überarb. Auflage. Govi-Verl, Eschborn 1998, ISBN 3-7741-1095-6, S. 94.
- ↑ Richard Cammack: Oxford dictionary of biochemistry and molecular biology. Second revised ed Auflage. Oxford university press, Oxford 2006, ISBN 0-19-852917-1.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. 4. Auflage. International Union of Pure and Applied Chemistry (IUPAC), Research Triangle Park, NC 2019, doi:10.1351/goldbook.a00208.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. 4. Auflage. International Union of Pure and Applied Chemistry (IUPAC), Research Triangle Park, NC 2019, doi:10.1351/goldbook.k03386.
- ↑ Ameisensäure. In: Spektrum.de Lexikon der Chemie. Abgerufen am 5. Juni 2024.
- ↑ Paula Y. Bruice: Organische Chemie - Studieren kompakt (= Always learning). 5., aktualisierte Auflage. Pearson Studium, München 2011, ISBN 978-3-86894-102-9, S. 673.
- ↑ Paula Y. Bruice: Organische Chemie - Studieren kompakt (= Always learning). 5., aktualisierte Auflage. Pearson Studium, München 2011, ISBN 978-3-86894-102-9, S. 711.
- ↑ a b c d Adalbert Wollrab: Organische Chemie Eine Einführung für Lehramts- und Nebenfachstudenten. Springer-Verlag, 2013, ISBN 978-3-662-09137-1, S. 402 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ George Socrates: Infrared and Raman Characteristic Group Frequencies. Wiley, 2004, ISBN 0-470-09307-2, S. 124 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-1 – 3-523.
- ↑ Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 565, ISBN 3-342-00280-8.
- ↑ Mikko Salaspuro: Acetaldehyde and gastric cancer. In: Journal of Digestive Diseases. Band 12, Nr. 2, April 2011, S. 51–59, doi:10.1111/j.1751-2980.2011.00480.x.
- ↑ Pergamon titles of related interest. In: Enzymes Dependent on Pyridoxal Phosphate and Other Carbonyl Compounds As Cofactors. Elsevier, 1991, ISBN 978-0-08-040820-0, S. 1.
- ↑ Oliver P. Ernst, David T. Lodowski, Marcus Elstner, Peter Hegemann, Leonid S. Brown, Hideki Kandori: Microbial and Animal Rhodopsins: Structures, Functions, and Molecular Mechanisms. In: Chemical Reviews. Band 114, Nr. 1, 8. Januar 2014, S. 126–163, doi:10.1021/cr4003769, PMID 24364740, PMC 3979449 (freier Volltext) – (acs.org [abgerufen am 20. Oktober 2024]).
- ↑ Claus Wasternack: Oxylipins: Biosynthesis, Signal Transduction and Action. In: Annual Plant Reviews Volume 24: Plant Hormone Signaling. 1. Auflage. Wiley, 2006, ISBN 978-1-4051-3887-1, S. 189–192, doi:10.1002/9780470988800.ch7.
- ↑ Kenji Matsui: Green leaf volatiles: hydroperoxide lyase pathway of oxylipin metabolism. In: Current Opinion in Plant Biology. Band 9, Nr. 3, Juni 2006, S. 274–280, doi:10.1016/j.pbi.2006.03.002.
- ↑ Nicholas J. Lawrence: Aldehydes and ketones. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 10, 1998, S. 1739–1750, doi:10.1039/a800646f.
- ↑ a b c d Gabriel Tojo, Marcos Fernandez: Oxidation of alcohols to aldehydes and ketones: a guide to current common practice (= Basic reactions in organic synthesis). Springer, New York, NY 2006, ISBN 0-387-23607-4.
- ↑ a b c d Francis A. Carey, Richard J. Sundberg: Advanced organic chemistry. B: Reactions and synthesis. Corr. 2. print Auflage. Springer, New York 2008, ISBN 978-0-387-68354-6.
- ↑ Sivaraman Balasubramaniam, Indrapal Aidhen: The Growing Synthetic Utility of the Weinreb Amide. In: Synthesis. Band 2008, Nr. 23, Dezember 2008, S. 3707–3738, doi:10.1055/s-0028-1083226.
- ↑ S. Chandrasekhar, M. Suresh Kumar, B. Muralidhar: One pot conversion of car☐ylic acids to aldehydes with DIBAL-H. In: Tetrahedron Letters. Band 39, Nr. 8, Februar 1998, S. 909–910, doi:10.1016/S0040-4039(97)10688-8.
- ↑ Kurt Peter C. Vollhardt, Neil Eric Schore: Organische Chemie. Hauptbd. 5. Auflage. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32754-6.
- ↑ Siegfried R. Waldvogel: Strategic Applications of Named Reactions in Organic Synthesis. Background and Detailed Mechanisms. By Laszlo Kürti and Barbara Czako. In: Angewandte Chemie International Edition. Band 44, Nr. 32, 12. August 2005, S. 5005–5006, doi:10.1002/anie.200585304.
- ↑ Andrew Burrows, John Holman, Simon Lancaster, Andrew Parsons, Tina Overton, Gwen Pilling, Gareth Price: Chemistry3. Oxford University Press, 2021, ISBN 978-0-19-882998-0, S. 1059 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Joachim Buddrus: Grundlagen der organischen Chemie. De Gruyter, 2020, ISBN 978-3-11-158631-1, S. 452 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans P. Latscha, Helmut A. Klein: Organische Chemie. Springer Berlin Heidelberg, 2013, S. 203 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Thieme, 2005, ISBN 3-13-541505-8, S. 319 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Stanley R. Sandler, Wolf Karo: Organic functional group preparations. In: Organic Chemistry - A Series of Monographs. 2nd ed Auflage. v. 12. Academic Press, New York 1983, ISBN 0-12-618601-4, S. 305.
- ↑ Elias J. Corey, Norman W. Gilman, B. E. Ganem: New methods for the oxidation of aldehydes to carboxylic acids and esters. In: Journal of the American Chemical Society. Band 90, Nr. 20, September 1968, S. 5616–5617, doi:10.1021/ja01022a059.
- ↑ Liyuan Lan, Shuai Huang, Yongguo Liu, Baoguo Sun, Hongyu Tian: Preparation and odor characteristics of nitriles derived from aldehydes. In: Flavour and Fragrance Journal. Band 35, Nr. 4, Juli 2020, S. 425–434, doi:10.1002/ffj.3581.
- ↑ Dylan J. Quinn, Graham J. Haun, Gustavo Moura-Letts: Direct synthesis of nitriles from aldehydes with hydroxylamine-O-sulfonic acid in acidic water. In: Tetrahedron Letters. Band 57, Nr. 34, August 2016, S. 3844–3847, doi:10.1016/j.tetlet.2016.07.047.
- ↑ Antonella Leggio, Emilia Lucia Belsito, Sonia Gallo, Angelo Liguori: One-pot conversion of aldehydes to nitriles mediated by TiCl 4. In: Tetrahedron Letters. Band 58, Nr. 15, April 2017, S. 1512–1514, doi:10.1016/j.tetlet.2017.03.007.
- ↑ Cheves. Walling, Michael J. Mintz: Positive Halogen Compounds. XIII. t-Butyl Hypochlorite Chlorination of Ethers, Aldehydes, and Other Molecules with Polar Substituents. In: Journal of the American Chemical Society. Band 89, Nr. 6, März 1967, S. 1515–1519, doi:10.1021/ja00982a040.
- ↑ Nitin D. Arote, Krishnacharya G. Akamanchi: Direct conversion of aldehydes to acyl azides using tert-butyl hypochlorite. In: Tetrahedron Letters. Band 48, Nr. 32, August 2007, S. 5661–5664, doi:10.1016/j.tetlet.2007.06.020.
- ↑ Jonathan Clayden, Nick Greeves, Stuart G. Warren: Organic chemistry. 2nd ed Auflage. Oxford University Press, Oxford; New YorK 2012, ISBN 978-0-19-927029-3, S. 130–132.
- ↑ Reinhard Brückner: Advanced organic chemistry: reaction mechanisms (= Advanced organic chemistry series). Harcourt/Academic Press, San Diego 2002, ISBN 0-12-138110-2, S. 307–308.
- ↑ Robert F. Nystrom, Weldon G. Brown: Reduction of Organic Compounds by Lithium Aluminum Hydride. I. Aldehydes, Ketones, Esters, Acid Chlorides and Acid Anhydrides. In: Journal of the American Chemical Society. Band 69, Nr. 5, Mai 1947, S. 1197–1199, doi:10.1021/ja01197a060.
- ↑ Gordon W. Gribble, Ahmed F. Abdel-Magid: Sodium Triacetoxyborohydride. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2007, ISBN 978-0-471-93623-7.
- ↑ Mathias Glatz, Berthold Stöger, Daniel Himmelbauer, Luis F. Veiros, Karl Kirchner: Chemoselective Hydrogenation of Aldehydes under Mild, Base-Free Conditions: Manganese Outperforms Rhenium. In: ACS Catalysis. Band 8, Nr. 5, 4. Mai 2018, S. 4009–4016, doi:10.1021/acscatal.8b00153, PMID 29755828, PMC 5939901 (freier Volltext).
- ↑ C. W. Jung, P. E. Garrou: Dehydrogenation of alcohols and hydrogenation of aldehydes using homogeneous ruthenium catalysts. In: Organometallics. Band 1, Nr. 4, April 1982, S. 658–666, doi:10.1021/om00064a016.
- ↑ William H. Brown, Thomas Poon: Einführung in die Organische Chemie. Band 1. WILEY-VCH, Weinheim 2021, ISBN 978-3-527-34674-5, S. 414.
- ↑ Ender Erdik: Organozinc reagents in organic synthesis (= New directions in organic and biological chemistry). CRC Press, Boca Raton 1996, ISBN 0-8493-9151-2, S. 192.
- ↑ Handbook of reagents for organic synthesis. Wiley, Chichester, West Sussex, UK; New York 1999, ISBN 0-471-97924-4, S. 72.
- ↑ A. L. Wilds: Reduction with Aluminum Alkoxides. In: Organic Reactions. 15. März 2011, S. 179–180, doi:10.1002/0471264180.or002.05.
- ↑ P. Tharmaraj, J. Shakina, R. Sujatha, L. Alphonse: Green Chemistry. AG PUBLISHING HOUSE (AGPH Books), ISBN 978-81-19-15262-9, S. 113 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur; zahlreiche Formeln, Tabellen. 5., überarb. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-541505-8, S. 321.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur; zahlreiche Formeln, Tabellen. 5., überarb. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-541505-8, S. 627–628.
- ↑ N-Heterocyclic carbenes in synthesis. Wiley-VCH; John Wiley [distributor], Weinheim: Chichester 2006, ISBN 3-527-31400-8, S. 281–282.
- ↑ David Kieslich, Jens Christoffers: Cyanide Anions as Nucleophilic Catalysts in Organic Synthesis. In: Synthesis. Band 53, Nr. 19, Oktober 2021, S. 3485–3496, doi:10.1055/a-1499-8943.
- ↑ William Carruthers, Iain Coldham: Modern methods of organic synthesis. 4. ed., 4. printing with corrections. Cambridge University Press, Cambridge 2006, ISBN 0-521-77097-1, S. 457.
- ↑ Michael Smith, Jerry March: March's advanced organic chemistry: reactions, mechanisms, and structure. Eighth edition Auflage. John Wiley, Hoboken, NJ 2020, ISBN 978-1-119-37179-3, Eintrag 19-66.
- ↑ Guangkuan Zhao, Ling‐Zhi Yuan, Mouad Alami, Olivier Provot: Desulfurization of Thioketals into Methylene and Methyl Derivatives: Nickel or not Nickel? In: ChemistrySelect. Band 2, Nr. 33, 21. November 2017, S. 10951–10959, doi:10.1002/slct.201702370.
- ↑ Bo Han, Chunping Ren, Min Jiang, Lipeng Wu: Titanium‐Catalyzed Exhaustive Reduction of Oxo‐Chemicals. In: Angewandte Chemie International Edition. Band 61, Nr. 46, 14. November 2022, doi:10.1002/anie.202209232.
- ↑ Christopher M. Beck, Scott E. Rathmill, You Jung Park, Junyi Chen, Robert H. Crabtree, Louise M. Liable-Sands, Arnold L. Rheingold: Aldehyde Decarbonylation Catalysis under Mild Conditions. In: Organometallics. Band 18, Nr. 25, 1. Dezember 1999, S. 5311–5317, doi:10.1021/om9905106.
- ↑ Volume Editors. In: Comprehensive Organic Functional Group Transformations. Band 1. Elsevier, 1995, ISBN 0-08-044705-8, S. 720–722.
- ↑ Francis A. Carey, Richard J. Sundberg: Advanced organic chemistry. Reactions and synthesis. 4. ed., repr. Springer, New York 2006, ISBN 0-306-46244-3, S. 111–112.
- ↑ Reinhard Brückner, Michael Harmata: Organic mechanisms: reactions, stereochemistry and synthesis. Springer, Berlin 2010, ISBN 978-3-642-03650-7, S. 467–469.
- ↑ László Kürti, Barbara Czakó: Strategic applications of named reactions in organic synthesis: background and detailed mechanisms; 250 named reactions. Nachdr. Auflage. Elsevier Acad. Press, Amsterdam Heidelberg 2009, ISBN 978-0-12-369483-6, S. 212.
- ↑ Comprehensive organic synthesis. Second edition Auflage. Band 1. Elsevier, Amsterdam, Netherlands; Waltham, MA 2014, ISBN 978-0-08-099964-7, S. 518–520.
- ↑ Comprehensive organic synthesis. Second edition Auflage. Band 1. Elsevier, Amsterdam, Netherlands; Waltham, MA 2014, ISBN 978-0-08-099964-7, S. 529.
- ↑ Modern carbonyl olefination. Wiley-VCH, Weinheim 2004, ISBN 3-527-30634-X, S. 18.
- ↑ a b Ian Beadham, Jason Micklefield: Reagents for Carbonyl Methylenation in Organic Synthesis. In: Current Organic Synthesis. Band 2, Nr. 2, S. 231–259, doi:10.2174/1570179053545396.
- ↑ a b c Bernhard Breit: Dithioacetals as an Entry to Titanium-Alkylidene Chemistry: A New and Efficient Carbonyl Olefination. In: Angewandte Chemie International Edition. Band 37, Nr. 4, 2. März 1998, S. 453–456, doi:10.1002/(SICI)1521-3773(19980302)37:4<453::AID-ANIE453>3.0.CO;2-M.
- ↑ Name reactions for homologations. Wiley, Hoboken 2009, ISBN 978-0-470-08507-3, S. 268–269.
- ↑ a b Damien Habrant, Vesa Rauhala, Ari M. P. Koskinen: Conversion of carbonyl compounds to alkynes: general overview and recent developments. In: Chemical Society Reviews. Band 39, Nr. 6, 2010, S. 2007, doi:10.1039/b915418c.
- ↑ E.J. Corey, P.L. Fuchs: A synthetic method for formyl→ethynyl conversion (RCHO→RCCH or RCCR′). In: Tetrahedron Letters. Band 13, Nr. 36, 1972, S. 3769–3772, doi:10.1016/S0040-4039(01)94157-7.
- ↑ Frédéric Eymery, Bogdan Iorga, Philippe Savignac: The Usefulness of Phosphorus Compounds in Alkyne Synthesis. In: Synthesis. Band 2000, Nr. 02, 2000, S. 185–213, doi:10.1055/s-2000-6241.
- ↑ Sabine Bognar, Manuel van Gemmeren: Direct Synthesis of Unsymmetrical Dithioacetals. In: Chemistry – A European Journal. Band 27, Nr. 15, 12. März 2021, S. 4859–4863, doi:10.1002/chem.202004835, PMID 33270274, PMC 8048688 (freier Volltext).
- ↑ Wilfred L. F. Armarego, Christina Li Lin Chai: Purification of laboratory chemicals. 6. ed Auflage. Butterworth-Heinemann, Amsterdam Heidelberg 2009, ISBN 978-1-85617-567-8, S. 65.
- ↑ Walter M. Lauer, Carl M. Langkammerer: The Constitution of the Bisulfite Addition Compounds of Aldehydes and Ketones. In: Journal of the American Chemical Society. Band 57, Nr. 12, Dezember 1935, S. 2360–2362, doi:10.1021/ja01315a007.
- ↑ Jonathan Clayden, Nick Greeves, Stuart G. Warren: Organic chemistry. 2nd ed Auflage. Oxford University Press, Oxford; New YorK 2012, ISBN 978-0-19-927029-3, S. 127–128.
- ↑ Robert J. H. Gregory: Cyanohydrins in Nature and the Laboratory: Biology, Preparations, and Synthetic Applications. In: Chemical Reviews. Band 99, Nr. 12, 8. Dezember 1999, S. 3649–3682, doi:10.1021/cr9902906.
- ↑ Hiroshi Ohno, Atsunori Mori, Shohei Inoue: Lanthanoid(III) Alkoxides as Novel Catalysts for a Rapid Transhydrocyanation from Acetone Cyanohydrin to Aldehydes and Ketones. In: Chemistry Letters. Band 22, Nr. 2, 1. Februar 1993, S. 375–378, doi:10.1246/cl.1993.375.
- ↑ Wayiza Masamba: Petasis vs. Strecker Amino Acid Synthesis: Convergence, Divergence and Opportunities in Organic Synthesis. In: Molecules. Band 26, Nr. 6, 18. März 2021, S. 1707, doi:10.3390/molecules26061707, PMID 33803879, PMC 8003338 (freier Volltext).
- ↑ Acetaldehyde Market Size, Share & Growth Report [Latest]. Abgerufen am 16. Februar 2024 (englisch).
- ↑ M. S. Peters, J. A. Quinn: Pentaerythritol Production Yields. In: Industrial & Engineering Chemistry. Band 47, Nr. 9, September 1955, S. 1710–1713, doi:10.1021/ie50549a016.
- ↑ David E. Lewis: Aleksei Yevgen'evich Chichibabin (1871–1945): A Century of Pyridine Chemistry. In: Angewandte Chemie International Edition. Band 56, Nr. 33, 7. August 2017, S. 9660–9668, doi:10.1002/anie.201611724.
- ↑ a b c Adam W. Franz, Helmut Kronemayer, Daniel Pfeiffer, Roman D. Pilz, Günther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt: Formaldehyde. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2016, ISBN 978-3-527-30673-2, S. 1–34, doi:10.1002/14356007.a11_619.pub2.
- ↑ a b c Butyraldehyde Market Size, Share, Growth & Forecast, 2032. Abgerufen am 15. Februar 2024.
- ↑ N-Butanol Market Size, Growth, Analysis & Forecast, 2032. Abgerufen am 15. Februar 2024.
- ↑ 2-Ethylhexanol Market Size, Growth, Industry Report. Abgerufen am 15. Februar 2024.
- ↑ Sandro Nalli, Owen J. Horn, Adam R. Grochowalski, David G. Cooper, Jim A. Nicell: Origin of 2-ethylhexanol as a VOC. In: Environmental Pollution. Band 140, Nr. 1, März 2006, S. 181–185, doi:10.1016/j.envpol.2005.06.018.
- ↑ Hydrogen Cyanide. In: Synthetic Nitrogen Products. Kluwer Academic Publishers, Boston 2005, ISBN 0-306-48225-8, S. 347–360, doi:10.1007/0-306-48639-3_19.
- ↑ Thomas Willke: Methionine production—a critical review. In: Applied Microbiology and Biotechnology. Band 98, Nr. 24, Dezember 2014, S. 9893–9914, doi:10.1007/s00253-014-6156-y.
- ↑ Formaldehyde Market Size, Growth, Analysis & Forecast, 2032. Abgerufen am 15. Februar 2024.
- ↑ A Nuryawan, I Risnasari, T Sucipto, A Heri Iswanto, R Rosmala Dewi: Urea-formaldehyde resins: production, application, and testing. In: IOP Conference Series: Materials Science and Engineering. Band 223, Juli 2017, S. 012053, doi:10.1088/1757-899X/223/1/012053.
- ↑ Christian Carrot, Amine Bendaoud, Caroline Pillon: Polyvinyl Butyral. In: Plastics Engineering. CRC Press, 2015, ISBN 978-1-4665-7722-0, S. 89–137.
- ↑ Alexander T. Cartus, Dirk W. Lachenmeier, Sabine Guth, Angelika Roth, Matthias Baum, Patrick Diel, Gerhard Eisenbrand, Barbara Engeli, Michael Hellwig, Hans‐Ulrich Humpf, Hans‐Georg Joost, Sabine E. Kulling, Alfonso Lampen, Doris Marko, Pablo Steinberg, Wim Wätjen, Jan G. Hengstler, Angela Mally: Acetaldehyde as a Food Flavoring Substance: Aspects of Risk Assessment. In: Molecular Nutrition & Food Research. Band 67, Nr. 23, Dezember 2023, doi:10.1002/mnfr.202200661.
- ↑ Werner Köhler, Rainer Ansorg: Medizinische Mikrobiologie. Elsevier, Urban & Fischer Verlag, 2001, ISBN 3-437-41640-5, S. 92.
- ↑ Anton C. De Groot, Margo Veenstra: Formaldehyde‐releasers in cosmetics in the USA and in Europe. In: Contact Dermatitis. Band 62, Nr. 4, April 2010, S. 221–224, doi:10.1111/j.1600-0536.2009.01623.x.
- ↑ Rooban Thavarajah, VidyaKazhiyur Mudimbaimannar, Joshua Elizabeth, UmadeviKrishnamohan Rao, Kannan Ranganathan: Chemical and physical basics of routine formaldehyde fixation. In: Journal of Oral and Maxillofacial Pathology. Band 16, Nr. 3, 2012, S. 400, doi:10.4103/0973-029X.102496, PMID 23248474, PMC 3519217 (freier Volltext).
- ↑ Stefanie Federle, Stefanie Hergesell, Sebastian Schubert: Die Stoffklassen der organischen Chemie. Springer Berlin Heidelberg, 2017, ISBN 978-3-662-54968-1, S. 186 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ludwig Acker, Gerhard Bressau, Georg Benedikt Brubacher, Karl Maximilian Bürger, Stefan Diemair, Willibald Diemair, Klaus Doerffel, Rudi Franck, Hansfriedel Gudjons, Paul Joppien, Ludwig Kotter, Ernst Kröller, Hermvn Libert, Helmut Mühlschlegel, Titus Niedermaier, Konrad Pfeilsticker, Gerhard Pfleiderer, Wilhelm Postel, Hanspeter P. Probst, W. Rödder, Werner Schäfer, Leopold Schmid, Erich Schneider, Artur Seher, Hans Sommer, Helmut Thaler, Jean Paul Vuilleumier, Herbert Woidich: Analytik der Lebensmittel Nachweis und Bestimmung von Lebensmittel-Inhaltsstoffen. Springer-Verlag, 2013, ISBN 978-3-642-46069-2, S. 648 (books.google.com).