Benutzer:MAtheDA/Spielwiese/Asinger-Reaktion
Die Asinger-Reaktion oder auch Asinger-Thiazolin-Synthese ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie wurde durch Friedrich Asinger während seines Zwangsaufenthaltes in der Sowjetunion – im Rahmen der Deportation deutscher Wissenschaftler (Aktion Ossoawiachim) – entdeckt[1]. Die Asinger-Reaktion zählt zu den Mehrkomponentenreaktionen und wird auch als A-4CR (Abkürzung für Asinger-Vierkomponentenreaktion) klassifiziert: Aus elementarem Schwefel, einem α-substituierbarem Keton oder Aldehyd, einer weiteren Carbonylkomponente und Ammoniak, entstehen in guter Ausbeute 3-Thiazoline[2] oder Gemische mehrerer 3-Thiazoline.


Alternativen
[Bearbeiten | Quelltext bearbeiten]Alternativ können 3-Thiazoline auch aus α-Mercaptoaldehyden oder α-Mercaptoketonen, einer Oxokomponente (Aldehyd oder Keton) und Ammoniak entstehen.[3]. Damit die Reaktion ablaufen kann muss am α-Kohlenstoffatom mindestans ein H-Atom vorhanden sein (sowohl bei der Reaktion mit einem Aldehyd als auch bei der mit einem Keton)
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Beispielhaft wird der Mechanismus mit einem Aldehyd dargestellt, alternativ kann die Reaktion auch mit einem Keton stattfinden. Diese verläuft analog.
Erster Schritt : Durch eine Thiolierungsreaktion bildet sich intermediär ein α-Mercaptoketon. Bei der α-Thiolierung wird basenkatalysiert - hier im Speziellen aminkatalysiert (durch den Einsatz von Ammoniak)- das H-Atom in α-Stellung ersetzt. Die Reaktion wird durch ein Aldehyd eingeleitet.
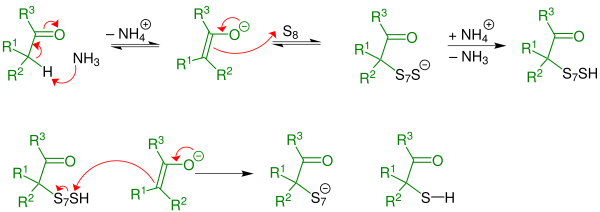
Zweiter Schritt: Das α-Mercaptoketon reagiert irreversibel mit Aldehyd und Ammoniak zum 3-Thiazolin. Das Aldeyd tritt hier als Oxokomponente in die Ringschlussreaktion ein. Es handelt sich um eine α-Amino-alkylierung einer SH-aciden Verbindung mit folgender cyclischer Stabilisierung durch Wasseraustritt.

Varianten
[Bearbeiten | Quelltext bearbeiten]Eine universellere Variante der Asinger-Reaktion wurde bei der Degussa AG entwickelt. Dabei reagiert eine α-halogenierte Carbonyl-Komponente mit NaHS und generiert in situ eine α-Mercapto-Carbonyl-Komponente (Thiol), welche direkt mit Aldehyden oder Ketonen und Ammoniak zu 3-Thiazolinen weiterreagieren[4]:

In der chemischen Industrie wurden, basierend auf der Asinger-Reaktion, mehrstufige Verfahren zur Herstellung des Arzneistoffes D-Penicillamin[5] und von DL-Cystein[6] entwickelt und im technischen Maßstab betrieben.

Die Synthese von 3-Oxazolinen (Sauerstoff-Analoga der 3-Thiazoline) erfolgt nach einer Variante der Asinger-Reaktion aus 2-Halogenaldehyden, Ammoniak, Natronlauge und einer Oxokomponente (meist ein Keton).[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Friedrich Asinger: Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone, Angewandte Chemie 68 (1956) 413.
- ↑ Organikum, Wiley-VCH Verlag GmbH, 23. Auflage, 2009, S. 434, ISBN 978-3-527-32292-3.
- ↑ Friedrich Asinger und Manfred Thiel: Einfache Synthesen und chemisches Verhalten neuer heterocyclischer Ringsysteme, Angewandte Chemie 70 (1958) 667–683.
- ↑ Karlheinz Drauz, Hans Günter Koban, Jürgen Martens und Werner Schwarze: Phosphonic and Phosphinic Acid Analogs of Penicillamine, Liebigs Annalen der Chemie 1985, 448-452.
- ↑ Wolfgang Weigert, Heribert Offermanns und Paul Scherberich : D-Penicillamin - Herstellung und Eigenschaften, Angewandte Chemie 87 (1975) 372-378 ; Angewandte Chemie-International Edition 14 (1975) 330-336.
- ↑ Jürgen Martens, Heribert Offermanns und Paul Scherberich : Eine einfache Synthese von racemischem Cystein, Angewandte Chemie 93 (1981) 680; Angewandte Chemie-International Edition 20 (1981) 668.
- ↑ Maya Weber, Jürgen Jakob und Jürgen Martens: Synthese und Reaktivität von 3-Oxazolinen, Liebigs Annalen der Chemie 1992, 1-6.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Friedrich Asinger: Chemiker-Treffen Salzburg: Über die einfache und ergiebige Synthese von Thiazolinen. In: Angewandte Chemie. 68, 1956, S. 376–389, doi:10.1002/ange.19560681109.
- Friedrich Asinger: Ueber die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone. In: Angewandte Chemie. 68, 1956, S. 413–413, doi:10.1002/ange.19560681209.
- Imre Schlemminger, Hans-Hermann Janknecht, Wolfgang Maison, Wolfgang Saak, Juergen Martens: Synthesis of the first enantiomerically pure 3-thiazolines via Asinger reaction. In: Tetrahedron Letters 41, 2000, S. 7289–7292,doi:10.1016/S0040-4039(00)01266-1.
- Jürgen Martens und Hans-Herrmann Janknecht: Synthese von 2-tert-Butyl-3-thiazolinen und Untersuchungen zur Diastereoselektivität der Asinger-Reaktion. In: Sulfur Letters. 11, 1990, S. 263–270.
[[Kategorie:Namensreaktion]] [[Kategorie:Mehrkomponentenreaktion]] [[en:Asinger reaction]] [[zh:Asinger反应]] 500p </nowiki> </nowiki> </nowiki>