Chrom(IV)-chlorid
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
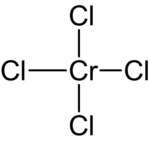
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Chrom(IV)-chlorid | ||||||||||||
| Andere Namen |
Chromtetrachlorid | ||||||||||||
| Summenformel | CrCl4 | ||||||||||||
| Kurzbeschreibung |
brauner Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 193,807 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Chrom(IV)-chlorid, auch Chromtetrachlorid, ist eine instabile chemische Verbindung der Elemente Chrom und Chlor.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Chrom(IV)-chlorid kann durch Reaktion von Chrom(III)-chlorid mit Chlor bei hohen Temperaturen gewonnen werden:[3]
Aufgrund der Dissoziation von Chrom(III)-chlorid bei dieser Temperatur entsteht Chlor(IV)-chlorid auch über die folgende Reaktion, bei der auch Chrom(II)-chlorid gebildet wird:[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chrom(IV)-chlorid liegt als brauner Feststoff vor. Es zerfällt bei einer Temperatur von über −80 °C in Chrom(III)-chlorid und Chlor.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b P. Рипан, И. Четяну: Неорганическая химия. 2. Химия металлов. Moskau 1972, S. 231.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b V. Plies: Massenspektrometrische Untersuchungen der Gasphase über CrCI3, und CrCI3/CI2. In: Zeitschrift für anorganische und allgemeine Chemie. Band 556, Nr. 1. Johann Ambrosius Barth Verlag, Leipzig 1988, S. 120–128, doi:10.1002/zaac.19885560112.

