Eaton-Reagenz
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eaton-Reagenz | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CH4O8P2S | ||||||||||||||||||
| Kurzbeschreibung |
bewegliche farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 238,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,500 g·cm−3 [2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Diethylether, Ethanol, Acetonitril und Dichlormethan, wenig löslich in Toluol und Hexan[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eaton-Reagenz (engl. Eaton’s reagent) ist eine im Mittel 7,7 gewichtsprozentige Lösung von Phosphorpentoxid (P2O5) in Methansulfonsäure (CH3SO3H). Aus den Komponenten entsteht eine bewegliche, klare Flüssigkeit, die gute Lösungsmitteleigenschaften besitzt und als wasserentziehendes Reaktionsmedium wesentlich leichter handhabbar ist als Polyphosphorsäure.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Im Jahr 1973 beschrieben Philip Eaton und Mitarbeiter ein 1:10-Gemisch aus festem Phosphorpentoxid und Methansulfonsäure,[1] das bei Raumtemperatur unter Rühren und schwacher Exothermie eine klare Lösung bildet.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Eaton-Reagenz ist eine klare, farblose und ätzende Flüssigkeit, die in sehr unpolaren Lösungsmitteln, wie z. B. Alkanen und Aromaten praktisch unlöslich, in vielen organischen Lösungsmitteln gut löslich ist. Mit Wasser erfolgt rasche Zersetzung unter Bildung von Polyphosphorsäure (Hn+2PnO3n+1) bzw. Phosphorsäure (H3PO4). Mit einem P2O5-Gehalt zwischen 7,2 bis 8,5 % ist Eaton-Reagenz bereits bei Raumtemperatur wesentlich niedrigviskoser als Polyphosphorsäure und daher viel leichter dosier- und rührbar.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Die starke wasserentziehende Wirkung von Phosphorpentoxid (und Polyphosphorsäure) – die man sich in der Chemie als Trocknungsmittel für wasserhaltige Feststoffe zunutze macht – zeigt sich auch in Wasserabspaltungsreaktionen, wie z. B. der Esterbildung aus Carbonsäuren und Alkoholen[4] oder in Namensreaktionen, wie der Fischer-Indol-Synthese, der Beckmann-Umlagerung, der Schmidt-Reaktion und anderen. Als aktives Agens wird ein gemischtes Anhydrid vermutet, das neben dem nachgewiesenen Methansulfonsäureanhydrid[5] in der Lösung vorliegt. Die Lösung von P2O5 in MeSO3H erzeugt ein einfach zugängliches, preisgünstiges, in der Reaktionsführung und Aufarbeitung sicher handhabbares und umweltschonendes Reagenz mit guten Lösungseigenschaften für viele organische Verbindungen.
Säureinduzierte Umlagerungen mit Eaton-Reagenz
[Bearbeiten | Quelltext bearbeiten]Die Umlagerung des Aromastoffs γ-Decalacton unter Wasserabspaltung in den Geruchsstoff Dihydrojasmon erfolgt mithilfe von Eaton-Reagenz bei Raumtemperatur fast quantitativ (92 % Ausbeute).[1]

Bei der Beckmann-Umlagerung von Cyclohexanonoxim in ε-Caprolactam bei 100 °C wird ebenfalls fast quantitative Ausbeute erzielt.[1]

Cyclisierungen mit Eaton-Reagenz
[Bearbeiten | Quelltext bearbeiten]Beispielhaft für eine Cyclisierung entsteht aus Phenol und Meldrumsäure in einer Pechmann-Reaktion 4-Hydroxycumarin in einer Gesamtausbeute von 69 %.[6]
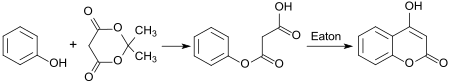
Ringsubstituierte N-Methylphenylessigsäureamide können einfach und effizient in einer Pictet-Spengler-Reaktion mit Paraformaldehyd und Eaton-Reagenz zu Tetrahydrochinolin-3-onen cyclisiert werden.[7]
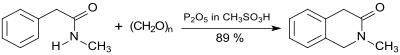
Von den nahe verwandten 4-Chinolonen leiten sich früher häufig verordnete Chinolon-Antibiotika ab, die auch durch Knoevenagel-Reaktion von substituierten Anilinen mit Methoxymethylenmalonsäuredimethylester (22398-14-7)[8] zu den entsprechenden Enaminen und anschließende Cyclisierung mit Eaton-Reagenz (ER) in hohen Ausbeuten (>90 %) erhalten werden.[9]

Durch die auch als „Cyclodehydratisierung“ bezeichnete Reaktion mit Eaton-Reagenz (ER) sind Benzofurane durch Umsetzung mit 2-Phenoxyketonen – aus leicht zugänglichen α-Bromketonen[10] und Phenolen – in guten Ausbeuten (bis > 90 %) erhältlich.[11]

Bereits bei Raumtemperatur werden in einer Mehrkomponentenreaktion aus Aldehyden, 1,3-Dicarbonylverbindungen wie z. B. Acetessigester oder Ketonen und Harnstoff 3,4-Dihydropyrimidin-2(1H)-one (DHPM) – so genannte Biginelli-Verbindungen – gebildet, die wertvolle Vorstufen für Arzneistoffe darstellen.[12]

Polymere mit Eaton-Reagenz
[Bearbeiten | Quelltext bearbeiten]Polyetheretherketone (PEEK) können z. B. aus Diphenylether-4,4′-dicarbonsäure (2215-89-6) und 1,4-Diphenoxybenzol (3061-36-7) durch mehrstündiges Erhitzen in Eaton-Reagenz in quantitativer Ausbeute und mit hoher intrinsischer Viskosität, d. h. hohem Molgewicht gebildet werden.[13]

Umfangreiche Arbeiten wurden über die Bildung von Polybenzimidazolen, z. B. durch direkte Synthese aus Dicarbonsäuren und Tetraaminen beim kurzzeitigen Erhitzen in Eaton-Reagenz (ER) durchgeführt.[14]

Das so erhaltene PBI zersetzt sich erst bei 470 °C an der Luft und bei 540 °C unter Stickstoff.
Mit Phosphorsäure durchtränktes („dotiertes“) PBI wird seit längerem als möglicher Ersatz für das Sulfonsäuregruppen tragende Fluorcopolymer Nafion in Polymerelektrolytbrennstoffzellen untersucht. Einbau von Trifluormethylgruppen verbessert in der Regel Löslichkeit, Verarbeitbarkeit und thermische und dielektrische Eigenschaften von Polymeren. Die Reaktion von trifluormethylgruppenhaltigen Dicarbonsäuren mit 3,3′-Diaminobenzidin in Gegenwart von Eaton-Reagenz (ER) erzeugt PBI-Varianten, die als Protonenaustauschmembranen in Brennstoffzellen (engl. proton-exchange membrane fuel cells, PEMFC) in Frage kommen könnten.[15]

Auch PBI-Varianten zum Aufbau von Gastrennmembranen für H2/CO2-Gemische bei erhöhten Temperaturen können bei der wasserabspaltenden Polykondensation mittel Eaton-Reagenz von sulfongruppenhaltigen Tetraaminen (3,3‘,4,4‘-Tetraaminodiphenylsulfon TADPS) mit Isophthalsäure erhalten werden.[16]

Eine größere Zahl säurekatalysierter Umlagerungs- und Cyclisierungsreaktionen unter Zuhilfenahme von Eaton-Reagenz ist in der neueren Literatur beschrieben.[17]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d P.E. Eaton, G.R. Carlson, J.T. Lee: Phosphorus pentoxide-methanesulfonic acid, A convenient alternative to polyphosphoric acid. In: J. Org. Chem. Band 38, Nr. 23, 1973, S. 4071–4073, doi:10.1021/jo00987a028.
- ↑ a b c Lisa A. Dixon: Phosphorus(V)Oxide – Methanesulfonic Acid. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rp160.
- ↑ a b Datenblatt Eaton’s Reagent bei Sigma-Aldrich, abgerufen am 26. Juli 2021 (PDF).
- ↑ A. Banerjee, S. Sengupta, M.M. adak, G.C. Banerjee: Use of phosphorus pentoxide: Esterification of organisc acids. In: J. Org. Chem. Band 48, Nr. 18, 1983, S. 3106–3108, doi:10.1021/jo00166a036.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Methansulfonsäureanhydrid: CAS-Nr.: 7143-01-3, EG-Nr.: 230-442-1, ECHA-InfoCard: 100.027.675, PubChem: 81560, ChemSpider: 73591, Wikidata: Q2849892.
- ↑ S.-J. Park, J.-C. Lee, K.-I. Lee: A facile synthesis of 4-hydroxycoumarin and 4-hydroxy-2-quinolinone derivatives. In: Bull. Korean Chem. Soc. Band 28, Nr. 7, 2007, S. 1203–1205, doi:10.5012/BKCS.2007.28.7.1203.
- ↑ Q. Liang, L.U. Ulysse, M.D. McLaws, D.K. Keefe, P.R. Guzzo, B.P. Haney: Preparation of tetrahydroisoquinoline-3-ones via cyclization of phenyl acetamides using Eaton’s reagent In: Organic Syntheses. 89, 2012, S. 44, doi:10.15227/orgsyn.089.0044 (PDF).
- ↑ Patent DE3927761C2: Verfahren zur Herstellung von Alkoxyalkylidenmalonsäureestern. Angemeldet am 23. August 1989, veröffentlicht am 27. November 1997, Anmelder: Hüls AG, Erfinder: F.-A. von Itten, K.-D. Steffen.
- ↑ D. Zewge, C.-Y. Chen, C. Deer, P.G. Dormer, D.L. Hughes: A mild and efficient synthesis of 4-quinolones and quinolone heterocycles. In: J. Org. Chem. Band 72, Nr. 11, 2007, S. 4276–4279, doi:10.1021/jo070181o.
- ↑ R. Rammurthy, P. Swamy, M. Naresh, K. Srujana, C. Durgaiah, G.K. Sai, N. Narender: A new and versatile one-pot strategy to synthesize alpha-bromoketones from secondary alcohols using ammonium bromide and oxone. In: New J. Chem. Band 41, Nr. 10, 2017, S. 3710–3714, doi:10.1039/C7NJ00052A.
- ↑ Z. Ma, M. Zhou, L. Ma, M. Zhang: Synthesis of benzofurans from the cyclodehydration of α-phenoxy ketones mediated by Eaton’s reagent. In: J. Chem. Res. Band 44, Nr. 7–8, 2020, S. 426–436, doi:10.1177/1747519820907244.
- ↑ A. Borse, M. Patil, N. Patil, R. Shinde: A green, expeditious, one-pot synthesis of 3,4-dihydropyrimidin-2(1H)-ones using a mixture of phosphorus pentoxide-methanesulfonic acid at ambient temperature. In: ISRN Org. Chem. 2012, S. 415645, doi:10.5402/2012/415645.
- ↑ M. Ueda, M. Sato: Synthesis of aromatic poly(etherketones). In: Macromolecules. Band 20, Nr. 11, 1987, S. 2675–2678, doi:10.1021/ma00177a007.
- ↑ M. Ueda, M. Sato, A. Mochizuki: Poly(benzimidazole) synthesis by direct reaction of diacids and tetramine. In: Macromolecules. Band 18, Nr. 12, 1985, S. 2723–2726, doi:10.1021/ma00154a060.
- ↑ X. Li, G.Qian, X. Chen, B. C. Benicewicz: Synthesis and characterization of a new fluorine-containing polybenzimidazole (PBI) for proton-conducting membranes in fuel cells. In: Fuel Cells. Band 13, Nr. 5, 2013, S. 832–842, doi:10.1002/fuce.201300054.
- ↑ H. Borjigin, K.A. Stevens, R. Liu, J.D. Moon, A.T. Shaver, S. Swinnea, B.D. Freeman, J.S. Riffle, J.E. McGrath: Synthesis and characterization of polybenzimidazoles derived from tetraaminodiphenylsulfone for high temperature gas separation membranes. In: Polymer. Band 71, 2015, S. 135–142, doi:10.1016/j.polymer.2015.06.021.
- ↑ S. Thimmaiah, M. Ningegowda, N.S. Shivananju, R. Ningegowda, R. Siddaraj, B.S. Priya: Eaton’s reagent catalysed alacritous synthesis of 3-benzazepinones. In: Eur. J. Chem. Band 7, Nr. 4, 2016, S. 391–396, doi:10.5155/eurjchem.7.4.391-396.1477.

