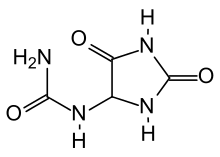
Allantoin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Allantoin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H6N4O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 158,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
~1,7 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,96 (25 °C)[3] | |||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (5,7 g·l−1 bei 25 °C), fast unlöslich in Ethanol[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Das Allantoin ist bei verschiedenen Tierarten, vor allem bei Säugetieren, neben der Harnsäure ein primäres Endprodukt des Abbaus von Nukleinsäuren, speziell von Purinbasen.[5]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Das Allantoin wurde um das Jahr 1800 von Buniva und Louis-Nicolas Vauquelin in der Körperflüssigkeit, welche die Allantois von Kühen ausfüllt, entdeckt und hat davon seinen Namen.[6] Später wurde die Verbindung aus dem Harn junger Kälber isoliert und von Friedrich Wöhler, in Kooperation mit Justus Liebig, untersucht.[7] Diese Forscher erkannten erstmals den Zusammenhang mit der Harnsäure, aus der sie Allantoin durch Oxidation mit Bleidioxid erhielten.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Allantoin ist ein in manchen heimischen Pflanzen (besonders im Beinwell) enthaltener Wirkstoff. Vor allem in Schwarzwurzel, aber auch in Weizenkeimlingen, Sojakeimlingen, Reis, Blumenkohl, grünen Bohnen und der Rosskastanie lässt sich Allantoin finden. Die Larven von Lucilia sericata (Goldfliegenart) werden als Mittel der Wundheilung genutzt, da sie sehr spezifisch nekrotisches Gewebe fressen und große Mengen von Allantoin abgeben.
-
Herzblättriger Beinwell (Symphytum cordatum)
-
Niedrige Schwarzwurzel (Scorzonera humilis)
Allantoin als Mineral
[Bearbeiten | Quelltext bearbeiten]Im ehemaligen Bergwerk „Rowley“ (englisch Rowley Mine) mit Cu-Pb-Au-Ag-Mo-V-Baryt-Flussspat-Vererzung[8] etwa 20 km nordwestlich von Theba im Maricopa County des US-Bundesstaates Arizona wurde Allantoin erstmals als natürliche Mineralbildung entdeckt. Außer seiner Typlokalität sind allerdings bisher keine weiteren Fundorte für natürlich gebildeten Allantoin dokumentiert (Stand 2024).[9]
Die Analyse und Erstbeschreibung erfolgte durch Anthony R. Kampf, Aaron J. Celestian, Barbara P. Nash und Joe Marty, die dem neu entdeckten Mineral keinen Eigennamen gaben, sondern es nach der bereits bekannten chemischen Verbindung benannten.[10]
2020 sandte das Mineralogenteam um Kampf seine Untersuchungsergebnisse und den gewählten Namen zur Prüfung an die International Mineralogical Association (interne Eingangs-Nr. der IMA: 2020-004a), die Allantoin als eigenständige Mineralart anerkannte.[11] Die Anerkennung wurde im Newsletter 56 der IMA Commission on New Minerals, Nomenclature and Classification (CNMNC) bestätigt.[10]
Das Typmaterial des Minerals wird in der mineralogischen Sammlung des Los Angeles County Museum of Natural History (LACMNH) in Los Angeles unter der Katalognummer 74491 aufbewahrt.[12][13]
Eine mineralogische Klassifizierung in einer der bekannten Mineral-Systematiken ist bisher nicht bekannt. Aufgrund seiner Verwandtschaft mit Harnstoff (bekannt als Mineral Urea) wird er jedoch voraussichtlich wie dieser in der Mineralklasse der Organischen Verbindungen eingeordnet werden.
Die von der Mineraldatenbank „Mindat.org“ weitergeführte Strunz-Klassifikation in der 9. Auflage (auch Strunz-mindat) ordnet den Allantoin in die Abteilung „Diverse organische Mineralien“ (englisch Miscellaneous Organic Minerals) und dort in die bisher unbenannte Unterabteilung „A“. Eine weitere Einordnung in eine Gruppe mit chemisch oder kristallographisch verwandten Mineralen wurde dort bisher (Stand 2024) nicht vorgenommen (vergleiche dazu auch Unterabteilung „10.CA“ in der Klassifikation nach Strunz (9. Auflage)).[14]
Synthese
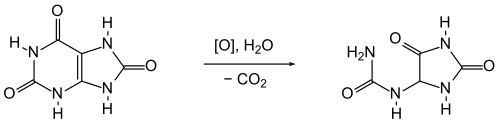
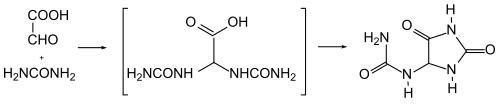
[Bearbeiten | Quelltext bearbeiten]Synthetisch kann Allantoin durch Erhitzen von Glyoxylsäure mit Harnstoff auf 100 °C erhalten werden.[15] Anstelle von Glyoxylsäure kann industriell Dichloressigsäure eingesetzt werden.[16] Auch die Herstellung aus Harnsäure wurde optimiert: Als Oxidationsmittel wird Kaliumpermanganat in alkalischer Lösung (Natronlauge) verwendet.[17]
Abbau
[Bearbeiten | Quelltext bearbeiten]In der Natur wird Allantoin zu Allantoinsäure (Allantoat) abgebaut. In Bakterien wie Escherichia coli wird diese Reaktion von dem Enzym Allantoinase (AllB, UniProt: P77671) katalysiert. Die Allantoinsäure wird dann von dem Enzym Allantoinsäure-amidohydrolase (AllC, Uniprot P77425) in Ureidoglyzin konvertiert, welches dann durch AllE (Uniprot: P7571) in Ureidoglykolat verwandelt wird. Letzteres ist das Substrat für die Enzyme AllA (Uniprot: P77731) für die Umwandlung in Glyoxylat bzw. für AllD (Uniprot: P77555) für die Umwandlung in Oxalo-Harnsäure.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Kristallstruktur von Allantoin wurde bereits 2011 durch Baojun Xu, Changkeun Sung und Byunghee Han am synthetisch hergestellten Analogon entschlüsselt. Demnach kristallisiert die Verbindung C4H6N4O3 in der monoklinen Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = =8,0004(6) Å; b = 5,1487(4) Å; c = 14,7501(10) Å und β = 92,9080(10)° sowie vier Formeleinheiten pro Elementarzelle.[18] Die Dichte von Allantoin beträgt 1,71 g/cm³ bei 22 °C.[19]
Die von Xu, Sung und Han synthetisch erzeugten, farblosen bis weißen Allantoin-Kristalle waren von prismatischer Gestalt und hatten eine Länge von nur wenigen Zehntelmillimetern.[18]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Allantoin wird in der Kosmetik in Hautcremes, Duschgels, Sonnenschutzmitteln, Rasierwässern, in Zahncreme und in Mitteln gegen übermäßige Schweißabsonderung (Hyperhidrose) und Hautirritationen eingesetzt. Es bewirkt die Beschleunigung des Zellaufbaus, der Zellbildung oder der Zellregeneration und beruhigt die Haut. Auch die Heilung schwer heilender Wunden wird unterstützt, jedoch besitzt Allantoin keine antiseptischen Eigenschaften.[5]
Beinwellsalbe galt in der Naturheilkunde lange als die beste Wundheilsalbe. Sie wurde durch einen Fettauszug der frischen Beinwellwurzel mittels Schweineschmalz hergestellt. Der Wirkstoff ist temperaturbeständig, jedoch empfindlich gegen Berührung mit Metallen, die eine katalytische Zersetzung bewirken können. Daher sollten Zubereitungen mit Allantoin nicht in Metallgefäßen gelagert werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ALLANTOIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. August 2020.
- ↑ a b c d Datenblatt Allantoin bei Merck, abgerufen am 4. November 2007.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ a b Datenblatt Allantoin, ≥98.0% (N) bei Sigma-Aldrich, abgerufen am 19. August 2024 (PDF).
- ↑ a b Eintrag zu Allantoin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. November 2011.
- ↑ Buniva und Vauquelin, Annales de Chimie, Serie 1, Band 33, 269–275 (1800); zitiert nach Beilsteins Handbuch der Organischen Chemie, Hauptwerk, Band 25, S. 474c sowie Partington, A History of Chemistry, Vol 4, S. 333.
- ↑ F. Wöhler, J. Liebig, Annalen der Pharmazie, 26, 241–336 (1838).
- ↑ Rowley Mine. In: Mineralienatlas Lexikon. Geolitho Stiftung, abgerufen am 23. Mai 2021.
- ↑ Fundortliste für Allantoin beim Mineralienatlas (deutsch) und bei Mindat (englisch), abgerufen am 17. August 2024.
- ↑ a b Ritsuro Miyawaki, Frédéric Hatert, Marco Pasero, Stuart J. Mills: IMA Commission on New Minerals, Nomenclature and Classification (CNMNC) Newsletter 56. In: Mineralogical Magazine. Band 84, 2020, S. 627, doi:10.1180/mgm.2020.60 (englisch, rruff.info [PDF; 160 kB; abgerufen am 17. August 2024]).
- ↑ IMA Database of Mineral Properties – Allantoin. In: rruff.info. RRUFF Project, abgerufen am 17. August 2024 (englisch).
- ↑ Catalogue of Type Mineral Specimens – A. (PDF 357 kB) Commission on Museums (IMA), 9. Februar 2021, abgerufen am 23. Mai 2021 (englisch, Gesamtkatalog der IMA).
- ↑ Catalogue of Type Mineral Specimens – Depositories. (PDF 311 kB) Commission on Museums (IMA), 18. Dezember 2010, abgerufen am 23. Mai 2021 (englisch).
- ↑ Classification of Allantoin. In: mindat.org. Hudson Institute of Mineralogy, abgerufen am 17. August 2024 (englisch, siehe auch Anker „Strunz-Mindat“: Related Minerals - Strunz-mindat Grouping).
- ↑ Grimaux, Comptes rendues des Seances de l'Academie des Sciences, Bd. 83, 63; Annales de Chimie, Serie 5, Bd. 11, 390; zitiert nach Beilsteins Handbuch der Organischen Chemie, Hauptwerk, Bd. 25, 474.
- ↑ C. N. Zellner, J. R. Stevens, U.S. Patent 2158098 (1939) für Merck & Co.; Chemical Abstracts 33, 6350 (1939).
- ↑ W. W. Hartman, E. W. Moffett, J. B. Dickey: Allantoin In: Organic Syntheses. 13, 1933, S. 1, doi:10.15227/orgsyn.013.0001; Coll. Vol. 2, 1943, S. 21–23 (PDF).
- ↑ a b Baojun Xu, Changkeun Sung, Byunghee Han: Crystal structure characterization of natural allantoin from edible lichen Umbilicaria esculenta. In: Crystals. Band 1, 2011, S. 128–135, doi:10.3390/cryst1030128 (englisch, rruff.info [PDF; 606 kB; abgerufen am 23. Mai 2021] Achtung! In der Quelle wird fälschlicherweise mg/m³ als Einheit für die Dichte angegeben (Tippfehler)).
- ↑ Freiwillige Sicherheitsinformation in Anlehnung an das Sicherheitsdatenblattformat gemäß Verordnung (EG) Nr. 1907/2006 (REACH) – Allantoin. Carl Roth, 6. Mai 2019, archiviert vom (nicht mehr online verfügbar) am 27. Januar 2022; abgerufen am 27. Januar 2022.