Hypothyreose

Unter Hypothyreose oder Hypothyreoidismus versteht man eine mangelnde Versorgung des Körpers mit den Schilddrüsenhormonen Trijodthyronin (T3) und Thyroxin (T4). Meist ist eine Unterfunktion der Schilddrüse (Schilddrüsenunterfunktion) dafür verantwortlich. Bei dieser Hormonsituation laufen zahlreiche Stoffwechselfunktionen des Körpers langsamer ab als normal. Die Folgen sind geringere körperliche und geistige Leistungsfähigkeit. Die Erkrankung wird in der Regel anhand von Blutuntersuchungen nachgewiesen und ist gut behandelbar. Das Gegenteil, eine Überversorgung mit Schilddrüsenhormonen, wird als Hyperthyreose bezeichnet.
Bei Kindern kann eine sehr früh erworbene oder eine angeborene Hypothyreose zu körperlichen und geistigen Entwicklungsverzögerungen führen, deren Vollbild bei fehlender Behandlung als Kretinismus bezeichnet wird.[1][2]
Definitionen
[Bearbeiten | Quelltext bearbeiten]Es existieren zwei unterschiedliche Definitionen von Hypothyreose, wobei die Fachliteratur in der Regel jeweils nur eine der beiden anführt. Nach der ersten produziert die Schilddrüse zu wenig Hormone (Schilddrüsenunterfunktion),[3][4][5] nach der zweiten besteht eine Minderversorgung des Körpers mit Schilddrüsenhormonen.[6][7][8] Auch die englische Literatur nennt entweder nur die Schilddrüsen-Unterfunktion[9][10][11] oder den mangelnden Hormoneinfluss auf die Körperzellen;[12][13][14] ein einziges Fachbuch erwähnt beide Definitionen:
„Hypothyroidism is the result of inadequate production of thyroid hormone or inadequate action of thyroid hormone in target tissues.“[15]
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Das Verständnis für die Funktion der Schilddrüse entwickelte sich erst langsam. Bis in die zweite Hälfte des 19. Jahrhunderts wurde sie als „Nebendrüse der Respirationsorgane“ betrachtet, deren Funktion unklar war.[17] 1895/1896 fand Eugen Baumann organisch gebundenes Jod in der Schilddrüse, das sogenannte Jodothyrin (oder auch Thyreojodin) und charakterisierte es als den wirksamen Bestandteil der Schilddrüse.[18][19] Über seine Wirkung war jedoch noch 1898 kaum etwas bekannt (Robert Hutchison);[20] es diente bis ins 20. Jahrhundert zu Versuchszwecken.[21] 1911 beschrieb Harry E. Alderson die Entstehung des Myxödems bei Hypothyreose als subkutane Infiltration einer schleimähnlichen Substanz, die im weiteren Verlauf durch eine überschießende Bildung von Bindegewebe ersetzt wird. Zusätzlich fand er, dass die Ichthyose damit einhergeht, und setzte erfolgreich Schilddrüsenextrakte und Jodothyrin zur Therapie ein.[22]
Die Entdeckung des Schilddrüsenhormones Thyroxin wird Edward Calvin Kendall 1914 zugeschrieben. Er hatte aus Jodothyrin einen aktiven Anteil herauskristallisiert und ihn Thyroxin genannt.[23] Als beste Möglichkeit zur Feststellung einer Hypothyreose mittels Untersuchung des Blutes werden in dieser Zeit als Parameter eine beschleunigte Blutgerinnung sowie eine Abnahme der Neutrophilen und eine Zunahme der Lymphozyten erachtet.[24] Die direkte Messung vom Thyroxin im Blut ist seit den 1960er Jahren möglich.[25]
François-Emmanuel Fodéré (1764–1835) ging von jodarmer Luft als Ursache der kindlichen Hypothyreose aus, deren unbehandelter Verlauf als Kretinismus bezeichnet wird.[26] Emil Theodor Kocher (1841–1917) beschrieb 1883 bei der Nachuntersuchung von schilddrüsenoperierten Patienten das Auftreten einer „kretinartigen Veränderung“.[27] In den 1890er Jahren führte Julius Wagner-Jauregg (1857–1940) grundlegende Studien über den Kretinismus in der Steiermark durch und behandelte ihn mittels Schilddrüsenextrakten.[28][29] Die ab 1918 im Nikolaital durch Otto Bayard (1881–1957) und dann ab 1922 in Appenzell Ausserrhoden durch Hans Eggenberger (1881–1946), später gesamtschweizerisch durchgesetzte Vorsorge mit Jodsalz hatte weltweiten Pioniercharakter. In der Folge wurden in der Schweiz keine Kretine mehr geboren.[30]
Grundlagen
[Bearbeiten | Quelltext bearbeiten]Beim gesunden Menschen gibt die Schilddrüse bedarfsgerecht die Schilddrüsenhormone – Thyroxin (T4) und Trijodthyronin (T3) – ins Blut ab. Die Produktion dieser Hormone wird durch den thyreotropen Regelkreis gesteuert. In der Schilddrüse bewirkt eine Verminderung des in der Hirnanhangsdrüse (Hypophyse) gebildeten Hormons Thyreotropin (TSH) eine Verminderung der Produktion von Schilddrüsenhormonen.
Zum Aufbau von Thyroxin und Trijodthyronin benötigt die Schilddrüse Jod. Der Bedarf des Erwachsenen liegt bei etwa 200 μg pro Tag. Eine ausreichende Zufuhr mit der normalen Ernährung ist in Deutschland nicht immer gewährleistet.[31]
Die Menge der produzierten Hormone schwankt innerhalb der Gruppe schilddrüsengesunder Personen (Normalpopulation) erheblich, das heißt, dass der Referenzbereich der laborchemischen Ergebnisse relativ groß ist. Die Schwankungen bei Messungen bei derselben Person sind wesentlich geringer.[32]
Die aus der Schilddrüse ins Blut abgegebenen Schilddrüsenhormone (T3 und T4) werden dort größtenteils an unterschiedliche Proteine (hauptsächlich TBG, TBPA und Albumin) gebunden und dabei biologisch inaktiv. Nur etwa 1 ‰ der im Blut befindlichen Schilddrüsenhormone zirkuliert frei (fT3 und fT4). Nur die freien Schilddrüsenhormone sind biologisch aktiv.
Die Schilddrüsenhormone steigern physiologisch den Grundumsatz, die Empfindlichkeit des Herzens für Katecholamine, den Calcium- und Phosphatumsatz sowie die Erregbarkeit von Muskel- und Nervenzellen und hemmen die Protein- und Glykogenneubildung.
Einteilung und Ursachen
[Bearbeiten | Quelltext bearbeiten]| Klassifikation nach ICD-10 | |
|---|---|
| E00 | Angeborenes Jodmangelsyndrom |
| E00.0 | Angeborenes Jodmangelsyndrom, neurologischer Typ |
| E00.1 | Angeborenes Jodmangelsyndrom, myxödematöser Typ |
| E00.2 | Angeborenes Jodmangelsyndrom, gemischter Typ |
| E00.9 | Angeborenes Jodmangelsyndrom, nicht näher bezeichnet |
| E03 | Sonstige Hypothyreose |
| E03.0 | Angeborene Hypothyreose mit diffuser Struma |
| E03.1 | Angeborene Hypothyreose ohne Struma |
| E89.0 | Hypothyreose nach medizinischen Maßnahmen |
| ICD-10 online (WHO-Version 2019) | |
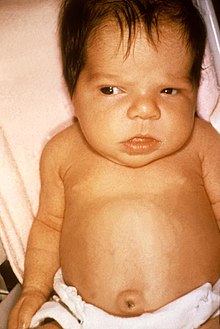
Eine angeborene Hypothyreose – statistisch sind etwa 0,2 ‰ aller Neugeborenen betroffen[33] – entsteht durch eine fehlende oder insuffizient angelegte Schilddrüse (Aplasie oder Dysplasie), eine nicht ausreichende Hormonbiosynthese oder -ausschüttung, sehr selten auch durch eine Hormonresistenz aufgrund von T3-Rezeptordefekten. Eine vorübergehende Hypothyreose des neugeborenen Kindes kann iatrogen durch eine vermehrte Jodexposition nach der Geburt (z. B. durch Desinfektionsmittel wie Povidon-Jod) oder Jodmangel bei der Mutter ausgelöst sein. In letzterem Falle ist begleitend eine Struma (bzw. ein Kropf) typisch.[34][35]
Die erworbene Hypothyreose kann schon im Kindesalter auftreten. Ihre Inzidenz in Deutschland beträgt etwa 0,25–1 % und ist mit zunehmendem Lebensalter ansteigend.[36] Man unterscheidet dabei auch die primäre, sekundäre und tertiäre Form. Von der primären Hypothyreose wird allgemein gesprochen, wenn die Schilddrüse selbst ursächlich für die Hypothyreose ist, d. h. wenn die Sekretionsleistung der Schilddrüse zu gering für die Anforderungen des Organismus ist. Zu dieser Form werden Schilddrüsenunterfunktionen gerechnet, die sich nach einer Schilddrüsenoperation, oder einer Radiojodtherapie entwickeln. Des Weiteren kann sie sowohl iatrogen durch Medikamente, die die Funktion der Schilddrüse hemmen (Thyreostatika) oder extremen Selen- bzw. Jodmangel (bei Kindern weltweit die häufigste vermeidbare Ursache für Retardierung) als auch durch eine atrophische Thyreoiditis (z. B. Autoimmunthyreopathie, Typ Morbus Hashimoto) ausgelöst werden. Bei der seltenen sekundären Hypothyreose mangelt es am schilddrüsenstimulierenden Hormon TSH, welches in der Hypophyse (Hirnanhangdrüse) produziert wird (Hypopituitarismus). Eine Rarität ist die tertiäre Hypothyreose, die entweder durch Mangel an thyrotropin releasing hormone (TRH), oder durch eine Unterbrechung des Portalgefäßsystems zwischen Hypothalamus und Hypophyse (Pickardt-Syndrom) gekennzeichnet ist.
Klinisches Bild
[Bearbeiten | Quelltext bearbeiten]Wie auch bei der Hyperthyreose gibt es unterschiedliche Schweregrade der Hypothyreose: Sie reichen von latent bzw. kompensiert (Schilddrüsenhormonspiegel normal, aber TSH-Wert erhöht) über subklinisch (Schilddrüsenhormonspiegel zwar erniedrigt, aber symptomlos) und manifest (erniedrigter Schilddrüsenhormonspiegel begleitet von entsprechenden Symptomen) bis hin zum lebensgefährlichen Mangel.
Angeborene Hypothyreose
[Bearbeiten | Quelltext bearbeiten]Bei der Geburt sind die Kinder meist klinisch unauffällig, weil die Kinder noch Schilddrüsenhormone der Mutter in ihrem Blutkreislauf haben. In den ersten Lebenswochen fallen sie z. B. durch zunehmende Trinkschwäche, Bewegungsarmut, Obstipation und eine große, sichtbare Zunge auf. Auch eine verlängerte Neugeborenengelbsucht (Ikterus neonatorum prolongatus) ist typisch. Die Kinder wirken „sehr brav“, schreien wenig und schlafen überdurchschnittlich viel. Eine verlangsamte Herzfrequenz (Bradykardie), teigige Haut, Persistenz des Neugeborenenkopfhaares und ein großer Bauch mit Nabelbruch sind ebenso weitere Zeichen, wie auch ein typischer Gesichtsausdruck mit eingesunkener Nasenwurzel und ballonierter Stirn.[35] Zu guter Letzt kann es bei Neugeborenen auch zu Erstickungsanfällen oder einer gestörten Muskelentwicklung kommen.[37] Wächst ein Kind heran, ohne dass die Hypothyreose behandelt wurde, so sind Störungen der geistigen und körperlichen Entwicklung (z. B. beeinträchtigtes Sprachvermögen, Schwerhörigkeit, verzögerte Pubertät)[37] zusammen mit einem verringerten Längenwachstum zu erwarten.
Erworbene Hypothyreose
[Bearbeiten | Quelltext bearbeiten]Anfangs sind die Beschwerden oft nicht auffallend (subklinisch), da sich das Krankheitsbild bei Erwachsenen in der Regel langsam entwickelt. Symptome bestehen aus Leistungsminderung, Konzentrationsschwäche, Schwäche, Antriebslosigkeit, Müdigkeit, Verstopfung und erhöhter Kälteempfindlichkeit. Eine Schilddrüsenunterfunktion kann darüber hinaus eine Depression hervorrufen. Betroffene Patienten klagen über depressive Stimmungen, Gedächtnisminderung und Appetitlosigkeit. Deshalb sollte bei depressiven Patienten die Schilddrüsenfunktion abgeklärt werden. Zudem kann häufig das typische Myxödem – eine ödematös-teigige Verdickung der Haut – beobachtet werden. Trockene bzw. raue Haut, raue Stimme, langsame Sprache, Trägheit, chronische Verstopfung, Schwellung der Lider und des Gesichtes, Verlangsamung des Pulses und der Reflexe sowie niedriger Blutdruck und Gewichtszunahme können beobachtet werden. Bei Frauen können Zyklusstörungen und fibrös-zystische Mastopathie,[38] bei beiden Geschlechtern eine verminderte Libido sowie bei Männern Erektionsstörungen auftreten.[39] Die schwerste und lebensbedrohliche Form ist das hypothyreote Koma (Myxödemkoma), bei dem typischerweise begleitend sehr leise Herztöne, langsamer Herzschlag und niedriger Blutdruck, ein diffuses Myxödem, erniedrigte Körpertemperatur, abgeschwächte oder erloschene Reflexe und flache Atmung auftreten.
Hypothyreotische Myopathie
[Bearbeiten | Quelltext bearbeiten]Veränderungen der Muskulatur (Myopathie) finden sich in 30–80 % bei Hypothyreoidismus, insbesondere bei länger bestehender und unbehandelter Erkrankung.[40] Es dominiert eine Typ-2-Muskelfaseratrophie.[41]
Es können vier verschiedene Formen der Myopathie unterschieden werden:
- Hoffmann-Syndrom
- Kocher-Debré-Semelaigne-Syndrom
- Atrophe Form
- Myasthenische Form
Diagnose
[Bearbeiten | Quelltext bearbeiten]Die angeborene Hypothyreose wird beim Neugeborenen-Screening am 4. bis 5. Lebenstag durch die Messung des Thyreotropin-Spiegels (TSH-Spiegel) gesucht.
Da die Hypothyreose bei Kindern und Erwachsenen durch einen Mangel an Schilddrüsenhormonen definiert ist, spielt neben Anamnese, klinischen Symptomen und bildgebenden Verfahren (insbesondere Sonographie und Szintigrafie) die Labordiagnostik die entscheidende Rolle. Die klinischen Symptome korrelieren beim Erwachsenen nicht immer mit nachweislichen Laborveränderungen. Beim Kind sind sie ein definitiver Indikator für drohende Entwicklungsstörungen.

In der Regel produziert die Schilddrüse bei der Hypothyreose, wie oben bereits dargestellt, zu geringe Mengen der Schilddrüsenhormone. Der thyreotrope Regelkreis führt daraufhin zu einer Steigerung der TSH-Ausschüttung, die ihrerseits dann für die Schilddrüse das Signal für eine erhöhte Produktion von Schilddrüsenhormonen ist. Als Screening-Parameter eignet sich daher die alleinige Bestimmung des basalen TSH-Spiegels im Blut. Ist dieser normal, kann bei einem klinisch unauffälligen Patienten auf eine weitere Bestimmung der Schilddrüsenhormone verzichtet werden. Nach den Leitlinien maßgeblicher medizinischer Fachgesellschaften (Stand März 2016) beträgt der Normalbereich (Referenzbereich) des TSH-Spiegels bei gesunden Erwachsenen 0,4 – 4,5 mU/l, während der Schwangerschaft jedoch mit abgesenkten oberen Werten von 2,5 im 1. Drittel, 3,0 im 2. Drittel und 3,5 im 3. Drittel.[42][43][44] Während einer Schwangerschaft steigt der Bedarf an Schilddrüsenhormonen üblicherweise an, so dass im Falle einer Schilddrüsenunterfunktion (bei etwa 0,4 % der Schwangeren) die Werte während und nach der Schwangerschaft regelmäßig kontrolliert werden sollten.[45]
Die latente (symptomfreie) oder subklinische Hypothyreose ist definiert durch einen fT4-Wert im Normalbereich und TSH oberhalb von 4,5 mU/l, sofern letzterer zweimal innerhalb von 3 bis 6 Monaten erhöht ist. Die Prävalenz der latenten Hypothyreose in der Allgemeinbevölkerung liegt nach Schätzungen zwischen 3 und 10 %.[46] Ein ausreichend nachgewiesenes, erhöhtes Risiko für eine Erkrankung – in Verbindung mit einem Vorteil bei Behandlung – besteht jedoch nicht, solange TSH unter 10,0 mU/l liegt.[47] Häufigste Ursache der latenten Hypothyreose ist eine Autoimmunthyreoiditis. Zur ätiologischen Klärung könne daher bei latenter Hypothyreose einmalig eine Antikörperbestimmung erfolgen (Antikörper gegen thyreoidale Peroxidase, „Anti-TPO“; bei speziellen Situationen ggf. auch Anti-Thyreoglobulin-Antikörper). Das Wissen um das Vorhandensein von Autoantikörpern habe klinisch allerdings kaum Relevanz und der Nachweis dieser Autoantikörper für die weitere Behandlung meist keine Bedeutung. Auf eine Schilddrüsen-Sonografie könne bei latenter Hypothyreose, sofern keine Schilddrüsenknoten tastbar sind, verzichtet werden.[46]
Zu beachten ist ferner, dass der obere Wert des TSH-Normalbereichs bei Erwachsenen mit dem Alter stetig zunimmt, und zwar – nach einer Analyse einer umfangreichen Datensammlung in den USA – zwischen den Altersklassen 20–29 und 80+ von 3,5 auf 7,5 mU/l. Wird diese Altersabhängigkeit nicht berücksichtigt, besteht ein erhebliches Risiko, dass bei Patienten ab 50 eine Diagnose „latente Hypothyreose“ nicht berechtigt ist.[48][49][50]
Der klassische Fall einer manifesten (offen sichtbaren) Hypothyreose ist eine Erniedrigung von fT3 und fT4 unterhalb ihrer Normalbereiche zusammen mit einer Erhöhung des TSH-Spiegels (> 4,0 mU/l) und den entsprechenden klinischen Symptomen. Als laborchemische Parameter zum Nachweis einer Hypothyreose genügen jedoch die Bestimmung von TSH und fT4.
Bei der angeborenen Hypothyreose werden ergänzend die Konzentration des Thyreoglobulin im Blut und der Jod-Gehalt im Urin bestimmt und eine Schilddrüsenszintigraphie mit 123Jod durchgeführt.
Bei der erworbenen Hypothyreose werden ergänzend die Messung von TPO-AK (Antikörper gegen Schilddrüsenperoxidase) und der Antikörper gegen Thyreoglobulin (Tg-AK), sowie als bildgebendes Verfahren die Sonographie empfohlen,[51] um die Ursache der Hypothyreose abzuklären. Weitere Untersuchungsmöglichkeiten spielen nur in speziellen Fällen eine Rolle und werden dort in dem jeweiligen Hauptartikel dargestellt.
Therapie
[Bearbeiten | Quelltext bearbeiten]
Bei der angeborenen Hypothyreose ist die lebenslange Gabe von Thyroxin notwendig. Sie sollte so früh wie irgend möglich begonnen werden.[52]
Die erworbene Hypothyreose, gleich ob subklinisch oder manifest, wird in der Regel ebenfalls mit einer lebenslangen Ersatztherapie (Substitution) mit T4 (L-Thyroxin) behandelt. Der Nutzen einer Therapie von subklinischen Unterfunktionen der Schilddrüse ist jedoch bisher (Stand März 2016) nicht ausreichend belegt und wird nur im begründeten Einzelfall empfohlen.[53]
Die Dosis muss in allen Fällen individuell angepasst werden. Es wird mit einer niedrigen Dosis Schilddrüsenhormon begonnen und dann langsam gesteigert. Diese Vorgehensweise hat sich im Hinblick auf die Vermeidung von Nebenwirkungen bewährt. Eine Dauersubstitutionsbehandlung (meist zwischen 50 und 150 µg L-Thyroxin pro Tag) gilt dann als gut eingestellt, wenn sich der Patient wohlfühlt und der basale TSH-Spiegel (frühestens nach sechs bis acht Wochen) im Normalbereich (siehe Diagnose) liegt.[54] Der weitere Verlauf wird in der Regel bei guter Einstellung halbjährlich und dann jährlich kontrolliert. Bei Kindern ist der Kontrollzyklus altersabhängig. Ergänzend sind engmaschige Kontrollen von Wachstum, Gewicht sowie psycho- und somatomotorischer Entwicklung angezeigt. Im Falle einer erworbenen Hypothyreose kann beim Kind nach etwa 2 Jahren ein vier- bis sechswöchiger Auslassversuch unternommen werden.[55]
Bei L-Thyroxin können sich bereits geringe Dosisänderungen bemerkbar machen (geringe therapeutische Breite). Daher sollte möglichst kein Wechsel auf ein Präparat eines anderen Herstellers erfolgen, da nicht gewährleistet ist, dass die aufgenommene Wirkstoffmenge vergleichbar ist (Bioverfügbarkeit).[56] Deshalb findet sich L-Thyroxin auch auf der Substitutionsausschlussliste.[57]
Beim Myxödemkoma (hypothyreotes Koma) handelt es sich um ein akut lebensbedrohliches, notfallmedizinisches Krankheitsbild. Daher beginnt die Therapie unverzüglich, ohne das Ergebnis laborchemischer Hormonanalysen abzuwarten. Auch Patienten mit den klinischen Zeichen eines Myxödemkomas sollen sofort auf einer Intensivstation aufgenommen und behandelt werden. Die Therapie umfasst in beiden Fällen die Sicherung der Vitalfunktionen, die Gabe von Glucocorticoiden, Glucose, die Überwachung und gegebenenfalls den Ausgleich des Elektrolythaushaltes, eine Normalisierung der Körpertemperatur (häufig Hypothermie) und die intravenöse Applikation von Thyroxin.[1]
Überbehandlung
[Bearbeiten | Quelltext bearbeiten]Eine unnötige oder überdosierte Behandlung mit Thyroxin (T4) ist ein weitverbreitetes Problem. Es betrifft ca. 15–20 % der damit behandelten Patienten.[58] Neben mangelnder ärztlicher Kontrolle ist eine häufige Ursache auch die eigenmächtige Veränderung der Dosis durch die Patienten nach Gefühl und ohne Beachtung ihrer Blutwerte.[59] Risiken einer Überdosierung sind eine erhöhte Wahrscheinlichkeit von Vorhofflimmern (Herzrhythmusstörung), Angina pectoris (Durchblutungsstörung des Herzens), Herzinsuffizienz, Nervosität, Palpitation (Herzklopfen), Abnahme der Knochenmineraldichte und Knochenbruch.[47]
Die Größenordnung des Problems einer weitverbreiteten unnötigen oder überdosierten Behandlung mit Thyroxin (T4) in Deutschland wurde im Arzneiverordnungs-Report 2014 dokumentiert. Danach wurden mindestens 4,1 Millionen Personen dauerhaft mit Schilddrüsenhormonen versorgt.[60]
Prophylaxe
[Bearbeiten | Quelltext bearbeiten]Prophylaktisch wirkt bei den durch einen Jodmangel verursachten Formen der Hypothyreose eine ausreichende Versorgung mit Jod über die Ernährung. Die täglich empfohlene Jod-Menge für Erwachsene beträgt etwa 200 μg. Während einer Schwangerschaft benötigt der Körper der Mutter mehr Jod (bis 300 μg täglich).[61] Besonders Seefisch und jodiertes Speisesalz enthalten viel Jod, darum sind sekundäre Schilddrüsenunterfunktionen in der Nähe des Meeres selten. In Jodmangelgebieten wie z. B. den Alpen wird eine entsprechende Nahrungsergänzung empfohlen (in Deutschland) bzw. staatlich geregelt. In der Schweiz und in Österreich, aber auch den USA gibt es bereits seit 1920 Gesetze, die die Versorgung mit Jod regeln, z. B. indem sie den Jodanteil in Kochsalz vorschreiben. Der Rückgang von Unterfunktionen wurde dabei mit einem kurzfristigen Anstieg von Schilddrüsenüberfunktionen erkauft. Langzeitstudien haben aber ergeben, dass diese vergleichsweise gering ausfallen.[62]
Die wissenschaftliche Auswertung der staatlichen Salzjodierung in China von 1985 bis 2014 zeigte neben den bekannten positiven Effekten auch deutliche negative Effekte auf die Schilddrüse bei lokaler Überversorgung mit Jod,[63][64] zu denen auch ein erhöhtes Risiko für Schilddrüsenunterfunktion gehört.[65]
Hypothyreose bei Tieren
[Bearbeiten | Quelltext bearbeiten]In der Tiermedizin hat vor allem die Hypothyreose des Hundes eine größere Bedeutung. Die Häufigkeit der durch Jodmangel bedingten Schilddrüsenunterfunktion bei anderen Tierarten hat dagegen in den letzten Jahrzehnten deutlich abgenommen, vor allem durch den Jodzusatz in kommerziellen Futtermitteln. Prinzipiell können bei Hunden die gleichen Ursachen wie beim Menschen dafür verantwortlich sein, 95 % der Fälle sind jedoch erworbene primäre Hypothyreosen. Es sind vor allem Hunde großwüchsiger Rassen betroffen. Die Symptome erscheinen meist schleichend und bestehen in zunehmender Trägheit sowie Haut- und Fellveränderungen, bei Hündinnen auch ein Ausbleiben der Läufigkeit. Die Behandlung erfolgt durch eine regelmäßige Gabe von Schilddrüsenhormonen[66]
Sauen mit Hypothyreose gebären „Nacktferkel“ mit einem Myxödem. Bei Kälbern wird „Zungenschlagen“ beobachtet. Ursache dieser Hypothyreose ist ein sekundärer Jodmangel durch Senfölglykosid- oder nitrathaltige Futtermittel.[67]
Bei Vögeln – vor allem Wellensittichen – spielen zum Teil noch durch Jodmangel hervorgerufene Schilddrüsenunterfunktionen eine Rolle. Klinisch äußern sie sich in Atemnot, da die vergrößerte Schilddrüse auf die Luftröhre drückt, sowie Befiederungsstörungen. Bei Papageien wird eine Hypothyreose in Zusammenhang mit der Entstehung von Verfettung und Befiederungsstörungen diskutiert, wie sie vor allem beim Rosakakadu auftritt. Diese Symptome sprechen zwar auf die Zufuhr von Thyroxin an, allerdings ist die Schilddrüsenhormondiagnostik bei Vögeln nicht praxisreif, so dass eine kausale Beziehung nur vermutet werden kann. Auch bei Schildkröten kommen in Gegenden mit geringen Jodgehalten im Trinkwasser vermehrt Hypothyreosen vor. Sie äußern sich in der Bildung von Myxödemen am Halsansatz.[68]
Literatur
[Bearbeiten | Quelltext bearbeiten]Leitlinien
[Bearbeiten | Quelltext bearbeiten]- O. Okosieme, J. Gilbert, P. Abraham, K. Boelaert, C. Dayan, M. Gurnell, G. Leese, C. McCabe, P. Perros, V. Smith, G. Williams, M. Vanderpump: Management of primary hypothyroidism: statement by the British Thyroid Association Executive Committee. In: Clinical endocrinology. [elektronische Veröffentlichung vor dem Druck] Mai 2015, doi:10.1111/cen.12824, PMID 26010808, (Review), www.british-thyroid-association.org (PDF) abgerufen am 21. März 2016.
- J. R. Garber, R. H. Cobin, H. Gharib, J. V. Hennessey, I. Klein, J. I. Mechanick, R. Pessah-Pollack, P. A. Singer, K. A. Woeber: Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. In: Thyroid: official journal of the American Thyroid Association. Band 22, Nummer 12, Dezember 2012, S. 1200–1235, doi:10.1089/thy.2012.0205, PMID 22954017.
- UK guidelines for the use of thyroid function tests (2006) (PDF) Association of Clinical Biochemistry, British Thyroid Association and British Thyroid Foundation; abgerufen am 21. März 2016.
- Erhöhter TSH-Wert in der Hausarztpraxis (PDF) DEGAM-Leitlinie Nr. 18, 2016.
Information für Patienten und Angehörige
[Bearbeiten | Quelltext bearbeiten]- Hypothyroidism - A Booklet for Patients and their Families. (PDF; 1,9 MB) American Thyroid Association (ATA), 2013; abgerufen am 21. März 2016.
- Erhöhter TSH-Wert in der Hausarztpraxis. (PDF; 309 kB) DEGAM-Patienteninformation, 2016; abgerufen am 28. März 2022.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Gerd Herold: Innere Medizin. 2007.
- ↑ Hans Bankl: Arbeitsbuch Pathologie III. maudrich, 1998, ISBN 3-85076-536-9, S. 361. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Andreae, Susanne (Mitwirkende): Lexikon der Krankheiten und Untersuchungen, Georg Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-142962-9, S. 475.
- ↑ Heiner Greten, Tim Greten, Franz Rinninger (Hrsg.): Innere Medizin. Georg Thieme Verlag, Stuttgart 2010, ISBN 978-3-13-162183-2, S. 510.
- ↑ Baenkler, Hanns-Wolf (Mitwirkender): Innere Medizin: 299 Synopsen, 611 Tabellen. Georg Thieme Verlag, Stuttgart 2001, ISBN 3-13-128751-9, S. 804.
- ↑ G.K. Stalla (Hrsg.): Therapielexikon Endokrinologie und Stoffwechselkrankheiten. Springer-Verlag, Heidelberg 2007, ISBN 978-3-540-30033-5, S. 541.
- ↑ Walter Siegenthaler (Hrsg.): Siegenthalers Differenzialdiagnose: innere Krankheiten - vom Symptom zur Diagnose. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-344819-6, S. 493.
- ↑ Waltraut Kruse, Gotthard Schettler (Hrsg.): Allgemeinmedizin. Walter de Gruyter, Berlin 1995, ISBN 3-11-087915-8, S. 209.
- ↑ Jürgen Floege, Richard J Johnson, John Feehally: Comprehensive clinical nephrology, Saunders/Elsevier, Philadelphia (USA) 2010, ISBN 978-0-323-08133-7, S. 484.
- ↑ Pauline M Camacho, Hossein Gharib, Glen W Sizemore: Evidence-based endocrinology, Lippincott Williams & Wilkins, Philadelphia 2007, ISBN 978-0-7817-7154-2, S. 37.
- ↑ Fabrizio Monaco: Thyroid Diseases, CRC Press, Boca Raton (USA) 2012, ISBN 978-1-4398-6839-3, S. 172.
- ↑ Pauline Camacho: Clinical Endocrinology and Metabolism. Manson Publishing, London 2011, ISBN 978-1-84076-585-4, S. 20.
- ↑ William D. Carey (Hrsg.): Current Clinical Medicine E-Book. Expert Consult - Online. Elsevier Health Sciences, Philadelphia 2010, ISBN 978-1-4377-3571-0, S. 416.
- ↑ Anthony P. Weetman (Hrsg.): Autoimmune Diseases in Endocrinology. Springer Science & Business Media, 2007, ISBN 978-1-59745-517-6, S. 137.
- ↑ Kenneth Burman (Hrsg.): Thyroid Disorders and Diseases, An Issue of Medical Clinics - E-Book. Elsevier Health Sciences, Philadelphia 2012, ISBN 978-1-4557-4415-2, S. 203.
- ↑ Albert Kölliker: Handbuch der Gewebelehre des Menschen. 1867, S. 480.
- ↑ J. Hyrtl: Lehrbuch der Anatomie das Menschen. Braumüller Hofbuchhändler, Wien 1863, S. 666.
- ↑ Eugen Baumann: Über das Thyrojodin. In: Münchner Medizinisch Wochenschrift. Band 43, 1896, S. 309.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 46.
- ↑ R. Hutchison: Further Observations on the Chemistry and Action of the Thyroid Gland. In: J Physiol., 26. Juli 1898, 23(3), S. 178–189.
- ↑ Otto v. Fürth, Karl Schwarz: Über die Einwirkung des Jodothyrins auf den Zirkulationsapparat. In: Archiv für die gesamte Physiologie des Menschen und der Tiere, Volume 124, Numbers 3-5 / August 1908, Verlag Springer Berlin / Heidelberg
- ↑ H. E. Alderson: The Skin as Influenced by the Thyroid Gland. In: Cal State J Med. Band 9, Nummer 6, 1911, S. 240–243.
- ↑ R. B. Welbourn: The History of Endocrine Surgery. Greenwood Publishing Group, 1990, ISBN 0-275-92586-2, S. 36.
- ↑ An Epitome Of Current Medical Literature. In: Br Med J., 20. Juni 1914, 1, 2790, S. E97–E100.
- ↑ Patent US3414383A: Determination of thyroxine. Angemeldet am 9. August 1965, veröffentlicht am 3. Dezember 1968, Anmelder: Canadian Patents Dev, Erfinder: Beverley E. P. Murphy.
- ↑ E. Werner u. a.: Enzyklopädie Medizingeschichte. Walter de Gruyter, 2004, ISBN 3-11-015714-4, S. 407.
- ↑ Th. Kocher: Über Kropfexstirpation und ihre Folgen. In: Arch Klin Chir. Band 29, 1883, S. 2541.
- ↑ Julius Wagner-Jauregg auf der Internetseite des Institutes für Geschichte der Medizin der Universität Wien ( vom 28. Juni 2009 im Internet Archive)
- ↑ E. Werner u. a.: Enzyklopädie Medizingeschichte. Walter de Gruyter, 2004, ISBN 3-11-015714-4, S. 1463.
- ↑ Jürg Rageth: Kretinismus. In: Historisches Lexikon der Schweiz. 4. November 2008, abgerufen am 5. Juni 2019.
- ↑ A. Gottschalk: Schilddrüse. In: Frank Wappler, Hartmut Bürkle, Peter Tonner (Hrsg.): Anästhesie und Begleiterkrankungen. Georg Thieme Verlag, 2011, ISBN 978-3-13-159522-5, S. 219. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ K. Miehle, R. Paschke: Sind TSH-Rezeptor Polymorphismen eine mögliche Ursache für die interindividuell unterschiedlichen Normalbereiche der TSH-, fT3- und fT4-Werte in einer Normalpopulation? ( vom 10. Juni 2008 im Internet Archive) In: Forschungsbericht 2004. Universität Leipzig
- ↑ Schilddrüsenerkrankungen im Kindesalter. (PDF; 8,1 MB) Uniklinik Saarland; abgerufen am 12. Februar 2008
- ↑ K. Middendorf: Geburtshilfe Basics. Springer, Berlin/Heidelberg 2006, S. 79–82.
- ↑ a b A. Grüter-Kieslich: Angeborene Hypothyreose und Struma. In: Differentialdiagnose Pädiatrie. Elsevier, 2004, ISBN 3-437-22530-8.
- ↑ Leitlinien-basierte Schilddrüsentherapie. In: Journal Med., 7. April 2002.
- ↑ a b Schilddrüsenunterfunktion: Symptome und Behandlung. In: Schilddrüsenunterfunktion Symptome: Kinder. Archiviert vom am 22. Februar 2018; abgerufen am 20. Februar 2018: „Erstickungsanfälle, gestörte Muskelentwicklung“ Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Helmut Madjar, Ellen B. Mendelson: Practice of Breast Ultrasound: Techniques, Findings, Differential Diagnosis. Thieme, 2011, ISBN 978-1-60406-088-1, S. 97.
- ↑ Andrew T. Gabrielson, Rita A. Sartor, Wayne J. G. Hellstrom: The Impact of Thyroid Disease on Sexual Dysfunction in Men and Women. In: Sexual Medicine Reviews. Band 7, Nr. 1, Januar 2019, S. 57–70, doi:10.1016/j.sxmr.2018.05.002, PMID 30057137.
- ↑ N. Udayakumar, A. C. Rameshkumar, A. V. Srinivasan: Hoffmann syndrome: presentation in hypothyroidism. In: Journal of postgraduate medicine. Band 51, Nummer 4, 2005 Oct-Dec, S. 332–333, ISSN 0022-3859. PMID 16388183.
- ↑ Tobias Müller, Stephan Zierz: Pathologie der Skelettmuskulatur. In: Stephan Zierz (Hrsg.): Referenz-Reihe Neurologie: Klinische Neurologie: Muskelerkrankungen. Thieme Stuttgart 2014, DOI:10.1055/b-0034-97105, S. 41.
- ↑ O. Okosieme, J. Gilbert, P. Abraham, K. Boelaert, C. Dayan, M. Gurnell, G. Leese, C. McCabe, P. Perros, V. Smith, G. Williams, M. Vanderpump: Management of primary hypothyroidism: statement by the British Thyroid Association Executive Committee. In: Clinical endocrinology. [elektronische Veröffentlichung vor dem Druck] Mai 2015; doi:10.1111/cen.12824, PMID 26010808, (Review), british-thyroid-association.org ( vom 25. März 2016 im Internet Archive; PDF) abgerufen am 21. März 2016.
- ↑ J. R. Garber, R. H. Cobin, H. Gharib, J. V. Hennessey, I. Klein, J. I. Mechanick, R. Pessah-Pollack, P. A. Singer, K. A. Woeber: Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. In: Thyroid: official journal of the American Thyroid Association. Band 22, Nummer 12, Dezember 2012, S. 1200–1235, doi:10.1089/thy.2012.0205, PMID 22954017.
- ↑ Association of Clinical Biochemistry, British Thyroid Association and British Thyroid Foundation: UK guidelines for the use of thyroid function tests (2006), PDF ( vom 17. November 2013 im Internet Archive) (abgerufen am 21. März 2016).
- ↑ Embryotox - Arzneimittelsicherheit in Schwangerschaft und Stillzeit ( vom 30. März 2018 im Internet Archive)
- ↑ a b J. Schübel, J. Feldkamp, A. Bergmann, W. Drossard, K. Voigt: Latent Hypothyroidism in Adults. In: Deutsches Ärzteblatt international. Band 114, Nummer 25, Juni 2017, S. 430–438, doi:10.3238/arztebl.2017.0430, PMID 28683860 (Review); freier Volltext auf Deutsch (PDF).
- ↑ a b C. Baumgartner, M. R. Blum, N. Rodondi: Subclinical hypothyroidism: summary of evidence in 2014. In: Swiss medical weekly. Band 144, 2014, S. w14058, doi:10.4414/smw.2014.14058, PMID 25536449 (Review).
- ↑ M. I. Surks, J. G. Hollowell: Age-specific distribution of serum thyrotropin and antithyroid antibodies in the US population: implications for the prevalence of subclinical hypothyroidism. In: The Journal of clinical endocrinology and metabolism. Band 92, Nummer 12, Dezember 2007, S. 4575–4582, doi:10.1210/jc.2007-1499, PMID 17911171.
- ↑ N. Aggarwal, S. Razvi: Thyroid and aging or the aging thyroid? An evidence-based analysis of the literature. In: Journal of thyroid research. Band 2013, 2013, S. 481287, doi:10.1155/2013/481287, PMID 24106641, PMC 3782841 (freier Volltext) (Review).
- ↑ J. V. Hennessey, R. Espaillat: Diagnosis and Management of Subclinical Hypothyroidism in Elderly Adults: A Review of the Literature. In: Journal of the American Geriatrics Society. Band 63, Nummer 8, August 2015, S. 1663–1673, doi:10.1111/jgs.13532, PMID 26200184 (Review) freier Volltext (PDF).
- ↑ Matthias Schott, Jochen Seißler, Werner A. Scherbaum: Diagnostik bei autoimmunen Schilddrüsenerkrankungen / Diagnostic testing for autoimmune thyroid diseases. In: LaboratoriumsMedizin. 30, 2006, S. 254, doi:10.1515/JLM.2006.033.
- ↑ Karin Götsch: Allgemeine und Spezielle Krankheitslehre Georg Thieme Verlag, 2007, ISBN 978-3-13-152211-5, S. 164. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Z. Javed, T. Sathyapalan: Levothyroxine treatment of mild subclinical hypothyroidism: a review of potential risks and benefits. In: Therapeutic advances in endocrinology and metabolism. Band 7, Nummer 1, Februar 2016, S. 12–23, doi:10.1177/2042018815616543, PMID 26885359, PMC 4740939 (freier Volltext) (Review).
- ↑ O. Okosieme, J. Gilbert, P. Abraham, K. Boelaert, C. Dayan, M. Gurnell, G. Leese, C. McCabe, P. Perros, V. Smith, G. Williams, M. Vanderpump: Management of primary hypothyroidism: statement by the British Thyroid Association Executive Committee. In: Clinical endocrinology [elektronische Veröffentlichung vor dem Druck], Mai 2015, doi:10.1111/cen.12824, PMID 26010808, (Review), british-thyroid-association.org ( vom 25. März 2016 im Internet Archive; PDF) abgerufen am 21. März 2016.
- ↑ W. Hecker: Endokrinologie. In: Klinikleitfaden Pädiatrie. Jungjohann Verlag, Stuttgart, ISBN 3-8243-1214-X.
- ↑ Der Arzneimittelbrief. Unabhängige Arzneimittelinformation: Bioäquivalenz von Levothyroxin-Präparaten. 2009, abgerufen am 23. Oktober 2021.
- ↑ Gemeinsamer Bundesausschuss: Anlage VII zum Abschnitt M der Arzneimittel-Richtlinie. (PDF) 15. November 2020, abgerufen am 23. Oktober 2021.
- ↑ P. N. Taylor, A. Iqbal, C. Minassian, A. Sayers, M. S. Draman, R. Greenwood, W. Hamilton, O. Okosieme, V. Panicker, S. L. Thomas, C. Dayan: Falling threshold for treatment of borderline elevated thyrotropin levels-balancing benefits and risks: evidence from a large community-based study. In: JAMA internal medicine. Band 174, Nummer 1, Januar 2014, S. 32–39, doi:10.1001/jamainternmed.2013.11312, PMID 24100714.
- ↑ L. F. Michaelsson, B. B. Medici, J. L. la Cour, C. Selmer, M. Røder, H. Perrild, N. Knudsen, J. Faber, B. Nygaard: Treating Hypothyroidism with Thyroxine/Triiodothyronine Combination Therapy in Denmark: Following Guidelines or Following Trends? In: European thyroid journal. Band 4, Nummer 3, September 2015, S. 174–180, doi:10.1159/000437262, PMID 26558234, PMC 4637515 (freier Volltext).
- ↑ Erhöhter TSH-Wert in der Hausarztpraxis. ( des vom 22. Oktober 2020 im Internet Archive; PDF) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. DEGAM-Leitlinie Nr. 18, 2016, S. 9 f.
- ↑ Gesundheitslexikon des Internistenverbandes ( vom 10. Mai 2008 im Internet Archive)
- ↑ R. Hörmann: Schilddrüsenkrankheiten: Leitfaden für Praxis und Klinik. 4. Auflage. 2005, S. 160.
- ↑ W. Zhao, C. Han, X. Shi, C. Xiong, J. Sun, Z. Shan, W. Teng: Prevalence of goiter and thyroid nodules before and after implementation of the universal salt iodization program in mainland China from 1985 to 2014: a systematic review and meta-analysis. In: PloS one. Band 9, Nummer 10, 2014, S. e109549, doi:10.1371/journal.pone.0109549, PMID 25313993, PMC 4196906 (freier Volltext) (Review).
- ↑ X. Sun, Z. Shan, W. Teng: Effects of increased iodine intake on thyroid disorders. In: Endocrinology and metabolism (Seoul, Korea). Band 29, Nummer 3, September 2014, S. 240–247, doi:10.3803/EnM.2014.29.3.240, PMID 25309781, PMC 4192807 (freier Volltext) (Review).
- ↑ A. Prete, R. M. Paragliola, S. M. Corsello: Iodine Supplementation: Usage “with a Grain of Salt”. In: International journal of endocrinology, Band 2015, 2015, S. 312305, doi:10.1155/2015/312305, PMID 25873950, PMC 4383497 (freier Volltext) (Review).
- ↑ Claudia Reusch: Hypothyreose. In: Peter F. Suter, Hans G. Niemand (Hrsg.): Praktikum der Hundeklinik. 10. Auflage. Paul-Parey-Verlag, 2006, ISBN 3-8304-4141-X, S. 922–925.
- ↑ Ulbrich, Hoffmann, Drochner: Fütterung und Tiergesundheit. Eugen Ulmer Verlag, Stuttgart 2004.
- ↑ K. Gabrisch, P. Zwart: Krankheiten der Heimtiere. 6. Auflage. Schlütersche Verlagsgesellschaft, Hannover 2005, ISBN 3-89993-010-X.