Aortendissektion
| Klassifikation nach ICD-10 | |
|---|---|
| I71.0 | Dissektion der Aorta (jeder Abschnitt) |
| ICD-10 online (WHO-Version 2019) | |

Als Aortendissektion beziehungsweise Aneurysma dissecans aortae bezeichnet man in der Medizin eine Aufspaltung der Wandschichten der Hauptschlagader (Aorta), meist verursacht durch einen Einriss der inneren Gefäßwand (Tunica intima) mit nachfolgender Einblutung zwischen den Schichten. Sie verursacht in aller Regel plötzliche, heftige Schmerzen und ist unmittelbar lebensbedrohlich, weil sie zu einem Aufplatzen der Hauptschlagader (Aortenruptur) und zu akuten Durchblutungsstörungen verschiedener Organe führen kann. Während sie noch vor 50 Jahren meist tödlich endete, überlebt heute die Mehrzahl der Betroffenen. Dies ist hauptsächlich einer möglichst rasch eingeleiteten Operation der gefährlichsten Formen zu verdanken. Eine unverzügliche Diagnostik ist deshalb bei dieser Krankheit von entscheidender Bedeutung.
Entstehung
[Bearbeiten | Quelltext bearbeiten]
1 Adventitia – 2 Media – 3 Intima


Die Gefäßwand der Aorta besteht, von außen nach innen betrachtet, aus den drei Schichten Adventitia (Tunica adventitia), Media (Tunica media) und Intima (Tunica intima). Wenn die elastischen oder muskulären Anteile der Media geschwächt sind, kann sich eine Blutung dort mehr oder weniger ungehindert ausdehnen und zu einer Aufspaltung (Dissektion) der Gefäßwand zwischen Intima und Adventitia führen.
Als unmittelbare Auslöser der Dissektion werden zwei verschiedene Mechanismen diskutiert. Am häufigsten kommt es zunächst zu einem Einriss der Intima, der dem Blutstrom einen Zugang zur Media öffnet. Durch diese Öffnung (engl.: entry) presst der arterielle Blutdruck das Blut zwischen Intima und Adventitia, wo es sich meist in Längsrichtung des Gefäßes weiter ausdehnt und einen künstlichen Raum („falsches Lumen“) schafft.
Seltener scheint eine Blutung in die Media als primäres Ereignis zu einem zunächst kleinen Bluterguss (Hämatom) zu führen. Sie stammt aus den Versorgungsgefäßen (Vasa vasorum, vgl. Gefäß) der Aorta und verschafft sich in vielen Fällen erst sekundär Zugang zum Gefäßlumen, wenn der Druck des Blutergusses die Intima zerreißt. Einige dieser Hämatome sind auf die Gefäßwand beschränkt und bleiben ohne Verbindung zum Blutstrom in der Aorta (intramurales Hämatom).
Die Ausdehnung der Dissektion hängt wesentlich vom Blutdruck als treibende Kraft und der Widerstandsfähigkeit der Media ab. Sie kann wenige Millimeter betragen oder auch die gesamte Länge der Aorta erfassen, bis in die Beckenarterien und auch in Seitenäste wie die Halsschlagadern und die Nierenarterien hinein reichen.
Risikofaktoren
[Bearbeiten | Quelltext bearbeiten]Die häufigsten prädisponierenden Faktoren sind eine Strukturschwäche der Media (s.g. Mediadegeneration) und die Arteriosklerose.
Die Mediadegeneration führt zunächst zu einer Erweiterung der Aorta ascendens und wird in der Mehrzahl der Fälle (80 %) von einer nicht ausreichend therapierten Bluthochdruckerkrankung verursacht. Seltener sind angeborene Erkrankungen, die mit Bindegewebsveränderungen (Marfan-Syndrom, Ehlers-Danlos-Syndrom, bikuspidale Aortenklappe) einhergehen. Ursächlich ist hierbei eine altersüberdurchschnittlich starke zystische Medianekrose.[1]
Auch für die Entwicklung der Arteriosklerose haben die beiden Faktoren Alter und Blutdruck eine große Bedeutung. Sie führt unter anderem zu flächigen Wandablagerungen (Plaques) an der Intima, die zum Aufreißen (Plaqueruptur) neigen, was zu teilweise tiefen Blutungskratern führen kann. Diese auch als Ulkus bezeichneten Krater können die Eintrittspforte für eine Dissektion bilden.
Seltene Ursachen für eine Aortendissektion sind die Aortenisthmusstenose und entzündliche Erkrankungen der Schlagadern (Arteriitis, vgl. Vaskulitis) mit Beteiligung der Aorta. Ungeklärt ist die beobachtete Häufung von Dissektionen nach Aufnahme von Kokain oder Crack sowie im Zusammenhang mit einer Schwangerschaft. Etwa die Hälfte aller Dissektionen bei unter 40-jährigen Frauen tritt im letzten Drittel der Schwangerschaft oder kurz nach der Entbindung auf. Da bei diesen Patientinnen aber häufig ein Marfan-Syndrom oder ein Bluthochdruck (Hypertonie) vorliegt, wird die Bedeutung der Schwangerschaft als Dissektionsursache eher angezweifelt.[2]
Äußere Einflüsse sind als Ursachen einer Aortendissektion selten. Sie führen zu umschriebenen Einrissen, Blutergüssen oder bei starker Gewalteinwirkung zum Abriss der Aorta. Verletzungen können auch durch medizinische Eingriffe (iatrogen) herbeigeführt sein, wie im Rahmen einer Katheteruntersuchung oder einer Herzoperation, besonders nach operativem Ersatz der Aortenklappe.
Bis zu 18 % der Patienten mit Aortendissektion sind irgendwann zuvor am Herzen operiert worden.
Unerwünschte Arzneimittelwirkungen stellen ein weiteres Risiko dar. So können bspw. Fluorchinolone möglicherweise eine Aortendissektion begünstigen oder auslösen. Retrospektive klinische Studien assoziieren die Einnahme von Fluorchinolonen mit einer mehr als 2-fachen Risikoerhöhung für Aortenaneurysmen und Aortendissektionen.[3][4] Experimentelle Daten legen nahe, dass Fluorchinolon-induzierte Aortendissektionen auf einer Nekroptose (in vivo) oder Apoptose aortischer glatter Muskelzellen (in vitro) und einer Zerstörung der extrazellulären Matrix der Aortenwand beruhen und bei gleichzeitig bestehender Atherosklerose zu tödlichen Aortenrupturen führen können.[5]
Pathologie
[Bearbeiten | Quelltext bearbeiten]
* = Riss der Intima

(histologisches Präparat)
Die Aortendissektion entsteht zu 80 % oberhalb[6] und zu 65 % wenige Zentimeter oberhalb der Aortenklappe, im ansteigenden Abschnitt der Aorta (Aorta ascendens), und zu 20 % unmittelbar nach Abgang der linken Schlüsselbeinarterie (Arteria subclavia sinistra), im absteigenden Abschnitt der Aorta (Aorta descendens). Des Weiteren sind der Aortenbogen mit 10 % oder die Bauchschlagader (Aorta abdominalis) mit 5 % betroffen.
Pathologisch lässt sich bei der Mehrzahl der Patienten das Bild der klassischen Aortendissektion mit einer Dissektionsmembran und einem Riss in der Intima im Sinne des entry nachweisen. Bei etwa 10–17 % der Obduktionen findet sich allerdings kein solches entry, so dass von einem intramuralen Hämatom (Bluterguss in der Gefäßwand) gesprochen wird.
Die Intima ist im Verlauf der Dissektion oft verdickt, die Media dünn mit Schäden an ihren elastischen und muskulären Anteilen. Die Adventitia ist im akuten Stadium durch den erhöhten Druck oft ballonähnlich aufgeweitet und verdünnt, während sie in chronischen Stadien eher bindegewebig verdickt erscheint.
Bei bis zu 25 % der Patienten zeigt sich histologisch eine zystische Medianekrose (u. a. vom Typ der Idiopathischen Medianekrose Erdheim-Gsell), diese Befunde sind bei Patienten vor dem 50. Lebensjahr häufiger als bei älteren.
Seltener findet man an der Aortenwand im Bereich atherosklerotischer Wandauflagerungen ein kraterförmiges Geschwür, das sich durch die Wandschichten „gefressen“ und entweder zum Aufplatzen des Gefäßes (Aortenruptur) oder zu einer Dissektion geführt hat. Ein solches penetrierendes atherosklerotisches Ulkus ist häufiger bei älteren Patienten mit Bluthochdruck und bei Rauchern anzutreffen.
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Epidemiologische Daten lassen jährlich drei Neuerkrankungen pro 100.000 Einwohner (Inzidenz) erwarten. Eine Arbeit aus dem Jahre 2017 zeigt eine Inzidenz von bis zu 11,9 Aortendissektionen pro 100.000 Einwohner.[7] Für 1998 rechnete das Statistische Bundesamt mit 4,5 Todesfällen durch Aortendissektion pro 100.000 Einwohner. Bei über 65-Jährigen steht die Dissektion zusammen mit dem Aortenaneurysma als „Aortenerkrankung“ an 13. Stelle der Todesursachenstatistik.
Männer erkranken doppelt bis dreimal so häufig wie Frauen. Am häufigsten sind Aortendissektionen bei 50- bis 70-Jährigen, allerdings sind Patienten mit angeborenen begünstigenden Faktoren oft schon im frühen Erwachsenenalter betroffen.
Aus unbekannten Gründen treten Aortendissektionen bevorzugt in den Wintermonaten auf. Von den knapp 1000 bis zum Jahr 2005 im internationalen Register International Registry of Acute Aortic Dissection (IRAD) erfassten Patienten erlitten 28,4 % die Dissektion im Winter, nur 19,9 % im Sommer. Ebenfalls unklar ist, warum sich die meisten Dissektionen am Vormittag zwischen 6:00 und 12:00 Uhr ereignen.
Formen thorakaler Aortendissektionen
[Bearbeiten | Quelltext bearbeiten]
|
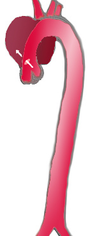
|

| |
| Häufigkeit | 60 % | 10–15 % | 25–30 % |
| Typ | DeBakey I | DeBakey II | DeBakey III |
| Stanford A | Stanford B | ||
| Proximal | Distal | ||
| Klassifikationen der Aortendissektion nach DeBakey und P. O. Daily | |||
Mit Blick auf die Gefährdung des Patienten und die therapeutischen Konsequenzen hat sich eine strikte Unterscheidung zwischen Aortendissektionen mit und ohne Beteiligung der Aorta ascendens durchgesetzt. Die heute gebräuchlichen Klassifikationen sind an diesem Kriterium orientiert.
1965 schlug der US-amerikanische Chirurg DeBakey eine Einteilung in drei Kategorien (Typ DeBakey I bis III) vor. Beim Typ I sind sowohl die Aorta ascendens als auch die Aorta descendens betroffen, beim Typ II nur die Aorta ascendens und beim Typ III nur die Aorta descendens.
Um die Gefährdung des Patienten und die wichtigsten therapeutischen Schritte unmittelbar aus der Klassifikation ableiten zu können, wurde diese Einteilung 1970 von Daily und Mitarbeitern von der Stanford University noch vereinfacht. Sie fassten die Typen DeBakey I und DeBakey II zusammen und unterschieden nur noch, ob die "Entry" im Bereich der Aorta ascendens (Typ Stanford A oder proximale Dissektion) oder distal der linken Arteria subclavia liegt (Typ Stanford B oder distale Dissektion). Diese Klassifikation hat sich heute am weitesten durchgesetzt.
| Klassifikation nach ICD-10-GM | |
|---|---|
| I77.80 | Penetrierendes Aortenulkus [PAU] |
| ICD-10 online (GM-Version 2024) | |
Umstritten ist noch, wie das von vielen als „Vorstufe“ oder „enge Verwandte“ der Aortendissektion betrachtete intramurale Hämatom (IMH) und das penetrierende Ulkus einzuordnen sind. Das IMH wird oft als Dissektion angesehen und bezeichnet. In den westlichen Ländern besteht auch Einigkeit, es wie eine Dissektion zu behandeln. In asiatischen Ländern wird zwischen beiden strikter getrennt und für das IMH eine eher konservative Therapie befürwortet, da es häufiger zu Spontanheilungen kommt.
| Klasse 1 | Klassische Dissektion mit entry und Membran | ||
| Klasse 2 | Mediaspaltung mit intramuraler Blutung | ||
| Klasse 3 | Intimariss mit diskreter Aussackung | ||
| Klasse 4 | Aortenulkus nach Plaqueruptur | ||
| Klasse 5 | Iatrogene oder traumatische Dissektion | ||
| Erweiterte Klassifikation (u. a. ESC 2001) | |||
Eine 1989 vorgeschlagene und 2001 von einer Arbeitsgruppe der European Society of Cardiology (ESC) übernommene Klassifikation umfasst auch solche Veränderungen der Aorta, die zwar keine Dissektion im klassischen Sinn sind, ihr aber ähneln oder vorausgehen. Zwar hat sich diese Klassifikation in der klinischen Routine bislang nicht durchgesetzt, durchaus aber eine gemeinsame Betrachtung dieser in vielerlei Hinsicht ähnlichen Erkrankungen der Aorta. Der zunehmend gebräuchliche Ausdruck „Akutes Aortensyndrom“[8] fasst Aortendissektion, intramurales Hämatom, Aortenulkus und Ruptur eines Aortenaneurysmas zusammen.
Als akut wird eine Dissektion bezeichnet, wenn ihre Symptome nicht länger als 14 Tage bestehen. Andernfalls spricht man von einer chronischen Dissektion.
Krankheitsbild
[Bearbeiten | Quelltext bearbeiten]Das Krankheitsbild variiert in Abhängigkeit vom betroffenen Aortenabschnitt und der Beteiligung von Seitenästen stark. Das Spektrum reicht vom Fehlen jeglicher Symptome und Krankheitszeichen bis zum plötzlichen Herztod durch eine frühe Ruptur der Aorta oder den Verschluss eines Herzkranzgefäßes.
Beginnt die Dissektion proximal, also in der aufsteigenden Aorta, so stehen Komplikationen von Seiten des Herzens im Vordergrund. Eine Ruptur in den Herzbeutel führt zum blutigen Perikarderguss mit drohender Perikardtamponade. Eine Aufweitung der Aortenwurzel oder gar das Fortschreiten der Dissektion in die Segel der Aortenklappe kann deren Schlussunfähigkeit (Aortenklappeninsuffizienz) nach sich ziehen. Die Ausweitung der Dissektion in eines der Herzkranzgefäße hat oft eine Durchblutungsstörung des Herzmuskels bis hin zum Herzinfarkt zur Folge.
Durchblutungsstörungen der Arme und des Kopfes (Aortenbogen-Syndrom) weisen auf eine Beteiligung des Aortenbogens hin. In der absteigenden Aorta kann eine Dissektion zu Durchblutungsstörungen des Darmes, der Nieren, der Beine und des Rückenmarks führen.
Symptome
[Bearbeiten | Quelltext bearbeiten]Typisch für die Aortendissektion und Leitsymptom ist ein heftiger und plötzlich einsetzender Schmerz, der von 80–96 % aller Betroffenen beschrieben wird. Er wird oft als reißend oder stechend erlebt und beginnt in der Regel sofort mit maximaler Intensität. Meist ist er so stark, dass das Ereignis von Patienten, Angehörigen und auch Ärzten als hochakut und bedrohlich eingeschätzt wird. Nicht selten krümmen sich die Patienten vor Schmerz oder werden bewusstlos. Bei proximalen Dissektionen beginnt der Schmerz im Brustbereich, bei distalen häufig im Rücken zwischen den Schulterblättern. Knapp jeder fünfte Patient empfindet den Schmerz als wandernd, was mit dem Fortschreiten der Dissektion entlang des Aortenverlaufs begründet wird. Allerdings kann die Dissektion auch schmerzlos („stumm“ oder asymptomatisch) verlaufen, so dass sie gelegentlich nur durch Zufall bei beschwerdefreien Menschen entdeckt wird.
Eventuelle weitere Symptome sind seltener, sie werden von den möglichen Komplikationen verursacht:
- Luftnot und Schocksymptome bei einer Herzbeteiligung,
- Schmerzen in den betroffenen Extremitäten bei Durchblutungsstörungen der Arme oder Beine,
- Symptome eines Schlaganfalls bei Beteiligung der hirnversorgenden Arterien,
- Bauch- oder Flankenschmerzen bei Durchblutungsstörungen des Darmes oder der Nieren,
- Lähmungserscheinungen bei einer Minderdurchblutung des Rückenmarks,
- starke, plötzlich eintretende Kieferschmerzen
Klinische Zeichen
[Bearbeiten | Quelltext bearbeiten]Typische klinische Zeichen der Aortendissektion selbst gibt es nicht, diese ergeben sich erst aus den möglichen Folgen. Bei größeren Blutverlusten imponieren die Zeichen des Schocks wie Pulsbeschleunigung, Blutdruckabfall und Bewusstseinstrübung. Durchblutungsstörungen der Extremitäten führen dort zur Pulsabschwächung oder zum Pulsverlust. Eine Minderdurchblutung des Darmes kann einen Mesenterialinfarkt mit entsprechenden Zeichen verursachen, Durchblutungsstörungen des Gehirns haben Zeichen des Schlaganfalls zur Folge. Eine Aortenklappeninsuffizienz kann bei der Auskultation durch das typische diastolische Herzgeräusch identifiziert werden, während ein Perikarderguss durch eine Abschwächung der Herztöne und einen paradoxen Puls (Pulsus paradoxus) auffallen kann.

1 Mediastinum und
2 Aortenknopf
Technische Befunde
[Bearbeiten | Quelltext bearbeiten]Entscheidende Untersuchungsverfahren bei einem Dissektionsverdacht sind die Röntgenaufnahme der Thoraxorgane, die Ultraschalluntersuchung (Sonografie) insbesondere in Form der transösophagealen Echokardiografie (TEE), die Computertomografie (CT) und die Magnetresonanztomografie (MRT), in Einzelfällen auch die Angiografie.
Auf einer normalen Röntgenaufnahme ist die Dissektion selbst nicht zu erkennen, indirekte Hinweise in Form einer Verbreiterung oder Doppelkontur des Mittelfells (Mediastinum) oder der Aorta können aber sichtbar sein. So ist eine Mediastinalverbreiterung bei etwa 63 % der Patienten mit einer Typ-A-Dissektion und etwa 56 % derer mit Typ-B-Dissektion nachweisbar. Insgesamt findet sich bei Dissektionsverdacht in 60–90 % der Röntgenaufnahmen irgendein auffälliger Befund, das Fehlen eines solchen Befundes schließt jedoch eine Dissektion keineswegs aus.

|

|
| Transösophageale Echokardiografie (TEE) |
TEE mit Farbdoppler farbig wahres Lumen |
| Querschnitt durch die Aorta ascendens 1 Dissektionsmembran – 2 Aortenklappe | |
Bei der üblichen Ultraschalluntersuchung des Bauchraumes (abdominelle Sonografie) können die im Bauchraum gelegenen Abschnitte der Aorta (Aorta abdominalis) meist dargestellt und mehr oder weniger gut beurteilt werden. Zusätzlich sind im Rahmen der normalen Ultraschalluntersuchung des Herzens (Echokardiografie) oft die ersten zwei bis fünf Zentimeter der Aorta mäßig gut beurteilbar. Insgesamt ist aber die diagnostische Genauigkeit der einfachen Ultraschallverfahren zur Erkennung von Aortenerkrankungen nur mäßig, weil die Darstellungsqualität durch die Brust- und Bauchwand hindurch oft schlecht ist und Teile der Aorta ascendens sowie der Aortenbogen und die im Brustraum gelegenen Abschnitte der Aorta descendens nicht beurteilbar sind (Sensitivität 59–85 %, Spezifität 63–96 %).
Die TEE hingegen erlaubt eine gute Darstellung der herznahen Aortenabschnitte und der Aorta descendens im Brustraum. Aufgrund der hohen räumlichen Auflösung ist eine vorhandene Dissektionsmembran fast immer zu erkennen, mit Hilfe der Dopplertechnik kann darüber hinaus das wahre Lumen zuverlässig vom falschen Lumen abgegrenzt werden. In vielen Fällen sind das entry und ein evtl. vorhandenes re-entry sichtbar. Eine Aortenklappeninsuffizienz kann ebenso exakt diagnostiziert werden wie ein Perikarderguss. Hingegen sind Veränderungen am Aortenbogen, an den dort entspringenden hirnversorgenden Gefäßen und an der Aorta abdominalis in der TEE oft unzureichend dargestellt, diese Regionen werden auch als „blinde Flecken“ der TEE bezeichnet. Die Sensitivität zur Erkennung von Aortenerkrankungen beträgt 88–99 %, die Spezifität 95–98 %.

|

|
| Computertomografie (CT) | Legende |
| Aortendissektion Typ Stanford A 1 Aorta ascendens, wahres Lumen – 2 falsches Lumen – 3 Lungenschlagader 4 Aorta descendens – 5 Brustwirbelkörper | |
Eine mit Kontrastmittel durchgeführte CT gestattet eine umfassende und exakte Darstellung der gesamten Aorta und kann sowohl die Dissektion selbst als auch deren räumliche Beziehung zu den Seitenästen der Aorta und eventuelle Blutungen in der Umgebung zuverlässig darstellen. Eine mögliche Beteiligung der Aortenklappe ist allerdings nicht erkennbar, die klappennahen Aortenabschnitte sind auf Grund von Artefakten durch das schlagende Herz bei älteren CT-Geräten schwieriger zu beurteilen. Mit diesen Geräten wurde in mehreren Studien eine Sensitivität von 83–94 % und eine Spezifität von 87–100 % ermittelt, moderne Spiral-CT erreichen eine Sensitivität von durchschnittlich mehr als 95 %.
Ähnlich exakt und umfassend ist die Darstellung in der MRT, für die kein iodhaltiges Kontrastmittel benötigt wird und die auch eine zuverlässige Beurteilung der Aortenklappe erlaubt. Die MRT erzielt mit jeweils fast 100 % die beste Sensitivität und Spezifität für die Diagnose einer Aortendissektion.
Bei der Angiografie sind die Seitenäste der Aorta und auch eine evtl. vorhandene Aortenklappeninsuffizienz gut beurteilbar, die Dissektion führt zu einer unterschiedlichen Kontrastanfärbung des wahren und des falschen Lumens sowie zu einer ungewöhnlichen Ausbreitung des Kontrastmittels. Die Sensitivität der Angiografie ist mit etwa 70 % geringer als bei den vorgenannten Verfahren, hauptsächlich bedingt durch die mangelhafte Erkennung von Dissektionen ohne Verbindung zum wahren Lumen der Aorta. Die Spezifität in der Größenordnung von 95 % hingegen ist hoch.
Andere Untersuchungstechniken helfen nicht weiter, auch Laboruntersuchungen sind bislang bei der Aortendissektion wenig hilfreich. So lässt sich zwar bei hohen Blutverlusten eine Anämie nachweisen, bei Thrombosierung des falschen Lumens eine Erhöhung der D-Dimere und bei größeren Dissektionen auch der Leukozytenzahl sowie des C-reaktiven Proteins, diese Veränderungen sind aber zu vieldeutig (unspezifisch), um zur Differenzialdiagnose beizutragen. Zukünftig könnten Metalloproteinasen und Myosinschwerketten für die labormedizinische Diagnostik der Aortendissektion eine Rolle spielen.
Krankheitsverlauf
[Bearbeiten | Quelltext bearbeiten]Der weitere Verlauf einer Aortendissektion ist variabel und nur unsicher vorhersehbar. Der hohe Druck im falschen Lumen kann innerhalb von Minuten zum Zerreißen der Gefäßaußenschicht (Adventitia) und so zum tödlichen Verbluten führen. Ebenso möglich ist ein weiteres Fortschreiten der Dissektion entlang des Gefäßverlaufes. Dies kann „mehrzeitig“ in Schüben geschehen und durch die Ausweitung der Dissektion auf die Nieren-, Darm- oder Beinarterien zu einzelnen Episoden weiterer Organbeteiligungen führen.
Wenn der Blutstrom im falschen Lumen durch eine oder mehrere weitere Öffnungen in der Intima (re-entry) wieder in das wahre Lumen geleitet wird, ist die Gefahr der Ruptur zunächst geringer. Die zwei durchströmten und von der Dissektionsmembran getrennten Lumina können über Jahre bestehen bleiben. Diese Situation ist für die unkomplizierten chronischen Dissektionen Typ Stanford B typisch. Auch eine „Pseudoheilung“ durch Thrombosierung des falschen Lumens ist möglich.
Diagnose
[Bearbeiten | Quelltext bearbeiten]
1 Aorta descendens mit Dissektion
2 Linke Schlüsselbeinarterie
3 Aorta ascendens
Die Aortendissektion ist einer der dringlichsten Notfälle in der Kardiologie und Herzchirurgie; ihre Diagnostik ist anspruchsvoll, weil sie den Einsatz aufwändiger und nicht überall sofort verfügbarer Verfahren unter Zeitdruck erfordert. Die hohe Sterblichkeit von ein bis zwei Prozent pro Stunde im Fall der Typ-A-Dissektion in der Akutphase zwingt zu einer unverzüglichen Klärung der Verdachtsdiagnose mittels transösophagealer Echokardiografie (TEE), CT oder MRT.
Anfangsverdacht
[Bearbeiten | Quelltext bearbeiten]Jeder plötzliche starke Schmerz im Rücken, Brust- oder Bauchraum, für den keine andere plausible Erklärung zu finden ist, muss auch an eine Aortendissektion oder ein Aortenaneurysma denken lassen. Insbesondere bei zusätzlichen Hinweisen wie erhöhtem Blutdruck (49 % der Patienten mit Aortendissektion), Puls- oder Blutdruckdifferenzen (31 %), einem diastolischen Herzgeräusch (28 %) oder fokalen neurologischen Defiziten (17 %) muss der Verdacht auf eine Aortendissektion geäußert und geklärt werden, sofern keine andere Ursache bewiesen ist.
Untersuchungsablauf
[Bearbeiten | Quelltext bearbeiten]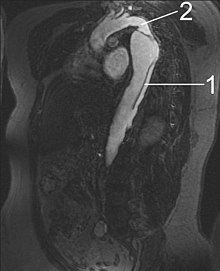
1 Aorta descendens mit Dissektion
2 Aortenisthmus
Der einmal entstandene Verdacht auf eine Aortendissektion muss schnellstmöglich mit Hilfe eines der geeigneten bildgebenden Verfahren bestätigt oder ausgeschlossen werden. Die Auswahl des Verfahrens hängt von dessen Verfügbarkeit, der Erfahrung des beteiligten Untersuchers und dem Zustand des Patienten ab.
- Transthorakale und transösophageale Echokardiografie sind in fast jedem Krankenhaus verfügbar und können auch bei instabilen Patienten auf der Intensivstation oder im Operationssaal durchgeführt werden. Die Risiken sind minimal, eine Strahlenbelastung entsteht nicht. Die Genauigkeit der Echokardiografie ist sehr von der Erfahrung der Untersucher abhängig.
- Auch die Computertomografie ist weit verbreitet, erfordert aber immer einen Transport des Patienten in die Röntgenabteilung, wo die Überwachungsmöglichkeiten eingeschränkt sein können. Die CT ist mit einer nicht unerheblichen Strahlenbelastung verbunden, die allerdings in Anbetracht der weitreichenden Konsequenzen einer evtl. Fehldiagnose zumindest bei Nicht-Schwangeren in Kauf genommen werden muss. Die erforderliche Kontrastmittelgabe führt zu einem zusätzlichen Risiko einer allergischen Reaktion oder einer Nierenfunktionsstörung bei etwa einer von hundert Untersuchungen.
- Die Magnetresonanztomografie ist hinsichtlich der diagnostischen Genauigkeit zwar am vorteilhaftesten, jedoch nur an wenigen Krankenhäusern rund um die Uhr verfügbar. Außerdem ist die Überwachungsmöglichkeit der Patienten durch die Bauart der üblichen Geräte oft stark eingeschränkt, so dass die MRT für instabile Patienten nur bedingt geeignet ist. Zusätzliche Risiken bestehen kaum; die evtl. eingesetzten Kontrastmittel sind, eine normale Nierenfunktion vorausgesetzt, gut verträglich. Die Untersuchung von Patienten mit metallischen Fremdkörpern oder Herzschrittmachern ist wegen der intensiven Magnetfelder nicht unproblematisch.
In der Praxis wurde als erstes diagnostisches Verfahren bei über 1000 Patienten im Register IRAD bei 61 % die CT, bei 33 % die Echokardiografie (TTE und TEE), bei 4 % die Angiografie und bei 2 % die MRT eingesetzt. Recht häufig wurde die Diagnostik durch ein zweites Verfahren ergänzt, im Durchschnitt wurden 1,8 Verfahren angewandt. Als zweites Verfahren kam am häufigsten die Echokardiografie (56 %) zur Anwendung, gefolgt von CT (18 %), Angiografie (17 %) und MRT (9 %).
Differenzialdiagnose
[Bearbeiten | Quelltext bearbeiten]Angesichts des Leitsymptoms wird bei einer Aortendissektion zunächst auch an andere Erkrankungen mit ähnlich heftigen und plötzlich beginnenden Schmerzen gedacht. Ein Herzinfarkt kann oft anhand des Elektrokardiogramms (EKG) abgegrenzt werden. Bei der Differenzialdiagnose des Brustschmerzes ist das akute Aortensyndrom nach dem akuten Koronarsyndrom und vor der Lungenembolie die zweithäufigste lebensbedrohende Krankheit. Auf 80 bis 300 Patienten mit einem akuten Koronarsyndrom kommt in der Notaufnahme ein Patient mit akutem Aortensyndrom.
Gallen- oder Nierenkoliken sind häufig mit Hilfe der Ultraschalluntersuchung zu unterscheiden. Gelegentlich hilft eine erhöhte Pankreaslipase im Rahmen der Labordiagnostik weiter, weil sie eine Entzündung der Bauchspeicheldrüse nahelegt.
Oft jedoch ergeben die genannten Verfahren keinen wegweisenden Befund, so dass eine transösophageale Echokardiografie oder eine Computertomografie wegen des kritischen Zeitfaktors unumgänglich sind. Erst wenn damit eine Dissektion hinreichend sicher ausgeschlossen wurde, sind weitere Untersuchungen sinnvoll, die dann von der Lungenembolie über einen Bandscheibenvorfall oder einen „eingeklemmten Nerv“ bis hin zur Rippenfellentzündung eine Vielzahl anderer Schmerzursachen aufdecken können.
Prognose
[Bearbeiten | Quelltext bearbeiten]Noch bis in die 1960er Jahre war die Prognose für Patienten mit einer Aortendissektion katastrophal. Akute Typ-A-Dissektionen waren in unterschiedlichen Studien mit einer Sterblichkeit (Letalität) von 30–70 % innerhalb von 24 Stunden und 80–95 % in der ersten Woche belastet. Da drei von vier Todesfällen in den ersten zwei Wochen auftraten, wurde die Gefährdung bei chronischen Dissektionen geringer eingeschätzt, kaum ein Patient überlebte aber das erste Jahr.
| Zeitraum | Ohne Operation | Mit Operation |
|---|---|---|
| In 24 Stunden | 20 % | 10 % |
| In einer Woche | 40 % | 13 % |
| In einem Monat | 50 % | 20 % |
| Letalität bei Typ-A-Dissektion | ||
Heute ist die Prognose dieser Patienten besser. Die in dem internationalen Register IRAD zusammengetragenen Daten von über 1100 Patienten zeigen für Typ-A-Dissektionen (vgl. Tab. „Letalität“) eine noch immer beträchtliche, aber eindeutig geringere Letalität.[9] Diese Zahlen verdeutlichen auch, dass die heute übliche Operation entscheidend zu dieser Prognoseverbesserung beiträgt.
Bei Dissektionen vom Typ B, die sich auf die Aorta descendens beschränken, ist die Prognose besser. Für sie fanden sich Ein- und Zwei-Jahres-Überlebensraten von 80–90 % unter rein medikamentöser Therapie. Aus den IRAD-Daten ergibt sich für diese Patientengruppe eine 30-Tage-Letalität von etwa 20 % für operierte Patienten und circa 10 % für jene, die nicht operiert werden mussten.
Therapie
[Bearbeiten | Quelltext bearbeiten]Bei einer akuten Dissektion steht neben einer angemessenen Schmerztherapie zunächst die Vermeidung von Komplikationen im Mittelpunkt. Unter engmaschiger Überwachung der Kreislaufparameter (Monitoring) werden bei Bluthochdruck Betablocker und evtl. Nitroprussid-Natrium zur Blutdrucksenkung auf systolische Werte um 110 mmHg eingesetzt, zur Schmerzbekämpfung in der Regel stark wirksame Opioide.
Ansonsten unterscheiden sich die Grundzüge der Therapie von Dissektionen in der herznahen Aorta (Typ Stanford A) von denen in der Aorta descendens (Typ Stanford B) wegen ihrer unterschiedlichen Prognose grundlegend.
Proximale Dissektion (Typ A)
[Bearbeiten | Quelltext bearbeiten]Bei einer akuten Dissektion Typ A gilt es, möglichst rasch die Gefahr der Ruptur zu bannen. Standardtherapie ist der sofortige operative Ersatz der Aorta ascendens durch eine Gefäßprothese. Gelegentlich ist auch im Rahmen des Notfalleingriffs die Rekonstruktion der Aortenklappe möglich. In der Regel wird aber die Aortenklappe bei Dissektion der klappennahen Aortenabschnitte und Patienten mit einer angeborenen Bindegewebserkrankung (z. B. Marfan-Syndrom) entfernt und eine Prothese mit integrierter Klappenprothese (klappentragendes Conduit oder Composite-Prothese) verwendet, an die auch die Herzkranzgefäße wieder „angeschlossen“ werden. Die 30-Tage-Sterblichkeit nach einer Operation bei Typ-A-Dissektion beträgt 15–30 %.
Auch bei chronischen Dissektionen vom Typ A wird fast immer eine operative Korrektur vorgenommen. Allerdings ist hier der Zeitfaktor von untergeordneter Bedeutung, so dass der Eingriff nicht notfallmäßig vorgenommen werden muss. Da überdies die Wandschichten besonders des falschen Lumens meist dicker sind als bei einer akuten Dissektion, sind die Nähte technisch einfacher anzulegen und von größerer Haltbarkeit.
Die Prothesen bestehen in der Regel aus gewebtem Dacrongewebe, welches zur primären Blutdichtigkeit mit Kollagen beschichtet ist. Ein Ersatz der großen Gefäße mit Goretexprothesen ist eher untypisch.
Distale Dissektion (Typ B)
[Bearbeiten | Quelltext bearbeiten]Bei unkomplizierten Typ-B-Dissektionen ist die 30-Tage-Sterblichkeit nach operativer Therapie mit etwa 25 % höher als bei rein medikamentöser Therapie mit weniger als 10 %. Aus diesem Grund wird nur bei lebensbedrohlichen Komplikationen operiert, etwa bei rasch zunehmendem Durchmesser der Aorta oder anderen Zeichen einer drohenden oder bereits erfolgten Ruptur.
Die Behandlung anderer Komplikationen erfolgt heute überwiegend interventionell, d. h. mit Hilfe von perkutan eingebrachten Kathetern. Dabei kann die Dissektionsmembran bei der perkutanen Intimamembranfensterung (PFA) durch einen oder mehrere Stents fixiert oder kathetertechnisch durch ein künstliches re-entry „gefenstert“ werden, um die Gefahr einer Ruptur zu mindern. Verschlossene Seitenäste können oft wieder eröffnet, dilatiert und mit einem Stent fixiert werden.
Stents in der Brustschlagader (Aorta thoracica) heißen TEVAR (thoracic endovascular aortic repair), in der Bauchschlagader (Aorta abdominalis) EVAR (endovascular aortic repair).
In unkomplizierten Typ-B-Dissektionen bietet eine zusätzliche endovaskuläre Intervention (Stenting) keinen Vorteil gegenüber einer optimalen medikamentösen Einstellung alleine, es zeigte sich in einer Studie eher ein (statistisch nicht signifikanter) Trend zu erhöhter 2-Jahressterblichkeit nach Stent-Implantation.[10]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die erste Beschreibung einer Aortendissektion datiert aus der Zeit Galens im zweiten Jahrhundert n. Chr., aus dem Jahr 1557 stammt eine Erwähnung durch Vesalius. Morgagni berichtete 1761 von einer Aortendissektion in den Perikardraum:
- Ein Mann … wurde von einem Schmerz des rechten und kurz darauf des linken Armes ergriffen, … danach erschien auf dem oberen Anteil des Brustbeines ein Tumor. … Er wurde angewiesen, ernsthaft und fromm an seinen Abschied von diesem sterblichen Leben zu denken, der unmittelbar bevorstand und unausweichlich war. (Übersetzung nach[11])
Der Begriff Dissektion stammt vermutlich von René Laënnec, der erstmals 1819 über das „Aneurysma dissecans“ schrieb. Den Grundstein zum heutigen Verständnis der Aortendissektion legte Shennan mit einer Publikation im Jahr 1934.[12]
Eine chirurgische Behandlung der Aortendissektion wurde erstmals 1935 von Gurin u. a. durch Fensterung der Dissektion versucht, der Patient überlebte nicht. Ebenfalls durch operative Fensterung behandelte 1955 Shaw, auch dieser Patient verstarb. Im gleichen Jahr allerdings berichtete ein US-amerikanisches Chirurgenteam um DeBakey über die erste erfolgreiche Operation bei einer akuten Aortendissektion. Für eine bessere präklinische Versorgung von Aortennotfällen wurde im Jahr 2015 am Deutschen Herzzentrum Berlin das bis dato einzigartige Konzept des „Aortentelefons“ entwickelt. Dabei wurde eine zentrale Notrufnummer für Berlin und Brandenburg eingerichtet, über die der Aortennotfall koordiniert und mit entsprechendem fachlichem Support unterstützt wird. Dadurch kam es zu einer deutlich besseren Versorgungszeit und einer Zunahme der Fallzahl.[13]
Tiermedizin
[Bearbeiten | Quelltext bearbeiten]Auch bei Rindern, Hunden und Katzen sowie mindestens einem Gorilla und einem afrikanischen Strauß wurden Aortendissektionen beschrieben. Sie werden allerdings fast ausschließlich erst nach dem Tod des Tieres (postmortal) diagnostiziert. Als Ursachen sind auch in der Veterinärmedizin u. a. erhöhter Blutdruck und angeborene Bindegewebserkrankungen ähnlich dem Marfan-Syndrom identifiziert worden. Wegen der anatomischen und pathophysiologischen Ähnlichkeiten wurden künstlich erzeugte Dissektionen bei Hunden und Schweinen auch bei der Erforschung operativer und interventioneller Therapieverfahren eingesetzt.
Bei Pferden kommen Aortenabrisse häufiger vor, nicht nur unter Belastung, sondern auch auf der Weide.[14][15] Bekannt wurde der Fall des Weltklasse-Springpferdes Hickstead.[16]
Literatur
[Bearbeiten | Quelltext bearbeiten]- E. M. Isselbacher: Aortic Dissection. In: DP Zipes u. a. (Hrsg.): Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 7. Auflage. W.B. Saunders, Philadelphia 2004, ISBN 1-4160-0014-3.
- Horst Rieger, Andreas L. Strauss, Werner Schoop (Hrsg.): Klinische Angiologie. 1. Auflage. Springer, Berlin 1998, ISBN 3-540-50899-6.
- R. Erbel u. a.: Diagnosis and Management of Aortic Dissection. (PDF; 622 kB) In: Eur Heart J., 2001, 22(18), S. 1642–1681, PMID 11511117 (englisch); Umfassende und kommentierte Empfehlungen der ESC Task Force
- Y von Kodolitsch u. a.: Das akute Aortensyndrom. In: Dtsch Arztebl. 2003, 100, S. A 326–333.
- E. Weigang u. a.: Management von Patienten mit Aortendissektion. In: Dtsch Arztebl., 2008, 105, S. A 639–645.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 405–425; hier: S. 406 f. (1. Auflage 1986)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Ultraschall-Filmsequenzen Aortendissektion und Aortenulkus (MOV) Steinkopff-Verlag
- Fallbeschreibung mit mehreren Filmsequenzen Echokardiografie, TEE und CT. (Flash) Journal für Kardiologie, 2005, Krause & Pachernegg Verlag
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Erdmann (Hrsg.): Klinische Kardiologie. 8. Auflage. Springer, Heidelberg 2011, ISBN 978-3-642-16480-4, S. 453 f.
- ↑ C. A. Nienaber u. a.: Diagnostik und Management der Aortendissektion – Orientierung zwischen Empfehlungen und Registerdaten. In: Kardiologie up2date. 2005, 1, S. 63–76.
- ↑ Nick Daneman, Hong Lu, Donald A. Redelmeier: Fluoroquinolones and collagen associated severe adverse events: a longitudinal cohort study. In: BMJ Open. Band 5, Nr. 11, 1. November 2015, S. e010077, doi:10.1136/bmjopen-2015-010077, PMID 26582407.
- ↑ Chien-Chang Lee, Meng-tse Gabriel Lee, Yueh-Sheng Chen, Shih-Hao Lee, Yih-Sharng Chen: Risk of Aortic Dissection and Aortic Aneurysm in Patients Taking Oral Fluoroquinolone. In: JAMA Internal Medicine. Band 175, Nr. 11, 1. November 2015, S. 1839–1847, doi:10.1001/jamainternmed.2015.5389.
- ↑ Scott A. LeMaire, Lin Zhang, Wei Luo, Pingping Ren, Chris Guardado: Abstract 15910: Ciprofloxacin Increases Susceptibility to Aortic Dissection and Rupture in Mice. In: Circulation. Band 136, Suppl 1, 14. November 2017, S. A15910 (circ.ahajournals.org [abgerufen am 21. Februar 2018]).
- ↑ J. Ostermeyer: Herz und herznahe Gefäße. In: Rudolf Häring, Hans Zilch (Hrsg.): Lehrbuch Chirurgie. 2., durchgesehene Auflage. De Gruyter, Berlin / New York 1988, ISBN 3-11-011280-9, S. 342–384, hier: S. 377.
- ↑ S.D. Kurz, V. Falk, J. Kempfert, M. Gieb, T.M. Ruschinski: Insight into the incidence of acute aortic dissection in the German region of Berlin and Brandenburg. In: International Journal of Cardiology. Band 241, August 2017, ISSN 0167-5273, S. 326–329, doi:10.1016/j.ijcard.2017.05.024 (elsevier.com [abgerufen am 8. Mai 2018]).
- ↑ H. Eggebrecht u. a.: Echokardiographische Abklärung des Patienten mit akutem Thoraxschmerz auf der Notfallstation. In: Intensivmed. 2006, 43, S. 64–77.
- ↑ R. H. Mehta u. a.: Predicting death in patients with acute type A aortic dissection. In: Circulation. 2002, 105, S. 200–206, PMID 11790701.
- ↑ C. A. Nienaber u. a.: Randomized Comparison of Strategies for Type B Aortic Dissection: The INvestigation of STEnt Grafts in Aortic Dissection (INSTEAD) Trial. In: Circulation, 2009, 120(25), S. 2519–2528, PMID 19996018.
- ↑ M. Klompas: Does This Patient Have an Acute Thoracic Aortic Dissection? In: JAMA, 2002, 287, S. 2262–2272, PMID 11980527.
- ↑ T. Shennan: Dissecting Aneurysms. His Majesty’s Stationery Office, London 1934. Medical Research Clinical Special Report Series No. 193
- ↑ Berliner Konzept „Aortentelefon“: Wenn die Arterienwand aufreißt. In: Ärzte Zeitung. Abgerufen am 8. Mai 2018.
- ↑ NRW-Landbeschäler Peking ist tot, Dominique Wehrmann, St. Georg, 28. März 2018
- ↑ Aortic Rupture, Marcia King, The Horse, 1. April 1999
- ↑ Hickstead: Aortaabriss bestätigt. St. Georg 10. November 2011