Miraculin
| Miraculin (Synsepalum dulcificum) | ||
|---|---|---|
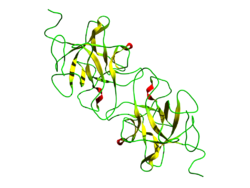
| ||
| Bändermodell nach PDB 3IIR | ||
| Masse/Länge Primärstruktur | 191 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Bezeichner | ||
| Externe IDs |
| |
| Inhibitorklassifikation | ||
| MEROPS | I03 | |
Miraculin ist ein Glykoprotein aus den Früchten der Wunderbeere (Synsepalum dulcificum), eines tropischen Sapotengewächses aus West- und Zentralafrika.[1][2]
Struktur
[Bearbeiten | Quelltext bearbeiten]Die Zusammensetzung von Miraculin wurde 1989 geklärt, sowohl der Polypeptidkette als auch der Anteile gebundener Monosaccharide.[3] Die Primärstruktur des Proteins ist eine Kette aus 191 Aminosäuren,[4] in der Quartärstruktur sind zwei über Disulfidbrücken verbundene Homodimere zu einem Tetramer zusammengelagert.[5]
Wirkung
[Bearbeiten | Quelltext bearbeiten]Miraculin selbst ist geschmacklos, doch wenn die menschliche Zunge Miraculin ausgesetzt wird, können auch eigentlich saure Speisen wie Zitrusfrüchte als süß wahrgenommen werden, sogar bis zu einer Stunde nach Einnahme.[6] Wird Miraculin gleichzeitig mit Saurem konsumiert, dauert es einen Moment, bis dieser Effekt eintritt. Bis das Miraculin zu wirken beginnt, schmeckt eine saure Mischung auch so, erst nach einer Verzögerung stellt sich ein süßer Geschmack ein, der den sauren bald überlagert.
Das Glykoprotein, ein Proteid mit einem Kohlenhydratanteil von etwa 14 %, heftet sich an einen Süßrezeptor von Sinneszellen in den Geschmacksknospen, bestehend aus T1R2 und T1R3, löst aber so noch keine Reaktion aus.[6] Isst man dann jedoch eine saure Speise, verschiebt sich das Milieu im Mund in den sauren pH-Wert-Bereich – und Miraculin nimmt dadurch eine etwas andere Form ein, es ändert sich die Konformation seiner Tertiärstruktur. In Folge der veränderten Gestalt werden nun die Geschmacksrezeptoren aktiviert und die Geschmackssinneszellen der Zunge gereizt, die nachgeschalteten afferenten Neuronen erregt, Signale den sensorischen Hirnnervenkernen (Nuclei tractus solitarii) im Markhirn zugeleitet und von dort an den gustatorischen Kortex weitergeleitet, sodass die Empfindung „intensiv süß“ wahrgenommen werden kann – obwohl die konsumierte Speise normalerweise einen sauren Geschmack hinterlassen würde.[7][8]
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Da die Wunderbeere selbst kaum Eigengeschmack hat, wurde die Geschmackskonversion als Wunder angesehen, daher der Name. In Westafrika wurde die Wunderbeere benutzt, um den Geschmack saurer Speisen zu verbessern.
Die aktive Substanz, die der japanische Wissenschaftler Kenzo Kurihara isolierte, wurde nach der Wunderbeere (englisch miracle fruit) benannt, als er seine Arbeit 1968 in Science veröffentlichte.[9] In Japan ist es als Süßungsmittel zugelassen.[10]
Miraculin wird zur Verwendung als energiearmer, für Diabetiker geeigneter Süßstoff untersucht, wie auch die Proteine Thaumatin, Mabinlin, Brazzein, Monellin, Pentadin und Curculin.[11] Die Herstellung ist derzeit allerdings noch zu teuer. Es gibt Versuche, Miraculin auf gentechnischer Basis herzustellen, wie z. B. in genveränderten Pflanzen wie der Tomate[12] und dem Gartensalat, die Miraculin produzieren. Auch Ansätze zur Produktion mittels gentechnisch veränderter Hefen[11] und Bakterien (Escherichia coli) wurden bereits beschrieben.[13]
Miraculin wird in den Vereinigten Staaten zur Linderung von Chemotherapie-induzierten Geschmacksstörungen verwendet.[14][15] Weiterhin wird es zur Verwendung als Süßungsmittel bei Patienten mit metabolischem Syndrom untersucht, um die Häufigkeit einer Krebserkrankung zu mindern.[16]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ K. B. Swamy, S. A. Hadi, M. Sekaran, M. R. Pichika: The clinical effects of Synsepalum dulcificum: a review. In: Journal of medicinal food. Band 17, Nummer 11, November 2014, S. 1165–1169, doi:10.1089/jmf.2013.3084, PMID 25314134.
- ↑ A. C. Akinmoladun, A. R. Adetuyi, K. Komolafe, O. O. Oguntibeju: Nutritional benefits, phytochemical constituents, ethnomedicinal uses and biological properties of Miracle fruit plant ( Shumach. & Thonn. Daniell). In: Heliyon. Band 6, Nummer 12, Dezember 2020, S. e05837, doi:10.1016/j.heliyon.2020.e05837, PMID 33426338, PMC 7785844 (freier Volltext).
- ↑ S. Theerasilp, Y. Kurihara: Complete amino acid sequence and structure characterization of the taste-modifying protein, miraculin. In: Journal of Biological Chemistry (JBC). Band 264. Jahrgang, Nr. 12, April 1989, S. 6655–6659, PMID 2708331 (englisch, jbc.org [PDF; abgerufen am 11. Oktober 2015]).
- ↑ UniProt P13087
- ↑ H. Igeta, Y. Tamura, K. Nakaya, Y. Nakamura, Y. Kurihara: Determination of disulfide array and subunit structure of taste-modifying protein, miraculin. In: Biochimica et Biophysica Acta (BBA). Band 1079. Jahrgang, Nr. 3, September 1991, S. 303–307, doi:10.1016/0167-4838(91)90073-9, PMID 1911854 (englisch).
- ↑ a b T. Misaka: Molecular mechanisms of the action of miraculin, a taste-modifying protein. In: Seminars in cell & developmental biology. Band 24, Nummer 3, März 2013, S. 222–225, doi:10.1016/j.semcdb.2013.02.008, PMID 23466289.
- ↑ A. Koizumi, A. Tsuchiya, K. Nakajima u. a.: Human sweet taste receptor mediates acid-induced sweetness of miraculin. In: Proceedings of the National Academy of Sciences of the United States of America. Band 108, Nummer 40, Oktober 2011, S. 16819–16824, doi:10.1073/pnas.1016644108, PMID 21949380, PMC 3189030 (freier Volltext).
- ↑ J. P. Slack, A. Brockhoff, C. Batram u. a.: Modulation of bitter taste perception by a small molecule hTAS2R antagonist. In: Current biology. (CB) Band 20, Nummer 12, Juni 2010, S. 1104–1109, doi:10.1016/j.cub.2010.04.043, PMID 20537538, PMC 2925244 (freier Volltext).
- ↑ K. Kurihara, L. Beidler: Taste-modifying protein from miracle fruit. In: Science. Band 161, September 1968, S. 1241–1243, PMID 5673432, doi:10.1126/science.161.3847.1241.
- ↑ Tim Schröder: Geschmackssinn: Unmögliches geschieht im Mund. In: FAZ. 17. März 2010 (faz.net).
- ↑ a b M. Bilal, L. Ji, S. Xu, Y. Zhang, H. M. Iqbal, H. Cheng: Bioprospecting and biotechnological insights into sweet-tasting proteins by microbial hosts-a review. In: Bioengineered. Band 13, Nummer 4, April 2022, S. 9815–9828, doi:10.1080/21655979.2022.2061147, PMID 35435127, PMC 9161876 (freier Volltext).
- ↑ K. Hiwasa-Tanase, T. Hirai, K. Kato, N. Duhita, H. Ezura: From miracle fruit to transgenic tomato: mass production of the taste-modifying protein miraculin in transgenic plants. In: Plant cell reports. Band 31, Nummer 3, März 2012, S. 513–525, doi:10.1007/s00299-011-1197-5, PMID 22160133.
- ↑ T. Matsuyama, M. Satoh, R. Nakata, T. Aoyama, H. Inoue: Functional expression of miraculin, a taste-modifying protein in Escherichia coli. In: Journal of biochemistry. Band 145, Nummer 4, April 2009, S. 445–450, doi:10.1093/jb/mvn184, PMID 19122203.
- ↑ Marlene K. Wilken, Bernadette A. Satiroff: Pilot study of ‘miracle fruit’ to improve food palatability for patients receiving chemotheraphy. In: Clinical Journal of Oncology Nursing. Band 16, Nr. 5, S. 173–177, DOI:10.1188/12.CJON.E173-E177 (Volltext als PDF)
- ↑ H. P. Soares, M. Cusnir, M. A. Schwartz u. a.: Treatment of taste alterations in chemotherapy patients using the ‘miracle fruit’: preliminary analysis of a pilot study. In: Journal of Clinical Oncology. Band 28, Nr. 15 Supplement, Artikel e19523, doi:10.1200/jco.2010.28.15_suppl.e19523.
- ↑ M. Gómez de Cedrón, S. Wagner, M. Reguero, A. Menéndez-Rey, A. R. de Molina: Miracle Berry as a Potential Supplement in the Control of Metabolic Risk Factors in Cancer. In: Antioxidants. Band 9, Nummer 12, Dezember 2020, S. , doi:10.3390/antiox9121282, PMID 33333960, PMC 7765360 (freier Volltext).