Alzheimer-Krankheit
| Klassifikation nach ICD-10 | |
|---|---|
| G30.0† F00.0* | Demenz bei Alzheimer-Krankheit, mit frühem Beginn (Typ 2) |
| G30.1† F00.1* | Demenz bei Alzheimer-Krankheit, mit spätem Beginn (Typ 1) |
| G30.8† F00.2* | Demenz bei Alzheimer-Krankheit, atypische oder gemischte Form |
| G30.9† F00.9* | Demenz bei Alzheimer-Krankheit, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| 8A20 | Alzheimer-Krankheit |
| 6D80 | Demenz durch Alzheimer-Krankheit |
| ICD-11: Englisch • Deutsch (Entwurf) | |

Normal: Vergleichsbild ohne Alzheimer-typische Veränderungen.
MCI: Mild cognitive impairment, Frühphase der Erkrankung mit nur leichten Einschränkungen. Als Zeichen der Schrumpfung des Gehirns sind die dunklen, flüssigkeitsgefüllten Räume außer- und innerhalb des Gehirns und die Abstände zwischen den Windungen vergrößert.
AD: Alzheimer-Krankheit mit deutlicher Schrumpfung des Gehirns.
Die Alzheimer-Krankheit (lateinisch Morbus Alzheimer, auch Alzheimer-Demenz, kurz Alzheimer[1] oder AD von englisch Alzheimer's disease[2]) ist eine neurodegenerative Erkrankung des Menschen, die in ihrer häufigsten Form bei Personen über dem 65. Lebensjahr auftritt und durch zunehmende Demenz gekennzeichnet ist. Sie ist für 60 bis 70 Prozent aller Demenzerkrankungen verantwortlich.
Charakteristisch ist eine zunehmende Verschlechterung der kognitiven Leistungsfähigkeit, die in der Regel einhergeht mit einer Abnahme der Fähigkeit, die Aktivitäten des täglichen Lebens zu bewältigen, mit zunehmenden Verhaltensauffälligkeiten und verstärkt auftretenden neuropsychiatrischen Symptomen.
Bereits viele Jahre bevor erste klinische Symptome sichtbar werden, bilden sich im Gehirn des Betroffenen Plaques, die aus fehlerhaft gefalteten Beta-Amyloid-(Aβ-)Peptiden bestehen. Zusammen mit den Plaques sind Neurofibrillen, die sich in Form von Knäueln in den Neuronen ablagern, kennzeichnend (pathognomonisch) für die Erkrankung. Morbus Alzheimer gehört zu den Tauopathien, da sich bei dieser neurodegenerativen Erkrankung fehlerhafte Tau-Proteine aus dem Zellkörper heraus an die Axone anlagern und nicht mehr zurück in den Zellkörper können und die Zellen bis zur Unfähigkeit hin einschränken.
Die zugrundeliegenden Veränderungen sind nicht behandelbar.
Die Krankheit ist nach dem Arzt Alois Alzheimer benannt, der sie im Jahr 1906 erstmals beschrieb, nachdem er im Gehirn einer verstorbenen Patientin charakteristische Veränderungen festgestellt hatte.
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Von Alzheimer sind fast ausschließlich Menschen höheren Alters betroffen. Durch die Bevölkerungsentwicklung in den westlichen Industrienationen mit immer älter werdenden Bürgern steigt daher auch die Alzheimer-Prävalenz. Von den 65–69-Jährigen sind etwa zwei Prozent betroffen, bei den 75–79-Jährigen 7,5 Prozent und bei den 85–89-Jährigen zeigen etwa 23 Prozent Symptome der Krankheit.[3] Über dem 85. Lebensjahr nimmt der Anteil der Betroffenen wieder ab, da die zuvor Erkrankten nur selten dieses Lebensalter erreichen.
Frauen erkranken deutlich häufiger an Alzheimer als Männer. Ein Grund hierfür ist die höhere Lebenserwartung. In den letzten Jahren werden zudem Zusammenhänge zwischen Schwankungen im Hormonhaushalt während der Menopause und dem Risiko, an Alzheimer zu erkranken, erforscht.[4][5]
In Deutschland lebten 2018 etwa 1,7 Millionen Menschen mit einer Demenzerkrankung, bis 2050 wird ein Anstieg auf drei Millionen prognostiziert. Mehr als 25.000 von ihnen haben noch nicht das 65. Lebensjahr erreicht. Jedes Jahr werden etwa 300.000 neue Demenzerkrankungen diagnostiziert, von denen mindestens zwei Drittel vom Alzheimertyp sind.[6] 2023 starben in Deutschland rund 10.100 Menschen an der Krankheit, rund doppelt so viele wie 20 Jahre zuvor. Ferner wurden 2022 rund 19.000 Menschen wegen Alzheimer im Krankenhaus behandelt.[7]
Die Weltgesundheitsorganisation (WHO) gab die Zahl der an Demenz erkrankten Menschen im März 2023 mit weltweit über 55 Millionen und den Anteil der Alzheimer-Krankheit mit 60 bis 70 % an.[8] Bis zum Jahr 2050 soll die Zahl der Betroffenen auf 139 Millionen steigen.[3]
Vermutete Teilursachen und Risikofaktoren
[Bearbeiten | Quelltext bearbeiten]Bis heute ist die Ursache der Alzheimer-Erkrankung nicht vollständig geklärt, auch wenn weitgehende, allerdings nicht vollständige Einigkeit über die möglichen Einflussfaktoren auf die Krankheitsentstehung herrscht.[9][10][11]
Genetische Risikofaktoren
[Bearbeiten | Quelltext bearbeiten]Das Risiko, an der sporadischen, also nicht-familiären, Form der Alzheimer-Demenz zu erkranken, wird von verschiedenen Genen beeinflusst.[12][13]
Den größten Einfluss haben dabei verschiedene Varianten (Allele) des Gens APOE, das für das Apolipoprotein E (ApoE) kodiert. Die Häufigkeiten der Allele und ihr Einfluss auf das Erkrankungsrisiko ist von der Ethnie, dem Alter, dem biologischen Geschlecht, weiteren Genen und Umweltfaktoren abhängig. Das häufigste Allel ist ε3; abhängig von der Ethnie liegen bei etwa der Hälfte der Menschen beide Kopien in dieser Variante vor. Etwa 20 bis 40 % tragen das ε4-Allel, eine Kopie steigert das Erkrankungsrisiko auf das 2- bis 3-Fache, zwei Kopien verzehnfachen es. 5 bis 10 % weisen ein ε2-Allel auf, ihr Erkrankungsrisiko beträgt etwa die Hälfte von reinen ε3-Trägern. Zwei ε2-Kopien sind mit einem noch niedrigeren Risiko assoziiert, jedoch sehr selten.[12][13]
Wie ApoE das Risiko für die Alzheimer- und andere Erkrankungen beeinflusst, ist nicht vollständig verstanden. Das Protein kommt vielfach im Körper vor und ist am Cholesterin-Transport beteiligt, im Gehirn wird es vor allem von Astrozyten und auch aktivierten Mikroglia gebildet. Diese wirken als Gliazellen unter anderem bei der Steuerung, Struktur, Vernetzung und immunologischen Prozessen im Gehirn mit, sind jedoch keine Nervenzellen. In Anwesenheit von ApoE4, dem durch das ε4-Allel-kodierten Protein, ist die Bildung von Amyloid-Plaques beschleunigt und ihre Entsorgung verlangsamt. ApoE4 fördert ebenso die Aggregation („Verklumpung“) von Tau-Protein und α-Synuclein, kann selbst Ablagerungen bilden und beeinflusst weitere Prozesse in- und außerhalb des Gehirns.[12][13]
Mit Stand 2024 wurden mehrere Hundert verschiedene Gene auf ihren Einfluss auf das Alzheimer-Risiko untersucht. Neben APOE scheinen vor allem SORL1, ABCA7 und TREM2 einen größeren Einfluss zu haben.[12][13]
Vererbte Formen
[Bearbeiten | Quelltext bearbeiten]Erbliche Formen sind für 5 bis 10 % der Fälle von AD mit frühem Beginn bzw. weniger als 1 % aller Alzheimer-Erkrankungen ursächlich. Fast alle werden durch Mutationen in den Genen APP, PSEN1 oder PSEN2 verursacht. Veränderungen in allen drei Genen führen dazu, dass sich früher als bei der nichterblich-sporadischen Form große Mengen von Beta-Amyloid in den Nervenzellen anhäufen. Betroffene erkranken fast immer vor dem 65. Lebensjahr.[14] 2023 waren in einem Viertel der erblichen Fälle die ursächlichen Mutationen noch unbekannt.[15]
Das Gen APP liegt auf Chromosom 21 kodiert für das Amyloid-Precursor-Protein („Amyloid-Vorläufer-Protein“, ebenfalls abgekürzt APP). Mit Stand 2016 sind 39 Mutationen des APP-Gens bekannt, die zur erblichen Alzheimer-Erkrankung führen.[14] Auch Mehrfachanlagen des Gens führen zu erblichen Alzheimer-Formen.[14][16] Bei Trisomie 21 („Down-Syndrom“) ist das Chromosom 21 dreifach angelegt, Betroffene zeigen meist ab dem 40. Lebensjahr Alzheimer-typische-Veränderungen.[17] Eine in Island identifizierte Variante des APP-Gens führt zu geringerer Spaltung des Proteins und reduziert das Erkrankungsrisiko.[14][16]
PSEN1 kodiert für Präsenilin 1, PSEN2 für Präsenilin 2, die Proteine sind wichtige Teile der γ-Sekretase, welche APP spaltet. Beide Gene weisen eine breite Streuung des Erkankungsbeginns und der Erkrankungssschwere auf. PSEN1-Mutationen können zu besonders schweren und früh beginnenden Verläufen führen, die selteneren PSEN2-Mutationen sind mit milderen Formen assoziiert.[14]
Unterfunktion der Ausschwemmung von Abfallstoffen aus dem Gehirn
[Bearbeiten | Quelltext bearbeiten]Im Zuge der Entdeckung (2012) des glymphatischen Systems, eines speziellen Mikrokreislaufs in Gehirn und Rückenmark zur Ausschwemmung von überflüssigem und schädlichem Material, zeigte sich, dass dieses System eine Schlüsselrolle bei der Entstehung der Alzheimer-Krankheit – und möglicherweise auch bei zukünftiger Vorbeugung und Behandlung – einzunehmen scheint.
Ablagerungen von Beta-Amyloiden, der so genannten senilen Plaques, im Zellzwischenraum (Interstitium) werden durch das glymphatische System abtransportiert. Bei Mäusen war der Abtransport der Beta-Amyloiden während des Schlafs doppelt so schnell wie während der Wachphasen. Dies wurde in Verbindung gebracht mit dem erhöhten Risiko von Personen mit Schlafstörungen, an Alzheimer zu erkranken. Auch die Zunahme des Erkrankungsrisikos im Alter wurde in Verbindung gebracht mit dem entsprechenden, altersbedingten Leistungsabfall des glymphatischen Systems.[18] Bestimmte pathogene, für Alzheimer charakteristische, Formen von Tau-Proteinen werden ebenfalls durch das glymphatische System aus dem Zellzwischenraum abtransportiert.[11]
Entzündliche Prozesse oder Infektion
[Bearbeiten | Quelltext bearbeiten]Die Nonnenstudie von David Snowdon zeigt als unerwartetes Ergebnis die Unabhängigkeit des pathologischen Gehirnbefunds (multiple Alzheimer-Plaques) von der wiederholt erhobenen intellektuellen Leistungsfähigkeit derselben Personen zu Lebzeiten. Pat McGeer vermutet entzündliche Prozesse im Gehirn als Ursache der Erkrankung. Thomas Bayer sieht die ursächlichen Prozesse in den Nervenzellen.
Beta-Amyloid-Proteine zeigen in vitro eine starke antimikrobielle Wirkung. Eine Vermutung ist, dass sie als Defensivantwort bei einer noch unbekannten Infektion entstehen.[19]
Eine Infektion mit dem Magenkeim Helicobacter pylori könnte das Risiko, an Alzheimer-Demenz zu erkranken, erhöhen: Bei Menschen über 50 Jahren kann das Risiko nach einer Infektion mit Symptomen um durchschnittlich elf Prozent erhöht sein, rund zehn Jahre nach der Infektion sogar um 24 Prozent.[20]
Risikofaktoren Cholesterin, Trauma, Diabetes und Bluthochdruck
[Bearbeiten | Quelltext bearbeiten]Als Risikofaktoren gelten – neben dem unvermeidbaren Altern und genetischer Disposition – ein vorangegangenes Schädel-Hirn-Trauma,[21] Stoffwechselerkrankungen – Insulinresistenz und Hyperinsulinämie,[22][23][24] Diabetes[25] und hohe Cholesterin-Werte[26] sowie Erkrankungen des kardiovaskulären Systems – Bluthochdruck[27] und erlittene Schlaganfälle.[28]
Aluminium
[Bearbeiten | Quelltext bearbeiten]Aluminium wurde mehrfach kontrovers als auslösender Faktor im Zusammenhang mit der Alzheimer-Krankheit diskutiert.[29] Es ist ein häufiges Element (dritthäufigstes in der Erdhülle und durch Prozesse der Bodenbildung wie der Ferralitisierung oft lokal angereichert) und taucht natürlich u. a. als Spurenelement in Lebensmitteln und im Trinkwasser auf. Zusätzliche Expositionen ergeben sich durch die Verwendung in z. B. Antazida (Magaldrat, Hydrotalkit) oder Aluminium-Kochgeschirr. Metallisches Aluminium wird durch Passivierung gegen vielfältige chemische Einflüsse geschützt, ist jedoch anfällig gegen Basen und auch jene Säuren, die in Lebensmitteln oder dem menschlichen Magen vorkommen.
Die britische[30], die amerikanische[31] und die Deutsche Alzheimer-Gesellschaft[32] sehen keinen überzeugenden Zusammenhang zwischen Aluminium-Aufnahme und der Alzheimer-Krankheit. Dialysepatienten wird geraten, sich zu vergewissern, dass nur aluminiumfreie Flüssigkeiten zur Blutreinigung eingesetzt werden. Aluminiumhaltige magensäurebindende Arzneimittel sollten nur nach ärztlicher Anordnung eingenommen werden.[32]
Ein in epidemiologischen Studien untersuchter möglicher Zusammenhang zwischen der Aluminiumaufnahme aus Trinkwasser und der Alzheimer-Krankheit lässt sich aufgrund der inkonsistenten Datenlage nicht zeigen.[33] Ferner wurden zwar erhöhte Aluminiumkonzentrationen in geschädigten Hirnregionen bei Alzheimer-Patienten nachgewiesen, teilweise auch im Blut.[34] Es ist jedoch nicht bekannt, ob dies der Grund oder eine der Folgen der Erkrankung ist, zumal die neuropathologischen Veränderungen bei der Alzheimer-Krankheit sich deutlich von denen bei einer Dialyse-Enzephalopathie unterscheiden.[33] Bei Dialyse-Patienten (und Patienten mit eingeschränkter Nierenfunktion) führt die Aufnahme von Aluminium zu einer progressiven Enzephalopathie.
Eine gesundheitliche Bewertung des Bundesinstitutes für Risikobewertung (BfR) aus dem Jahre 2005 sah keinen Zusammenhang zwischen der Aluminiumaufnahme aus Lebensmittelbedarfsgegenständen und der Alzheimer-Krankheit, ebenso wenig eine Aktualisierung aus dem Jahr 2007, jedoch wurde die Empfehlung abgegeben, vorsorglich keine sauren Speisen in Kontakt mit Aluminiumtöpfen oder -folie aufzubewahren.[35] Die Ergebnisse einer Stellungnahme der Europäischen Behörde für Lebensmittelsicherheit (EFSA) zu Aluminium als Lebensmittelzutat (im Stoff E131), die im April 2013 veröffentlicht wurde, werden in einer neuen Stellungnahme des BfR berücksichtigt. Auch hier wird darauf hingewiesen, dass der Zusammenhang zur Alzheimer-Krankheit bisher nicht bewiesen sei. Hierauf wird in einer Stellungnahme von 2019[33] und 2020[36] erneut hingewiesen. Der Beitrag zur Gesamtbelastung von Aluminium in Form von Aluminiumhydroxychlorid in Antitranspirantien sei zudem deutlich geringer als angenommen.[37] So liegt die Bioverfügbarkeit bei 0,00192 %, deutlich geringer als bei den bisher angenommenen 0,014 %.[34]
Histologie und Biochemie
[Bearbeiten | Quelltext bearbeiten]


Im Gehirn von Alzheimer-Patienten bilden sich senile Plaques und fibrilläre Ablagerungen. Die Proteinablagerungen der Plaques bestehen im Wesentlichen aus dem Beta-Amyloid-Peptid. Die in Zellen liegenden Neurofibrillenbündel bestehen aus dem Tau-Protein. Dieses aggregiert zu Fibrillen, wenn es stärker als normal phosphoryliert, d. h. mit Phosphorsäureresten besetzt ist („Hyperphosphorylierung“). Es ist ungeklärt, ob diese Tau-Phosphorylierung sekundärer Natur oder krankheitsauslösend ist.
Im Krankheitsverlauf nimmt die Hirnmasse durch das Absterben von Neuronen vermehrt ab; man spricht dabei von einer Hirnatrophie. Außerdem wird der Botenstoff Acetylcholin nicht mehr in ausreichenden Mengen produziert (unter anderem durch Verminderung des im Nucleus basalis vorkommenden Enzyms Cholinacetyltransferase, das die Zusammensetzung von Acetyl-CoA und Cholin katalysiert), was zu einer allgemeinen Leistungsschwächung des Gehirns führt.
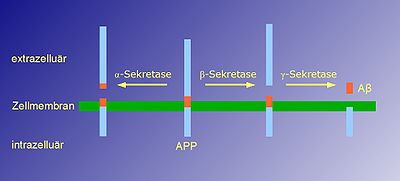
Das Beta-Amyloid-Peptid entsteht aus einem Vorläuferprotein, dem Amyloid-Precursor-Protein (APP), bei dem es sich um ein integrales Membranprotein handelt. Der größte Anteil dieses Proteins ragt aus der Zelle heraus (befindet sich extrazellulär; siehe Extrazelluläre Matrix), während sich nur ein kleiner Anteil innerhalb der Zelle befindet (intrazellulär). Es handelt sich um ein Typ I-Transmembranprotein: Der Amino-Terminus befindet sich auf der Zellaußenseite, der Carboxyl-Terminus innerhalb der Zelle.
APP wird von proteinspaltenden Enzymen, den sogenannten Sekretasen (Alpha-Sekretasen, Beta-Sekretase und Gamma-Sekretase) gespalten, wodurch es zur Freisetzung des Beta-Amyloid-Peptids aus dem Vorläuferprotein kommen kann. Grundsätzlich gibt es zwei Wege, wie APP gespalten werden kann:
- Der nicht-amyloidogene Weg: APP wird durch eine α-Sekretase geschnitten. Dieser Schnitt findet innerhalb des Teils von APP statt, der Beta-Amyloid enthält. Dadurch wird die Bildung von Beta-Amyloid verhindert. Es kommt zur Freisetzung eines großen extrazellulären Anteils, dessen Funktion noch nicht endgültig geklärt ist.
- Der amyloidogene Weg: APP wird zuerst von der β-Sekretase geschnitten und nachfolgend von der γ-Sekretase. Dieser Schnitt, der innerhalb der Transmembrandomäne erfolgt, führt zur Freisetzung von Beta-Amyloid.
Beide Vorgänge können parallel in Nervenzellen stattfinden. Die durch β- und γ-Sekretase gebildeten Beta-Amyloid-Peptide variieren in ihrer Länge. Der Haupttyp ist Beta-Amyloid-40 (40 Aminosäuren lang), während ein kleiner Anteil, Beta-Amyloid-42, 42 Aminosäuren lang ist. Die Länge des Beta-Amyloids ist von zentraler pathologischer Bedeutung, da das längere Beta-Amyloid-42 eine wesentlich höhere Tendenz zur Aggregation aufweist als das kleinere Beta-Amyloid-40.
Kandidaten für die α-Sekretase sind die Proteasen ADAM 10, ADAM17/TACE und für die β-Sekretase BACE1. Die γ-Sekretase besteht aus einem hochmolekularen Komplex aus den Proteinen Präsenilin 1 bzw. 2, PEN-2, APH-1 und Nicastrin, wobei nicht geklärt ist, ob nicht noch weitere Proteine daran beteiligt sind.
Bei der Alzheimer-Erkrankung ist die Funktion der Mitochondrien gestört. Eine Blockade der Atmungskette am Komplex IV führt zu einer übermäßigen Produktion von Radikalen, die die Zelle schädigen können. Ob diese Blockade eine Konsequenz der übermäßigen Beta-Amyloid-Produktion ist oder ob Beta-Amyloid als Antioxidans gegen diesen neu entstandenen oxidativen Stress übermäßig produziert wird, war 2014 noch offen.
Krankheitsverlauf
[Bearbeiten | Quelltext bearbeiten]Früherkennung
[Bearbeiten | Quelltext bearbeiten]Als Alzheimer-Früherkennung wird u. a. eine Untersuchung der Hirnleistung mittels verschiedener Tests angeboten oder auch eine Kernspintomographie (MRT). Beides ist eine Privatleistung, also eine IGeL (Individuelle Gesundheitsleistung). Der IGeL-Monitor des MDS (Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen) hat den Hirnleistungs-Check zur Früherkennung einer Demenz mit „tendenziell negativ“ bewertet, da kein wirklicher Nutzen erkennbar ist. Es lässt sich weder eine Demenz durch frühes Erkennen verhindern oder abmindern, und da nur die Hälfte der Menschen mit leichter Demenz später eine schwere entwickelt, werden möglicherweise Patienten unnötig beunruhigt.[38] Auch die S3-Leitlinie „Demenzen“ von 2016 spricht sich gegen eine Untersuchung von Personen ohne Beschwerden oder Symptome aus.[39]
Die Kernspintomographie zur Früherkennung einer Alzheimer-Demenz hat der IGeL-Monitor aus ähnlichen Gründen ebenfalls mit „tendenziell negativ“ bewertet. Zwar sei die Kernspin- oder Magnetresonanztomographie (MRT) ein wertvolles Verfahren, das helfen könne, eine Alzheimer-Demenz zu diagnostizieren. Es gebe aber keine Studien zum Nutzen einer Früherkennung per MRT.[40]
Bei einem Verdacht auf Alzheimer-Demenz bezahlen die gesetzlichen Krankenkassen die Abklärung des Verdachts, unter Umständen auch mit einer MRT. Ein Hirnleistungs-Check ist Kassenleistung für Menschen, bei denen ein begründeter Verdacht auf eine Demenz besteht, bei Menschen zwischen 70 und 80 Jahren mit bestimmten weiteren Erkrankungen, sowie allgemein bei Menschen über 80 Jahren. Die Angebote der Selbstzahlerleistung wurden in verschiedenen Medien kritisch aufgegriffen.[41]
Verdachtsdiagnose
[Bearbeiten | Quelltext bearbeiten]Erste Warnzeichen
[Bearbeiten | Quelltext bearbeiten]Das amerikanische National Institute on Aging hat sieben Warnzeichen formuliert, die auf eine beginnende Alzheimersche Krankheit hinweisen können und welche die Menschen in der nahen Umgebung veranlassen sollten, ärztlichen Rat einzuholen:[42]
- Der Erkrankte wiederholt immer wieder die gleiche Frage.
- Der Erkrankte erzählt immer wieder die gleiche kurze Geschichte.
- Der Erkrankte weiß nicht mehr, wie bestimmte alltägliche Verrichtungen wie Kochen, Kartenspiel, Handhabung der TV-Fernbedienung funktionieren.
- Der Erkrankte hat den sicheren Umgang mit Geld, Überweisungen, Rechnungen und Ähnlichem verloren.
- Der Erkrankte findet viele Gegenstände nicht mehr oder er legt sie an ungewöhnliche Plätze (unabsichtliches Verstecken) und verdächtigt andere Personen, den vermissten Gegenstand weggenommen zu haben.
- Der Erkrankte vernachlässigt anhaltend sein Äußeres, bestreitet dies aber.
- Der Erkrankte antwortet auf Fragen, indem er die ihm gestellte Frage wiederholt.
Der Verlauf wird in verschiedene Stadien unterteilt[43], in denen jeweils andere physische und psychische Einschränkungen im Vordergrund stehen.
Prä-Demenz-Stadium
[Bearbeiten | Quelltext bearbeiten]Schon acht Jahre bevor Alzheimer sicher diagnostiziert werden konnte, waren leichte Auffälligkeiten in neuropsychologischen Tests nachweisbar.[44][45][46] Nachlassende Leistungen beim Kurzzeitgedächtnis erlauben in diesem Stadium noch am leichtesten eine Einschätzung. Daneben kann es bereits früh zu Beeinträchtigungen beim Sprachverständnis, der Umsetzung zuvor gesetzter Ziele, zu Teilnahmslosigkeit und zu affektiven Störungen wie Depressionen kommen.
Medizinische Diagnose
[Bearbeiten | Quelltext bearbeiten]
Vom „National Institute on Aging“ und der US-Alzheimer-Gesellschaft wurden im April 2011 neue Empfehlungen zu Diagnose der Alzheimer-Krankheit veröffentlicht.[47] Diese überarbeiteten Diagnose-Kriterien werden aber als noch ungeeignet für den allgemeinen klinischen Alltag angesehen und sollten daher spezialisierten Zentren vorbehalten sein.[48] In den aktualisierten Leitlinien werden drei ineinander übergehende Stadien unterschieden:
- das präklinische Stadium des Morbus Alzheimer,[49]
- das Stadium der leichten kognitiven Beeinträchtigung („Mild Cognitive Impairment“, MCI)[50] und
- das Stadium der Demenz als Folge der Alzheimer-Erkrankung.[51]
Eine relativ sichere In-vivo-Diagnose ist bislang nur in den Stadien Demenz und MCI möglich – und zwar durch eine Kombination von anamnestischen Befunden, neuropsychologischen Tests, laborchemischen (Liquor-Biomarker) und bildgebenden Befunden.[52]
Bildgebende Verfahren
[Bearbeiten | Quelltext bearbeiten]Für das MCI-Stadium sind die Diagnosemöglichkeiten jedoch auch noch sehr eingeschränkt, da die hier erforderlichen bildgebenden Verfahren, vor allem die direkte Amyloid-Darstellung mittels Positronenemissionstomographie (PET) und radioaktiven Tracern wie Florbetaben[53][54] sowie die unterschiedlichen funktionellen Magnetresonanztomographie-Verfahren (fMRT), zwar als vielversprechend gelten, aber für den klinischen Alltag in der Regel noch als zu aufwendig und zu teuer.[55] Viele Fragen zur Interpretation der Befunde sind außerdem noch nicht beantwortet. Inzwischen befindet sich die Diagnose durch Positronen-Emissions-Tomographie (PET) weiterhin in klinischen Entwicklungen. Bestimmte Substanzen, sogenannte PET-Tracer, können sich an die Amyloid-beta-Aggregate, die sich bei Alzheimer-Patienten vermehrt im Gehirn bilden, anlagern. Der erste Tracer, der in klinischen Studien untersucht wurde, war die Substanz Pittsburg B mit dem Kohlenstoffisotop C-11. Wegen dessen kurzer Halbwertszeit von 20 Minuten wurden Tracer auf Basis von Fluor-18 mit einer Halbwertszeit von 109 min entwickelt. Die aussichtsreichen Tracer mit diesem Isotop sind neben Florbetaben Florbetapir und Flutemetamol.[56] Die Messung von Biomarkern (Beta-Amyloid, Gesamt-Tau-Protein, phosphoryliertes Tau, Amyloid-Vorläufer-Proteine) im Liquor setzt eine Lumbalpunktion, also ein invasives Verfahren voraus.
Pathohistologie
[Bearbeiten | Quelltext bearbeiten]Pathohistologisch bestätigt werden kann die Diagnose jedoch erst nach dem Tod des Patienten, indem eine feingewebliche Untersuchung des Gehirns durchgeführt wird.[57]
Früh- und Mittelstadium
[Bearbeiten | Quelltext bearbeiten]Bei den meisten Patienten führen Defizite beim Lernen und der Merkfähigkeit zur Diagnosestellung.[58] Während im Langzeitgedächtnis gewohnte Tätigkeitsabläufe und emotionale Erlebnisse meist noch gut gegenwärtig sind, sind das Lernen und das Kurzzeitgedächtnis am stärksten eingeschränkt.[59][60]
Das Sprachvermögen der Betroffenen ist insgesamt reduziert, was sich im Sprachfluss und durch ein vermindertes Vokabular äußert. Grundsätzlich sind sie aber in der Lage, ihre Gedanken und Ideen anderen Personen in geeigneter Weise mitzuteilen.[61][62][63]
Die Feinmotorik zeigt bereits gewisse Unsicherheiten, die bei Tätigkeiten wie Schreiben, Malen oder Ankleiden erkennbar sind.[64] Beim Übergang der Erkrankung zum Mittelstadium sind einige Patienten noch in der Lage, selbstständig ihren Alltag zu gestalten, bei komplizierten oder komplexen Tätigkeiten sind sie jedoch bereits auf Unterstützung angewiesen.[58]
Fortgeschrittenes Stadium
[Bearbeiten | Quelltext bearbeiten]
Im fortgeschrittenen Stadium verlernen die Patienten altbekannte Fertigkeiten und erkennen nahestehende Personen und alltägliche Gegenstände nicht mehr wieder.[65][66]
Auch bei Patienten, die vor der Erkrankung ein friedfertiges Wesen besessen haben, kann es für Außenstehende zu scheinbar unbegründeten Wut- und Gewaltausbrüchen kommen. Schuldgefühle und allgemein eine innere Selbstreflexion nehmen im weiteren Verlauf immer mehr ab, so wie viele menschliche Verhaltensmuster nur noch automatisiert abzulaufen scheinen.
Die Muskulatur baut kontinuierlich ab, was zu weiteren Sprachproblemen, Harn- bzw. Stuhlinkontinenz und einer immer weiter abnehmenden Mobilität bis hin zur Bettlägerigkeit führt. Ohne Unterstützung können die Betroffenen ihren Alltag nicht mehr meistern und brauchen auch bei einfachen Tätigkeiten Unterstützung. Die Krankheit schreitet bis zum Tode voran, der bei den stark geschwächten Patienten oft durch eine Lungenentzündung eintritt.
Differenzialdiagnose
[Bearbeiten | Quelltext bearbeiten]Die Alzheimer-Krankheit muss stets von anderen, ähnlichen psychischen und neurologischen Störungen abgegrenzt werden, etwa von
- normaler altersbedingter Vergesslichkeit
- Verweigerung oder Vermeidungsverhalten
- leichter kognitiver Störung des Alters (unter der Chiffre ICD-10 F06.7 Organische psychische Störungen eingeordnet)
- Depression bei älteren Menschen mit Denkhemmung (evtl. mit zusätzlichen kognitiven Störungen im Sinne einer Zweiterkrankung)
- Deprivationserscheinungen bzw. Hospitalismus und Regression in Altersheimen
- einfacher Aphasie
- einfachem Mutismus
- schwerem Autismus (Kanner-Syndrom) mit Mutismus
- schweren neurologischen Syndromen wie dem Apallischen Syndrom, dem Locked-in-Syndrom oder dem akinetischen Mutismus
- Gehirntumoren, Gehirnverletzungen, die zu einem organischen amnestischen Syndrom führten (ICD-10 F04)
- Störungen des Stoffwechsels (beispielsweise Unterzuckerung bei Diabetikern)
- Schlaganfall
- Normaldruckhydrozephalus
- Delirium
- Psychosen und Wahn (beispielsweise Schizophrenie, Manie oder psychotische Depression)
- anderen Formen von Demenz
- Sprachstörungen, Wortfindungsstörungen und totalem Verlust der Sprache.
Möglichkeiten der Prävention
[Bearbeiten | Quelltext bearbeiten]Nachweislich vorbeugende Arzneimittel sind Gegenstand der Forschung. Allgemein leiten sich die Präventionsempfehlungen aus den modifizierbaren Risikofaktoren (wie z. B. Bluthochdruck) ab.[39] Daher beinhaltet die Prävention eine diesbezügliche leitliniengerechte Diagnostik und frühzeitige Behandlung solcher demenzbeeinflussenden Faktoren. Da diese überwiegend im mittleren Lebensalter vorliegen, richten sich die Empfehlungen auch an Personen ab dem mittleren Lebensalter.
Forschung an zukünftigen Impfstoffen
[Bearbeiten | Quelltext bearbeiten]An einer Impfung, die der Krankheit vorbeugen oder zumindest das Fortschreiten der Krankheit verhindern können soll, wird vielfach geforscht.[67]
Blutdruck, Bewegung, Ernährung und Umwelteinflüsse
[Bearbeiten | Quelltext bearbeiten]Verschiedene vorbeugende Maßnahmen gegen typische Zivilisationskrankheiten scheinen auch die Wahrscheinlichkeit zu senken, an Alzheimer zu erkranken. Die Datenlage und wissenschaftliche Akzeptanz von verschiedenen Diäten, Verhaltensrichtlinien, Umwelteinflüssen und Ersterkrankungen als Auslöser der Krankheit ist unterschiedlich.[68] Dabei ist wichtig, dass Maßnahmen, die in der Lage sind, das Auftreten der Erkrankung zu verhindern, nicht unbedingt geeignet sind, den Verlauf einer bereits diagnostizierten Alzheimer-Krankheit günstig zu beeinflussen.
Es gibt viele beobachtende Studien, jedoch nur wenige kontrolliert-randomisierte, welche die Wirksamkeit der Maßnahmen belegen. Bis 2006 wurde nach diesen strengen Studienkriterien nur für die Kontrolle des Blutdrucks eine signifikante Senkung des Alzheimer-Risikos festgestellt.
Regelmäßig körperliche Bewegung wird zur allgemeinen Risikoreduktion empfohlen.[39] Zu den möglichen Ursachen des Zusammenhangs wurden verschiedene molekularbiologische Konzepte entwickelt.[69][70][71][72][73] Allgemein gilt ein Lebensstil mit körperlicher Bewegung, sportlicher, sozialer und geistiger Aktivität protektiv.[39] Außerdem kann eine ausgewogene Ernährung (z. B. mediterrane Diät) erwogen werden. Zwar weist ein leichter bis moderater Alkoholkonsum auf eine protektive Wirkung hin, wird aber aufgrund der Abhängigkeitsgefahr und toxischer Eigenschaften nicht zur Prävention empfohlen.[39]
Mit Ausnahme von Eisen und Kupfer können bestimmte antioxidativ und entzündungshemmend wirkende Mikronährstoffe (Vitamin C, E, B12 und Selen) sowie Vitamin A, B3, B6, K und Magnesium zur Neuroprotektion beitragen.[74] Jedoch kann die (übermäßige) Supplementation fettlöslicher Vitamine (z. B. A, D oder E) zu Toxizitäten führen. Nikotinverzicht wirkt sich ebenfalls positiv aus.[39]
Therapie und Therapieversuche
[Bearbeiten | Quelltext bearbeiten]Die Alzheimer-Krankheit kann derzeit nicht geheilt werden. Aktuell zur Demenzbehandlung zugelassene Medikamente wirken auf bestehende Symptome nur wenig und können das Voranschreiten der Erkrankung nicht stoppen. Im Jahre 2006 wurde von der Amerikanischen Vereinigung für Geriatrische Psychiatrie ein Konsenspapier zur Alzheimer-Behandlung veröffentlicht.
Antidementive Pharmakotherapie
[Bearbeiten | Quelltext bearbeiten]Acetylcholinesterase-Hemmer
[Bearbeiten | Quelltext bearbeiten]Acetylcholinesterase(AChE)-Hemmer sorgen dafür, dass Acetylcholin im Gehirn langsamer abgebaut wird und damit in höherer Konzentration vorliegt. Dadurch soll der Verringerung des Acetylcholin-Niveaus durch das Absterben von Neuronen, die diesen Botenstoff produzieren, entgegengewirkt werden. Acetylcholin ist ein vielfach im Assoziationscortex auftretender Neurotransmitter, der efferente Nervenverbindungen zum Hippocampus (für die in Alzheimer-Patienten geschädigte Gedächtnisbildung verantwortlich) aussendet. So erklärt sich, dass der Hippocampus zwar selbst nicht cholinerg ist, die Therapie mit AChE-Hemmern aber dennoch seine Aktivität ankurbelt.[75] Vertreter dieser Wirkstoffgruppe sind Galantamin, Donepezil und Rivastigmin. Zugelassen sind die Acetylcholinesterase-Hemmer bei leichter bis mittelschwerer Alzheimer-Demenz, nicht bei schwerer. Die Wirksamkeit der Therapie wird diskutiert. In der Ideal-Studie wird gezeigt, dass sowohl die Pflaster-Applikation als auch die orale Gabe von Rivastigmin die kognitiven Fähigkeiten der Patienten deutlich gegenüber Placebo verbessern.[76] Andererseits gab es auch Studien, die eine geringe Wirkung der Acetylcholinesterase-Hemmer zeigen.[77] Unter deutschen Psychiatern ist das Ausmaß des Nutzens der Präparate daher umstritten.[78] Das stark AChE-hemmende Lycopodiumalkaloid Huperzin A wurde 1994 in China zur Behandlung milder Formen der Alzheimer-Krankheit zugelassen;[79] eine Metaanalyse von 2012 ließ die Frage zu dessen Wirksamkeit offen.[80] Einem Umbrella-Review von 2022 zufolge wirkten sich Galantamin, Donepezil, Rivastigmin und Huperzin A, gemessen anhand der ADAS-Cog und des MMSE, bei einer milden Form der Alzheimer-Demenz günstig auf die kognitiven und allgemeinen Leistungen und Aktivitäten des täglichen Lebens aus.[81][82]
NMDA-Rezeptor-Antagonisten
[Bearbeiten | Quelltext bearbeiten]Die Beeinflussung des Botenstoffes Glutamat, des häufigsten erregenden Botenstoffs im zentralen Nervensystem, der an Lernprozessen und Gedächtnisfunktionen beteiligt ist, ist ein weiterer medikamentöser Ansatz. Der bisher einzige Vertreter dieser Wirkstoffklasse ist das Memantin, das 2002 europaweit und 2003 in den USA zugelassen wurde. Memantin ist ein NMDA-Rezeptor-Antagonist (N-Methyl-D-Aspartat-Rezeptor-Antagonist) und soll die bei Alzheimer-Demenzen verstärkte glutamaterge Signalweiterleitung normalisieren. Studienergebnisse zeigen, dass Memantin bei mittlerer bis schwerer Erkrankung nach sechs Monaten zu einer insgesamt geringfügigen Verbesserung der kognitiven Störungen und der beeinträchtigten Alltagsaktivitäten führt.[83] Zugelassen ist Memantin bei moderater bis schwerer Alzheimer-Demenz, nicht bei leichter.
Ginkgo biloba
[Bearbeiten | Quelltext bearbeiten]Der Extrakt aus den Blättern des Ginkgo-Baums EGb 761 (Tebonin) ist zugelassen zur symptomatischen Behandlung von „hirnorganisch bedingten geistigen Leistungseinbußen bei demenziellen Syndromen“. Als Standarddosis gelten 240 Milligramm täglich. Außer diesem Extrakt gibt es noch eine Vielzahl von anderen Ginkgo-biloba-haltigen Präparaten, die sich in ihrer exakten Zusammensetzung unterscheiden. Eine Meta-Analyse der vorliegenden Studienergebnisse aus dem Jahre 2007 kam zu dem Schluss, dass die Hinweise auf einen günstigen Einfluss von Ginkgo-Präparaten auf die kognitiven Fähigkeiten von Alzheimer-Patienten unschlüssig und wenig überzeugend seien;[84] in einer vorangegangenen Publikation hatten dieselben Autoren Ginkgo als vielversprechend beschrieben.[85]
In den USA wurde eine große doppeltblinde Langzeitstudie (GEM-Studie) durchgeführt, die klären sollte, ob Ginkgo effektiv zur Prävention von Alzheimer eingesetzt werden kann.[86] Die im Jahre 2008 veröffentlichten Resultate ergaben keinen signifikanten Unterschied zwischen dem Ginkgo-Präparat (2× täglich 120 mg) und Placebo – während in der Placebo-Gruppe 246 Personen eine Demenz entwickelten, waren es in der Ginkgo-Gruppe 277 Personen.[87] Eine weitere Analyse der GEM-Studie, Ende 2009 publiziert, ergab zudem, dass der EGb 761 bei den durchschnittlich knapp 80-jährigen Patienten einen mentalen Leistungsverlust nicht aufhalten konnte.[88] Die Autoren der Studie weisen in ihrer Diskussion der Ergebnisse zum einen darauf hin, dass die verwendeten kognitiven Tests möglicherweise nicht geeignet waren, um Effekte des Präparats erkennen zu können. Zum anderen sollen die Studienteilnehmer ungewöhnlich gesund und gebildet gewesen sein, was das Auftreten kognitiver Leistungsschwächen relativ unwahrscheinlich mache. Eine Literaturanalyse von Wissenschaftlern der Charité kam 2010 zu dem Schluss, dass der Spezialextrakt zwar wirksamer sei als Placebo, der Effekt jedoch moderat ausfalle und die klinische Bedeutung dieses Effektes wie generell bei Antidementiva sehr schwer zu bestimmen sei.[89]
Das deutsche Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen untersuchte 2008 im Rahmen einer Arzneimittelbewertung öffentlich zugängliche Studien sowie von Arzneimittelherstellern zur Verfügung gestellte Daten der in Deutschland verfügbaren ginkgohaltigen Präparate. Es kam zu dem Schluss, dass es einen Beleg für einen Nutzen beim Therapieziel „Aktivitäten des täglichen Lebens“ gebe, sofern 240 mg Extrakt täglich eingenommen werden. Für die Therapieziele „kognitive Fähigkeiten“ und „allgemeine psychopathologische Symptome“ sowie für das angehörigenrelevante Therapieziel „Lebensqualität der (betreuenden) Angehörigen“ (gemessen am emotionalen Stress der Angehörigen) gebe es bei derselben Dosierung nur einen Hinweis auf einen Nutzen.[90]
Weitere Studien deuteten darauf hin, dass Ginkgo-Blätter pharmakologisch wirksamere Substanzen enthalten, die möglicherweise eine ursächliche Behandlung der präklinischen Alzheimer-Demenz zulassen.[91] In diesem Zusammenhang spielen Chaperone aus pflanzlichen Proteinextrakten eine wichtige Rolle.[92]
Anti-Amyloid-Antikörper
[Bearbeiten | Quelltext bearbeiten]Wirkstoffe, die durch Bindung an das pathologische Beta-Amyloid im Gehirn auf eine kausale Therapie der Alzheimer-Erkrankung zielen, sind monoklonale Antikörper wie Aducanumab, Lecanemab und Donanemab. Sie sollen Amyloid-Plaques auflösen, welche Nervenfasern im Gehirn ummanteln und zur Alzheimer-Demenz führen. Die Antikörper heilen die Krankheit nicht, sondern verlangsamen den Krankheitsfortschritt.[93] Sie müssen intravenös verabreicht werden.
Aducanumab erhielt 2021 von der FDA – in einem umstrittenen Verfahren, entgegen der Empfehlung des Fachgremiums – eine Zulassung (Präparatename Aduhelm), die EMA dagegen lehnte die Zulassung ab. Im Folgejahr verkündete der Hersteller, die Firma Biogen, die Vermarktung einzustellen.[94] Der monoklonale Antikörper Lecanemab wurde 2023 in einer randomisierten Studie mit 1785 Patienten in einem sehr frühen Stadium der Erkrankung klinisch geprüft. Sowohl in der Lecanemab-Gruppe als auch in der Plazebo-Gruppe nahmen die kognitiver Funktionen über 18 Monate kontinuierlich ab. Dabei war die mittels eines Scores gemessene Abnahme in der Gruppe mit dem Antikörper etwas geringer.[95] Daraufhin wurde das Präparat unter dem Namen Leqembi in USA, China, Japan und Südkorea zugelassen. In den USA entstehen umgerechnet ca. 25.000 € Jahrestherapiekosten und ggf. weitere Kosten für Screening-Tests, da die Krankheit in den frühen Stadien oft noch nicht klinisch erkennbar ist.[96] Im November 2024 empfahl die Europäische Arzneimittel-Agentur nach erneuter Prüfung die Zulassung von Lecanemab für bestimmte Patienten und revidierte damit ihre ursprüngliche Entscheidung vom Juli 2024, die Zulassung abzulehnen. Das Risiko von – teils schweren – amyloid-assoziierten Bildgebungsanomalien (z. B. Hirnschwellungen und -blutungen) sei bei Patienten ohne oder mit lediglich einer Kopie des Gens für Apolipoprotein E 4 (ApoE4) geringer als bei Patienten mit zwei ApoE4-Kopien. Für diese begrenzte Population sei das Nutzen-Risiko-Verhältnis positiv.[97] Als weiterer Antikörper wurde im Jahr 2024 Donanemab unter dem Namen Kisunla in den USA zugelassen.[98] Wie auch Lecanemab ist Donanemab für den Einsatz im frühen Stadium, also bei milder Symptomatik, angezeigt.
Experimentelle Wirkstoffe
[Bearbeiten | Quelltext bearbeiten]In retrospektiven Studien wurde 1995 festgestellt,[99] dass Rheumapatienten ein signifikant reduziertes Risiko haben, die Alzheimer-Krankheit zu entwickeln, beziehungsweise dass die Krankheit bei ihnen später als bei Nichtrheumatikern ausbricht. Daraus wurde geschlossen, dass dieser Effekt auf die nichtsteroidalen Antirheumatika (NSAR) (in englischsprachigen Publikationen nonsteroidal anti-inflammatory drugs (NSAID) genannt) zurückzuführen ist, die diese Patienten einnehmen.[100][101] In einigen transgenen Tiermodellen konnte eine Reduktion von Beta-Amyloid-Plaques bei der Gabe von Ibuprofen festgestellt werden.[102][103][104] Beim Menschen liegen bisher keine Daten aus randomisierten Doppelblind-Studien vor, die eine gesicherte Wirkungsweise von Ibuprofen und anderen nichtsteroidalen Antirheumatika aufzeigen. Aufgrund der nicht unerheblichen Nebenwirkungen, die bei einer dauerhaften prophylaktischen Einnahme von Ibuprofen zu erwarten sind, wird von einer unkontrollierten Einnahme abgeraten.[105][106] Die zur möglichen Prävention der Alzheimer-Krankheit notwendigen Dosen an nichtsteroidalen Antirheumatika sind erheblich höher als zur normalen Schmerzbehandlung. Die nichtsteroidalen Antirheumatika stehen in Verdacht, kardiovaskuläre Probleme hervorzurufen, wenn sie auf Dauer und in hohen Dosen eingenommen werden.[107]
Mit Stand 2021 gibt nicht genug Daten um sichere Aussagen über die Wirkung von Cannabinoiden auf die Alzheimer-Krankheit zu treffen. Vermutlich bringen sie keine oder höchstens vernachlässigbare Vorteile.[108]
Pharmakotherapie von Verhaltensauffälligkeiten
[Bearbeiten | Quelltext bearbeiten]Die Apathie, also ein verminderter Antrieb, ist die häufigste Verhaltensauffälligkeit bei Betroffenen. Dadurch ist ihre Teilhabe am Alltagsleben erschwert und das Krankheitsbild verschlechtert sich schneller. Das Stimulans Methylphenidat kann die Apathie vermindern. In der multizentrischen, randomisierten, placebokontrollierten ADMET-2-Studie wurde die Besserung der Apathie bestätigt, aber keine Veränderung der Kognition und der allgemeinen Lebensqualität gefunden.[109][110] Das Medikament ist für die Behandlung der Alzheimer-Krankheit nicht zugelassen, die Leitlinien von 2023 empfehlen einen Off-Label-Behandlungsversuch.[2]
Nicht pharmakologische Behandlung und Maßnahmen
[Bearbeiten | Quelltext bearbeiten]Vitamine
[Bearbeiten | Quelltext bearbeiten]Es konnte weder für B-, C- oder E-Vitamine ein günstiger Effekt auf das Risiko oder das Fortschreiten der Erkrankung nachgewiesen werden.[111][112][2]
Psychotherapeutische Behandlung
[Bearbeiten | Quelltext bearbeiten]Symptome wie innere Unruhe, depressive Verstimmung oder Erregung und Aggressivität, die im Verlauf der Krankheit möglicherweise auftreten, können mit Hilfe von Psychotherapie und Psychopharmaka behandelt werden. Daneben werden seit Beginn des 21. Jahrhunderts zunehmend nichtpharmakologische Interventionen bei Verhaltensstörungen von Demenzkranken favorisiert.[113]
Psychosoziale Maßnahmen
[Bearbeiten | Quelltext bearbeiten]Die Anpassung der Lebensräume an die veränderten Möglichkeiten und Bedürfnisse können den Alltag von Betroffenen und Pflegekräften erleichtern. Die Vereinfachung von Tätigkeitsabläufen und das Beschriften von Gegenständen helfen dem Patienten dabei, ein höheres Maß an Unabhängigkeit zu erhalten. Veränderungen der bekannten Abläufe oder der Umgebung regen die Patienten oft unnötig auf, während gut ausgeleuchtete Räume, angemessene Pausen und begrenzte Anforderungen dem Patienten ein sicheres Gefühl geben. Angemessene soziale und visuelle Stimulation kann zu einer Verbesserung der Aufmerksamkeit und Orientierung führen, beispielsweise kann eine Steigerung der Nahrungsaufnahme erreicht werden, wenn auffallend farbige Tisch-Accessoires verwendet werden, die Alzheimer-Patienten mit verminderter Kontrasterkennung besser wahrnehmen können.[114]
Spezialisierte Pflegefachkräfte können zuhause oder im Heim spezifische Unterstützung im Alltag bieten.
Transkranielle Pulsstimulation
[Bearbeiten | Quelltext bearbeiten]Bei der der Transkraniellen Pulsstimulation (TPS) werden per Ultraschall Stoßwellen-Impulse in Hirnregionen geschickt, die im frühen und mittleren Stadium von der Alzheimer-Krankheit betroffen sind. Dadurch sollen Gehirnzellen aktiviert werden. Laut Alzheimer Forschung Initiative wurde die TPS (Stand April 2022) nur in sehr kleinen Studien ohne Kontrollgruppen getestet. Deshalb konnte die Wirksamkeit der Behandlung durch Studien bisher nicht belegt werden.[115] Die in der Werbung angeführte Studie wurde von dem Unternehmen finanziert, das die entsprechenden Geräte vertreibt.[116] Im September 2022 veröffentlichte die Deutsche Gesellschaft für Klinische Neurophysiologie und Funktionelle Bildgebung (DGKN) eine Stellungnahme zur TPS. Im Fazit dieser Stellungnahme kommt Ulf Ziemann, Ärztlicher Direktor der Abteilung Neurologie und Co-Direktor am Hertie-Institut für klinische Hirnforschung der Universität Tübingen, angesichts der bisherigen Studienlage zu dem Ergebnis, dass es „aktuell nicht gerechtfertigt [ist], TPS als neue effektive Therapieform der Alzheimer-Erkrankung oder anderer Erkrankungen des Gehirns anzusehen und zu bewerben.“[117]
Ergotherapie
[Bearbeiten | Quelltext bearbeiten]Das Ziel der Ergotherapie ist die größtmögliche Selbstständigkeit im Alltag. Auf Hausbesuchen können Ergotherapeutinnen und Ergotherapeuten Angehörige schulen und Empfehlungen zur Sturzprävention in der Wohnung abgeben.[118] Im Heim können Ergotherapeutinnen und Ergotherapeuten Betroffene darin unterstützen, bedeutungsvolle Betätigungen weiterhin auszuführen. In ergotherapeutischen Gruppentherapien können Betroffene kognitive Fähigkeiten trainieren.
Prognose
[Bearbeiten | Quelltext bearbeiten]Nachdem die Diagnose Alzheimer gestellt worden ist, beträgt die verbleibende Lebenserwartung in etwa sieben bis zehn Jahre, wobei es auch Fälle gibt, in denen das Endstadium bereits nach vier bis fünf Jahren erreicht ist. Auf der anderen Seite gab es Patienten, die noch über 20 Jahre gelebt haben.
Gesundheitsökonomische Aspekte
[Bearbeiten | Quelltext bearbeiten]Daten aus dem Jahr 2016 besagen, dass 2010 für Patienten die gesellschaftlichen Gesamtkosten in Deutschland mit leichter etwa 15.000 EUR, mit mittlerer etwa 29.000 EUR und mit mittelschwerer/schwerer Alzheimerdemenz etwa 45.000 EUR betrugen. „Die informellen Pflegekosten hatten den größten Anteil an den gesellschaftlichen Gesamtkosten: 49% bei leichter, 55 % bei mittlerer und 6 % bei mittelschwerer/schwerer AD“.[119] 2016 verursachte die Demenz für Kostenträger Zusatzausgaben von 18 Milliarden Euro: Das seien etwa 11 % der gesamten Gesundheitsausgaben für über 65-Jährige gewesen. Bezogen auf die Gesellschaft lägen die Zusatzkosten aber wesentlich höher: Hier koste die Versorgung von Demenzkranken etwa 54 Milliarden Euro, das entspricht jährlich etwa 33.200 Euro pro Patient. Die medizinische und pflegerische Versorgung eines Menschen mit Demenz belastete die Kostenträger im Schnitt mit jährlich 20.659 Euro.[120] Für Österreich gibt es eine entsprechende Meldung aus dem Jahr 2019,[121] für die Schweiz ebenfalls.[122]
Geschichte
[Bearbeiten | Quelltext bearbeiten]

Im November 1906 beschrieb der deutsche Psychiater und Neuropathologe Alois Alzheimer in einem Vortrag vor Kollegen den ersten Fall der Krankheit, die später als Alzheimer-Krankheit bekannt wurde. Alzheimer hatte die Patientin Auguste Deter im November 1901 nach ihrer Aufnahme in die Frankfurter Nervenklinik kennengelernt. Er beobachtete die damals 51 Jahre alte Patientin aufmerksam und protokollierte ihr Verhalten. Als Deter im April 1906 starb, war Alzheimer mittlerweile Laborleiter bei Emil Kraepelin in München geworden. Da Alzheimer an der Erforschung der Demenz interessiert war, ließ er sich das Gehirn der Verstorbenen von Emil Sioli schicken und untersuchte es. Alzheimers anschließender Vortrag über seine Erkenntnisse rief jedoch keine sonderlichen Reaktionen hervor, das heißt, dass die Brisanz von der damaligen Fachwelt noch nicht erkannt wurde. Im darauffolgenden Jahr veröffentlichte Alzheimer diese in dem Beitrag Über eine eigenartige Erkrankung der Hirnrinde in der Allgemeinen Zeitschrift für Psychiatrie.[123][124][125]
In den nächsten fünf Jahren wurden elf ähnliche Fälle in der medizinischen Literatur beschrieben, einige schon unter Verwendung der Bezeichnung Alzheimer-Krankheit.[126] Die offizielle Benennung geht auf den Psychiater Emil Kraepelin zurück. Kraepelin benannte die Erkrankung in der achten Ausgabe seines Lehrbuchs der Psychiatrie aus dem Jahre 1910 nach Alois Alzheimer.[127]
Da die von Alzheimer betreute Patientin relativ jung war, beschrieb er die Erkrankung als präsenile Demenz. Erst später wurde erkannt, dass die gleichen histologischen Veränderungen auch bei älteren Demenz-Patienten auftreten. Zur Abgrenzung gegenüber dem echten (präsenilen) Morbus Alzheimer wird die Erkrankungsform des älteren Menschen als Senile Demenz vom Alzheimer-Typ (SDAT oder DVAT) bezeichnet.
Im Jahr 1997 wurden originale Mikroskop-Präparate von Alzheimers Arbeit in München wiederentdeckt und neu evaluiert.[128] 2012 wurde in dem Material eine Präsenilin-Mutation nachgewiesen.[129]
Kulturelle Rezeption
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]Literarisch verarbeitete der Schriftsteller Arno Geiger die Alzheimer-Erkrankung seines Vaters in dem Sachbuch Der alte König in seinem Exil, für das der Autor 2011 für den Preis der Leipziger Buchmesse nominiert war und das ihm einen Ehrenpreis des Deutschen Hospiz- und PalliativVerbandes einbrachte.[130]
Der Roman Hirngespinste von J. Bernlef, erstmals erschienen 1984 unter dem Titel Bis es wieder hell ist und 2007 neu aufgelegt, schildert die innere Erfahrungswelt eines Alzheimer-Kranken.
Der Autor Martin Suter veröffentlichte 1997 zum Thema Altersdemenz den Roman Small World, der mit Gérard Depardieu und Alexandra Maria Lara 2010 verfilmt wurde.
John Bayley, Iris Murdochs Witwer, veröffentlichte 1999 seine Erinnerungen an deren Alzheimer-Erkrankung in Elegy for Iris, die 2001 mit Kate Winslet und Judi Dench als Iris Murdoch verfilmt wurden.
Die Aktivistin Helga Rohra (* 1953), die mit 54 Jahren die Diagnose Lewy-Body-Demenz gestellt bekam, setzt sich für die Rechte Demenzkranker ein und veröffentlichte 2011 das Buch Aus dem Schatten treten – Warum ich mich für unsere Rechte als Demenzbetroffene einsetze.[131]
Einen Comic über eine Alzheimer-Geschichte zeichnete der spanische Künstler Paco Roca unter dem Titel Kopf in den Wolken. Seine Graphic Novel erschien 2013. Das Buch handelt von erkrankten Menschen in einem Altersheim. „Die Geschichte lebt von authentischen Details, die Roca in seinem Bekannten- und Verwandtenkreis sowie durch die Recherche in einem Seniorenheim gesammelt hat. Es entfaltet sich eine Erzählung, die der Krankheit komische Seiten abgewinnt, ohne deren Tragik herunterzuspielen“, beurteilte der Kulturjournalist Ralph Trommer in seiner Besprechung in der tageszeitung (taz) am 4. November 2013.[132] Es gibt eine Zeichentrick-Verfilmung von Kopf in den Wolken mit dem Titel Wrinkles.
Sarah Leavitt brachte den Comic Das große Durcheinander – Alzheimer, meine Mutter und ich 2013 heraus.
Eine Bearbeitung des Themas Alzheimer in Form von Lyrik nahm die österreichische Autorin und Sozialpädagogin Maria Seisenbacher mit ihrem Gedichtband Ruhig sitzen mit festen Schuhen vor (2015).
Im März 2016 veröffentlichte die Publizistin Inge Jens das Sachbuch Langsames Entschwinden: Vom Leben mit einem Demenzkranken über die Demenz ihres Ehemannes Walter Jens.
Die italienische Journalistin und Autorin Michela Farabella veröffentlichte im Jahre 2019 den autobiografischen Roman Italo, con te partirò,[133] in dem sie die Leidensgeschichte ihres Vaters Italo Farabella schildert, der im Alter schwer von der Alzheimer-Krankheit betroffen war. Michela Farabella verbindet die Darstellung der sich in Turin zugetragenen tragischen Geschichte einer vierjährigen Odyssee ihres Vaters zwischen Heimen für Demenzkranke und Krankenhäusern mit der Kritik am italienischen Gesundheitssystems im Umgang mit älteren Alzheimerpatienten.
Auch in dem Roman Untertags von Schriftsteller Urs Faes, erschienen im Suhrkamp Verlag im Oktober 2020, nimmt das Thema Demenz eine zentrale Rolle ein.
Film und Theater
[Bearbeiten | Quelltext bearbeiten]In dem Theaterstück Ich muss gucken, ob ich da bin, erarbeitet von der Regisseurin Barbara Wachendorff, spielen auf der Bühne an Demenz erkrankte, ältere Schauspieler. Im Zentrum des Stücks, das 2006 für den Preis Der Faust nominiert war, steht die Lebenswelt der Betroffenen, ihre Wahrnehmung der Gegenwart und Vergangenheit.[134] Außerdem schrieb Barbara Wachendorff das Theaterstück Anderland – Eine Reise ohne Ruder ins Land der Demenz, das im Mai 2012 im Bürgerhaus Stollwerck (Köln) Premiere feierte.[135][136]
Nachdem der englische Fantasy-Autor Terry Pratchett († 12. März 2015) 2007 die Diagnose gestellt bekommen hatte, spendete er eine Million US-Dollar an den Alzheimer Research Trust. Pratchett führte in diesem Zusammenhang eine Kampagne gegen das Verbot der Sterbehilfe in Großbritannien, dazu produzierte er den BBC-Dokumentarfilm Choosing to die.[137]
Der Regisseur Iain Dilthey veröffentlichte 2009 den drei Demenz-Geschichten umfassenden Episodenfilm Eines Tages…, mit den Schauspielern Horst Janson, Annekathrin Bürger und Heinrich Schafmeister. Der Spielfilm ist Teil einer Filmratgeber-DVD-Box des LVR-Zentrums für Medien und Bildung in Düsseldorf.[138][139]
Von einem alten Ehepaar, das mit dem Schlaganfall und der dadurch fortschreitenden Demenz der Ehefrau fertig werden muss, erzählt der Film Liebe des Regisseurs Michael Haneke, der 2012 für das Beziehungsdrama bei den Filmfestspielen in Cannes die Goldene Palme verliehen bekam.
Der Episodenfilm When yesterday comes erzählt in 77 Minuten vier verschiedene Geschichten zum Thema Demenz, realisiert durch die vier taiwanischen Regisseure Hsiu Chiung Chiang, Singing Chen, Wi Ding Ho und Ko Shang Shen.
Im Dokumentarfilm Vergiss mein nicht aus dem Jahr 2012 porträtierte der Regisseur David Sieveking seine an Alzheimer erkrankte Mutter.
Der Regisseur Armin Petras widmet sich in seinem Theaterstück Demenz, Depression und Revolution, das 2013 am Berliner Maxim-Gorki-Theater Premiere feierte, ebenso der Krankheit. Eindringlich symbolisieren die Darsteller den geistigen Verfall mit Worten wie „Er gießt Kaffee auf den Teller, Brot in den Kaffee, Zeitung wird in die Limo getunkt“.[140]
Der Fernsehfilm Die Auslöschung erzählt die Geschichte der großen, aber späten Liebe einer Restauratorin, gespielt von Martina Gedeck, und eines Kunsthistorikers, dargestellt von Klaus Maria Brandauer. Ihre Beziehung verändert sich, als bei ihm die Alzheimer-Krankheit diagnostiziert wurde. Aus einer gleichberechtigten Partnerschaft entsteht nach und nach ein Pflegeverhältnis, die liebevolle Verbundenheit beider bleibt jedoch bestehen (Ausstrahlung im Sender Das Erste am 8. Mai 2013).
Der Regisseur Thomas Liesen produzierte 2013 unter dem Titel Leben, Lieben, Vergessen… eine dreijährige Langzeit-Dokumentation für Das Erste. Porträtiert wurde eine dreiköpfige Familie, die mit der genetisch bedingten Alzheimer-Erkrankung der 42-jährigen Mutter konfrontiert wird. Der Film behandelt die Entwicklung der Krankheit von der Diagnose im Frühstadium bis ins Endstadium und beschreibt die daraus resultierenden Belastungen und Einschränkungen der Familie im Alltag.[141]
In der deutschen Tragikomödie Honig im Kopf (2014) von und mit Til Schweiger setzt sich Schweiger gemeinsam mit seiner Tochter Emma Schweiger und Dieter Hallervorden mit den Themen Alzheimer und Demenz auseinander.
Still Alice – Mein Leben ohne Gestern (Still Alice) mit Julianne Moore in der Hauptrolle ist ein US-amerikanisch-französisches Filmdrama aus dem Jahr 2014 (2015 in Deutschland erschienen).[142] Es basiert auf der gleichnamigen Romanvorlage der Schriftstellerin Lisa Genova und beschäftigt sich mit dem Verlauf einer früh einsetzenden Variante von Alzheimer.
Weitere Filme
[Bearbeiten | Quelltext bearbeiten]- 1995: Sommerschnee (女人四十 / Nu ren si shi), Britisch-Hongkong, Regie: Ann Hui, mit Josephine Siao, Roy Chiao[143]
- 2001: Claire – Se souvenir des belles choses (Se souvenir des belles choses), Frankreich, Regie: Zabou Breitman, mit Isabelle Carré, Bernard Campan
- 2001: Iris, Großbritannien / USA, Regie: Richard Eyre, mit Judi Dench, Jim Broadbent, Kate Winslet
- 2003: Totgemacht – The Alzheimer Case (De zaak Alzheimer), Belgien, Regie: Erik Van Looy, mit Jan Decleir, Koen De Bouw, Werner De Smedt
- 2004: Wie ein einziger Tag (The Notebook), USA, Regie: Nick Cassavetes, mit Ryan Gosling, Rachel McAdams, James Garner, Gena Rowlands
- 2008: Immer noch Liebe! (Lovely, Still), USA, Regie: Nik Fackler, mit Martin Landau, Ellen Burstyn
- 2011: Das Blaue vom Himmel, Deutschland, Regie: Hans Steinbichler, mit Hannelore Elsner, Juliane Köhler
- 2012: Für immer dein (Still Mine), Kanada, Regie: Michael McGowan, mit James Cromwell, Geneviève Bujold
- 2013: Stiller Abschied, Deutschland, Regie: Florian Baxmeyer, mit Christiane Hörbiger[144]
- 2014: Nichts für Feiglinge, Deutschland, Regie: Michael Rowitz, mit Hannelore Hoger, Frederick Lau
- 2017: Für dich dreh ich die Zeit zurück, Österreich / Deutschland, Regie: Nils Willbrandt, mit Gisela Schneeberger, Erwin Steinhauer
- 2017: Das Leuchten der Erinnerung (The Leisure Seeker), Frankreich / Italien, Regie: Paolo Virzì, mit Helen Mirren, Donald Sutherland
- 2019: Romys Salon (Kapsalon Romy), Niederlande / Deutschland, Regie: Mischa Kamp, mit Beppie Melissen, Vita Heijmen[145]
- 2020: The Father, Großbritannien, Regie: Florian Zeller, mit Anthony Hopkins, Olivia Colman, Imogen Poots, Rufus Sewell
- 2020: Noch einmal, June (June Again), Australien, Regie: JJ Winlove, mit Noni Hazlehurst, Claudia Karvan, Stephen Curry[146]
- 2020: Supernova, Großbritannien, Regie: Harry Macqueen, mit Colin Firth, Stanley Tucci
- 2021: Die Vergesslichkeit der Eichhörnchen, Deutschland, Regie: Nadine Heinze, Marc Dietschreit, mit Emilia Schüle, Günther Maria Halmer[147]
Alzheimer-ähnliche Symptome bei Tieren
[Bearbeiten | Quelltext bearbeiten]Aufgrund verbesserter tiermedizinischer Versorgung erreichen auch Haustiere ein höheres Lebensalter. Neuropathologische Veränderungen (Plaques und vaskuläre Amyloidose) z. B. im Hirn seniler Haustiere ähneln den Befunden von an Alzheimer erkrankten Menschen.[148] Die Folge dieser Prozesse sind kognitive Funktionsstörungen, die zu übersteigerter Angst, Desorientierung, scheinbar grundloser Aggression, verringerter oder fehlender Lernfähigkeit und Verlust der Stubenreinheit führen können.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Alois Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. Vortrag (3. November) auf der Versammlung Südwestdeutscher Irrenärzte in Tübingen am 3. und 4. November 1906. Eigenbericht Alzheimers in Allg. Zeitschrift für Psychiatrie und psychisch-gerichtliche Medizin, 1907, S. 146–148.
- T. A. Bayer, O. Wirths: Alzheimer-Demenz. Molekulare Pathologie, Tiermodelle und Therapiestrategien. In: Der Nervenarzt. 79 (Suppl 3), S. 117–128.
- Anne Eckert: Alois Alzheimer und die Alzheimer Krankheit. In: Pharmazie in unserer Zeit. Band 31 (4), 2002, S. 356–360.
- Hans Förstl, Alexander Kurz, Tobias Hartmann: Alzheimer-Demenz. In: Hans Förstl (Hrsg.): Demenzen in Theorie und Praxis. 3. Auflage. Springer, Berlin u. a. 2011, ISBN 978-3-642-19794-9, S. 47–72.
- Kurt Jellinger (Hrsg.): Alzheimer – Meilensteine aus hundert Jahren wissenschaftlicher und klinischer Forschung. Akademische Verlagsgesellschaft AKA, Berlin 2006, ISBN 3-89838-077-7.
- Frank Jessen (Hrsg.): Handbuch Alzheimer-Krankheit. Grundlagen – Diagnostik – Therapie – Versorgung – Prävention. De Gruyter, Berlin 2018, ISBN 978-3-11-040345-9.
- Cornelia Stolze: Vergiss Alzheimer! Die Wahrheit über eine Krankheit, die keine ist. Kiepenheuer & Witsch, Köln 2011, ISBN 3-462-04339-0.
- J. Randall et al.: Clinical and Biomarker Changes in Dominantly Inherited Alzheimer’s Disease. In: New England Journal of Medicine. 2012, S. 120723122607004, doi:10.1056/NEJMoa1202753.
- Michael Jürgs: Alzheimer: Spurensuche im Niemandsland. Bertelsmann Taschenbuch, München 2006, ISBN 978-3-570-00934-5.
- Margret Lock: The Alzheimer Conundrum: Entanglements of Dementia and Aging. Princeton University Press 2013, ISBN 978-0-691-14978-3.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- S3-Leitlinie Demenzen der Deutschen Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde und Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand November 2023)
- Wegweiser Demenz des deutschen Bundesministeriums für Familie, Senioren, Frauen und Jugend
- Österreichische Alzheimer Gesellschaft
- Alzheimer Schweiz
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Was ist Alzheimer? - Die Alzheimer-Krankheit. In: Alzheimer Forschung Initiative. Abgerufen am 25. August 2024.
- ↑ a b c S3-Leitlinie Demenzen der Deutschen Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde und Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand November 2023)
- ↑ a b Global status report on the public health response to dementia. (PDF) World Health Organization, 2021, abgerufen am 24. Juli 2024 (englisch).
- ↑ Alexandra Bröhm: Warum Frauen häufiger an Alzheimer erkranken. In: welt.de. Axel Springer SE, 31. Mai 2016, abgerufen am 30. Dezember 2019.
- ↑ Jane Gilmore: A possible 'link’ between menopause and Alzheimer’s is scaring women, including me. In: The Sydney Morning Herald. 7. Juni 2019, abgerufen am 30. Dezember 2019 (englisch).
- ↑ Deutsche Alzheimer Gesellschaft e. V.: Die Häufigkeit von Demenzerkrankungen. (PDF) Infoblatt 1. In: deutsche-alzheimer.de. Juni 2018, abgerufen am 9. August 2019.
- ↑ Zahl der Todesfälle wegen Alzheimer von 2003 bis 2023 fast verdoppelt. In: destatis.de. Statistisches Bundesamt, 17. September 2024, abgerufen am 29. September 2024.
- ↑ Dementia. WHO, 15. März 2023, abgerufen am 31. Mai 2024 (englisch).
- ↑ „Die Ursachen der Alzheimer-Krankheit sind bislang nicht vollständig geklärt. Die bisherige Forschung zeigt, dass an ihrer Entstehung mehrere Faktoren beteiligt sind.“ In: Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0, S. 192.
- ↑ „Obgleich die Ätiologie der Alzheimer-Demenz letztlich weiterhin als ungeklärt bezeichnet werden muss, gab es doch in den letzten Jahren einen deutlichen Wissenszuwachs in der Pathologie der Erkrankung, in erster Linie auf der Basis von genetischen und molekularbiologischen Untersuchungen.“ In: R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6, S. 11–12.
- ↑ a b J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
- ↑ a b c d Alberto Serrano-Pozo, Sudeshna Das, Bradley T Hyman: APOE and Alzheimer's disease: advances in genetics, pathophysiology, and therapeutic approaches. In: The Lancet Neurology. Band 20, Nr. 1, Januar 2021, S. 68–80, doi:10.1016/S1474-4422(20)30412-9, PMID 33340485, PMC 8096522 (freier Volltext).
- ↑ a b c d Rosemary J. Jackson, Bradley T. Hyman, Alberto Serrano-Pozo: Multifaceted roles of APOE in Alzheimer disease. In: Nature Reviews Neurology. Band 20, Nr. 8, August 2024, ISSN 1759-4758, S. 457–474, doi:10.1038/s41582-024-00988-2 (nature.com [abgerufen am 27. August 2024]).
- ↑ a b c d e Caroline Van Cauwenberghe, Christine Van Broeckhoven, Kristel Sleegers: The genetic landscape of Alzheimer disease: clinical implications and perspectives. In: Genetics in Medicine. Band 18, Nr. 5, Mai 2016, S. 421–430, doi:10.1038/gim.2015.117, PMID 26312828, PMC 4857183 (freier Volltext).
- ↑ Christiane Reitz, Margaret A. Pericak-Vance, Tatiana Foroud, Richard Mayeux: A global view of the genetic basis of Alzheimer disease. In: Nature Reviews Neurology. Band 19, Nr. 5, Mai 2023, ISSN 1759-4758, S. 261–277, doi:10.1038/s41582-023-00789-z, PMID 37024647, PMC 10686263 (freier Volltext).
- ↑ a b Randall J Bateman, Paul S Aisen, Bart De Strooper et al.: Autosomal-dominant Alzheimer's disease: a review and proposal for the prevention of Alzheimer's disease. In: Alzheimer's Research & Therapy. Band 3, Nr. 1, 2010, ISSN 1758-9193, S. 1, doi:10.1186/alzrt59, PMID 21211070, PMC 3109410 (freier Volltext).
- ↑ Ira T. Lott, Elizabeth Head: Dementia in Down syndrome: unique insights for Alzheimer disease research. In: Nature Reviews Neurology. Band 15, Nr. 3, März 2019, ISSN 1759-4758, S. 135–147, doi:10.1038/s41582-018-0132-6, PMID 30733618, PMC 8061428 (freier Volltext).
- ↑ J. M. Tarasoff-Conway et al.: Clearance systems in the brain-implications for Alzheimer disease. In: Nature reviews. Neurology. Band 11, Nr. 8, August 2015, S. 457–470, doi:10.1038/nrneurol.2015.119, PMID 26195256, PMC 4694579 (freier Volltext) (Review).
- ↑ S. J. Soscia et al.: The Alzheimer’s disease-associated amyloid beta-protein is an antimicrobial peptide. In: PloS one. Band 5, Nr. 3, 2010, S. e9505, doi:10.1371/journal.pone.0009505. PMID 20209079. PMC 2831066 (freier Volltext).
- ↑ Antonios Douros, Zharmaine Ante, Carlo A. Fallone, Laurent Azoulay, Christel Renoux, Samy Suissa, Paul Brassard: Clinically apparent Helicobacter pylori infection and the risk of incident Alzheimer's disease: A population‐based nested case‐control study. In: Alzheimer's & Dementia. 13. Dezember 2023, ISSN 1552-5260, doi:10.1002/alz.13561 (wiley.com [abgerufen am 2. Januar 2024]).
- ↑ R. Mayeux, R. Ottman, M. Tang, L. Noboa-Bauza, K. Marder, B. Gurland, Y. Stern: Genetic susceptibility and head injury as risk factors for Alzheimer’s disease among community-dwelling elderly persons and their first-degree relatives. In: Ann Neurol. Band 33, Nr. 5, 1993, S. 494–501, PMID 8498827.
- ↑ K. F. Neumann, L. Rojo, L. P. Navarrete, G. Farías, P. Reyes, R. B. Maccioni: Insulin resistance and Alzheimer’s disease: molecular links & clinical implications. In: Curr Alzheimer Res.:. Nr. 5 (5), Oktober 2008, S. 438–447, PMID 18855585.
- ↑ J. S. Roriz-Filho, T. M. Sá-Roriz, I. Rosset, A. L. Camozzato, A. C. Santos, M. L. Chaves, J. C. Moriguti, M. Roriz-Cruz: (Pre)diabetes, brain aging, and cognition. In: Biochim Biophys Acta. 2009, S. 432–443, PMID 19135149.
- ↑ W. Q. Qiu, M. F. Folstein: Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer’s disease: review and hypothesis. In: Neurobiol Aging. Feb; 27 (2), 2006, S. 190–198, PMID 19135149.
- ↑ O. S. Kofman, V. H. Macmillan: Diffuse cerebral atrophy. In: Applied therapeutics. Band 12, Nr. 4, April 1970, S. 24–26, PMID 5446326.
- ↑ M. Crisby, L. Carlson, B. Winblad: Statins in the prevention and treatment of Alzheimer disease. In: Alzheimer Disease & Associated Disorders. Band 16, Nr. 3, 2002, S. 131–136, PMID 12218642.
- ↑ P. Kehoe, G. Wilcock: Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer’s disease? In: Lancet neurology. Band 6, Nr. 4, 2007, S. 373–378, PMID 17362841.
- ↑ „Why stroke ups Alzheimer’s risk“ BBC, vom 4. Juni 2007
- ↑ Theodore I. Lidsky: Is the Aluminum Hypothesis dead? In: Journal of Occupational and Environmental Medicine. Band 56, 5 Suppl, Mai 2014, S. S73–79, doi:10.1097/JOM.0000000000000063, PMID 24806729, PMC 4131942 (freier Volltext) – (englisch).
- ↑ Alzheimer’s Society: Aluminium and Alzheimer’s disease. (PDF) In: The Learning Exchange. Juni 2002, abgerufen am 9. August 2019 (englisch).
- ↑ Myths. In: Alzheimer's Association. Abgerufen am 23. Juni 2023 (englisch).
- ↑ a b Walter Stehling, Timo Grimmer, Alexander Kurz: Leichtes Metall mit schweren Folgen? Aluminium und die Alzheimer Krankheit. In: Archiv Alzheimer Info. DAlzG, März 2013, archiviert vom (nicht mehr online verfügbar) am 31. Mai 2020; abgerufen am 11. Oktober 2019.
- ↑ a b c Reduzierung der Aluminiumaufnahme kann mögliche Gesundheitsrisiken minimieren. (PDF) Stellungnahme Nr. 045/2019 des BfR. In: BfR. 18. November 2019, abgerufen am 1. Februar 2023.
- ↑ a b Delia Friess: Ist Aluminium gefährlich für uns? In: ARD alpha. 23. Januar 2023, abgerufen am 1. Februar 2023.
- ↑ Bundesinstituts für Risikobewertung: Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen (PDF; 8 Seiten, 65 kB), am 4. Oktober 2013.
- ↑ Neue Studien zu aluminiumhaltigen Antitranspirantien: Gesundheitliche Beeinträchtigungen durch Aluminiumaufnahme über die Haut sind unwahrscheinlich. (PDF) Bundesinstitut für Risikobewertung, 6. Oktober 2023, abgerufen am 25. Januar 2024 (aktualisierte Stellungnahme, ersetzt die Stellungnahme 030/2020 vom 20. Juli 2020).
- ↑ Aluminium in Antitranspirantien: Geringer Beitrag zur Gesamtaufnahme von Aluminium im Menschen. In: BfR. 20. Juli 2020, abgerufen am 15. November 2021.
- ↑ Hirnleistungs-Check zur Früherkennung einer Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: Meta-Analyse Tsoi 2016. – KK Tsoi, HW Hirai, JY Chan, TC. Kwok: Time to Treatment Initiation in People With Alzheimer Disease: A Meta-Analysis of Randomized Controlled Trials. In: Journal of the American Medical Directors Association, 2016, 17, S. 24–30, PMID 26392193; sowie Systematisches Review Lin et al. 2013 – J. S. Lin, E. O’Connor, R. C. Rossom, L. A. Perdue, E. Eckstrom: Screening for cognitive impairment in older adults: A systematic review for the U.S. Preventive Services Task Force. In: Annals of internal medicine, 2013, 159, S. 601–612, PMID 24354019. Mehr zur Begründung der Bewertung in Evidenz kompakt. (PDF; 297 kB) abgerufen am 15. Januar 2019.
- ↑ a b c d e f AWMF: S3-Leitlinie "Demenzen". Abgerufen am 7. Januar 2021.
- ↑ MRT zur Früherkennung einer Alzheimer-Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: NICE-Leitlinie von 2011. (National Institute for Health and Clinical Excellence der britischen Gesundheitsbehörde NHS) sowie Meta-Analyse Schmand et al. 2010. – B. Schmand, H. M. Huizenga, W. A. van Gool: Meta-analysis of CSF and MRI biomarkers for detecting preclinical Alzheimer’s disease. In: Psychological Medicine, Januar 2010, 40 (1): S. 135–145, PMID 19863841. Mehr zur Begründung der Bewertung in der Evidenzsynthese. (PDF; 104 kB) abgerufen am 15. Januar 2019.
- ↑ Artikel aus dem Tagesspiegel. vom 21. Februar 2018 oder aus der Ärzte-Zeitung. vom 5. Dezember 2017.
- ↑ National Institute on Aging: The Seven Warning Signs of Alzheimer’s Disease. ( vom 12. März 2009 im Internet Archive) (englisch)
- ↑ 7 Stufen von Alzheimer | Deutschland. Abgerufen am 15. April 2021.
- ↑ R. T. Linn et al.: The 'preclinical phase' of probable Alzheimer’s disease. A 13-year prospective study of the Framingham cohort. In: Arch Neurol. Band 52, Nr. 5, 1995, S. 485–490, PMID 7733843.
- ↑ J. Saxton et al.: Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset. In: Neurology. Band 63, Nr. 12, 2004, S. 2341–2347, PMID 15623697.
- ↑ E. W. Twamley, S. A. Ropacki, M. W. Bondi: Neuropsychological and neuroimaging changes in preclinical Alzheimer’s disease. In: J Int Neuropsychol Soc. Band 12, Nr. 5, 2006, S. 707–735, doi:10.1017/S1355617706060863, PMID 16961952.
- ↑ C. R. Jack et al.: Introduction to the recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 257–262, doi:10.1016/j.jalz.2011.03.004. PMID 21514247. PMC 3096735 (freier Volltext).
- ↑ G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- ↑ R. A. Sperling et al.: Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia. Band 7, Nr. 3, Mai 2011, S. 280–292, doi:10.1016/j.jalz.2011.03.003. PMID 21514248. PMC 3220946 (freier Volltext).
- ↑ M. S. Albert et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 270–279, doi:10.1016/j.jalz.2011.03.008. PMID 21514249. PMC 3312027 (freier Volltext).
- ↑ G. M. McKhann et al.: The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 263–269, doi:10.1016/j.jalz.2011.03.005. PMID 21514250. PMC 3312024 (freier Volltext).
- ↑ H.-J. Gertz, A. Kurz: Diagnose ohne Therapie. Frühdiagnostik der Alzheimer-Krankheit im Stadium der leichten kognitiven Beeinträchtigung. In: Der Nervenarzt. Band 82, Nr. 9, 2011, doi:10.1007/s00115-010-3213-3
- ↑ H. Barthel et al.: Cerebral amyloid-β PET with florbetaben (18F) in patients with Alzheimer’s disease and healthy controls: a multicentre phase 2 diagnostic study. In: The Lancet. Neurology. Band 10, Nr. 5, Mai 2011, S. 424–435, doi:10.1016/S1474-4422(11)70077-1. PMID 21481640.
- ↑ Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Florbetaben, Beschluss des G-BA "neue Untersuchungsmethode" vom 20. Februar 2014, abgerufen am 6. März 2014
- ↑ Thomas Hauser et al..: Mild cognitive impairment. Diagnostische Wertigkeit verschiedener MRT-Techniken. In: Der Radiologe. 2011; 51: S. 285–292 doi:10.1007/s00117-010-2094-6
- ↑ Marcus Bauser, Lutz Lehmann: Positronen-Emissions-Tomographie. In: Chemie in unserer Zeit. Band 46, Nr. 2, 2012, S. 94, doi:10.1002/ciuz.201200564.
- ↑ L. Mucke: Neuroscience: Alzheimer’s disease. In: Nature. Band 461, 2009, S. 895–897, PMID 19829367.
- ↑ a b H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284.
- ↑ G. A. Carlesimo, M. Oscar-Berman: Memory deficits in Alzheimer’s patients: a comprehensive review. In: Neuropsychology Review. Band 3, Nr. 2, 1992, S. 119–169, PMID 1300219.
- ↑ M. Jelicic, A. E. Bonebakker, B. Bonke: Implicit memory performance of patients with Alzheimer’s disease: a brief review. In: International psychogeriatrics / IPA. Band 7, Nr. 3, 1995, S. 385–392, PMID 8821346.
- ↑ E. M. Frank: Effect of Alzheimer’s disease on communication function. In: Journal of the South Carolina Medical Association (1975). Band 90, Nr. 9, 1994, S. 417–423, PMID 7967534.
- ↑ J. T. Becker, A. A. Overman: [The semantic memory deficit in Alzheimer’s disease]. In: Revista De Neurologia. Band 35, Nr. 8, 2002, S. 777–783, PMID 12402233.
- ↑ J. R. Hodges, K. Patterson: Is semantic memory consistently impaired early in the course of Alzheimer’s disease? Neuroanatomical and diagnostic implications. In: Neuropsychologia. Band 33, Nr. 4, 1995, S. 441–459, PMID 7617154.
- ↑ T. Benke: Two forms of apraxia in Alzheimer’s disease. In: Cortex; a Journal Devoted to the Study of the Nervous System and Behavior. Band 29, Nr. 4, 1993, S. 715–725, PMID 8124945.
- ↑ Liz Kumru: Getting Lost in Alzheimer’s. UNMC; abgerufen am 22. Juli 2007 unmc.edu ( vom 10. Mai 2001 im Internet Archive)
- ↑ Tom Rickey: Road Skills Hint At “Motion Blindness” Of Alzheimer’s. University of Rochester Medical Center, 31. Januar 2002, abgerufen am 25. März 2016.
- ↑ Konzepte für Alzheimer-Impfungen im Testlabor. In: Deutsches Ärzteblatt. 9. November 2017, abgerufen am 9. August 2019.
- ↑ Gary W. Small: What we need to know about age related memory loss. In: British Medical Journal. 22. Juni 2002, abgerufen am 5. November 2006.
- ↑ S. López-Ortiz, S. Lista, P. L. Valenzuela, J. Pinto-Fraga, R. Carmona, F. Caraci, G. Caruso, N. Toschi, E. Emanuele, A. Gabelle, R. Nisticò, F. Garaci, A. Lucia, A. Santos-Lozano: Effects of physical activity and exercise interventions on Alzheimer's disease: an umbrella review of existing meta-analyses. In: Journal of neurology. Band 270, Nr. 2, Februar 2023, S. 711–725, doi:10.1007/s00415-022-11454-8, PMID 36342524 (Review).
- ↑ P. Iso-Markku, U. M. Kujala, K. Knittle, J. Polet, E. Vuoksimaa, K. Waller: Physical activity as a protective factor for dementia and Alzheimer's disease: systematic review, meta-analysis and quality assessment of cohort and case-control studies. In: British journal of sports medicine. Band 56, Nr. 12, Juni 2022, S. 701–709, doi:10.1136/bjsports-2021-104981, PMID 35301183, PMC 9163715 (freier Volltext) (Review).
- ↑ K. I. Erickson, A. M. Weinstein, O. L. Lopez: Physical activity, brain plasticity, and Alzheimer's disease. In: Archives of medical research. Band 43, Nr. 8, November 2012, S. 615–621, doi:10.1016/j.arcmed.2012.09.008, PMID 23085449, PMC 3567914 (freier Volltext) (Review).
- ↑ K. A. Intlekofer, C. W. Cotman: Exercise counteracts declining hippocampal function in aging and Alzheimer's disease. In: Neurobiology of Disease. Band 57, September 2013, S. 47–55, doi:10.1016/j.nbd.2012.06.011, PMID 22750524 (Review).
- ↑ B. M. Brown, J. J. Peiffer, R. N. Martins: Multiple effects of physical activity on molecular and cognitive signs of brain aging: can exercise slow neurodegeneration and delay Alzheimer's disease? In: Molecular Psychiatry. Band 18, Nummer 8, August 2013, S. 864–874, doi:10.1038/mp.2012.162, PMID 23164816 (Review).
- ↑ Harsh Shah et al.: Revisiting the Role of Vitamins and Minerals in Alzheimer's Disease. In: Antioxidants (Basel, Switzerland). Band 12, Nr. 2, 8. Februar 2023, S. 415, doi:10.3390/antiox12020415, PMID 36829974, PMC 9952129 (freier Volltext) – (englisch).
- ↑ Weblink für Paper Paul T. Francis, Gordon K. Wilcock et al.: The cholinergic hypothesis of Alzheimer’s disease: a review of progress In: J Neurol Neurosurg Psychiatry (1999)
- ↑ B. Winblad, J. Cummings, N. Andreasen et al.: A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer’s disease – rivastigmine patch versus capsule. In: International Journal of Geriatric Psychiatry, Band 22, Nr. 5, S. 456–467, May 2007 doi:10.1002/gps.1788 PMID 17380489
- ↑ H. Kaduszkiewicz, T. Zimmermann, H. P. Beck-Bornholdt, Hendrik van den Bussche: Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of randomised clinical trials. In: BMJ (Clinical Research Ed.). Band 331, Nr. 7512, August 2005, S. 321–327, PMID 16081444, PMC 1183129 (freier Volltext).
- ↑ T. Lempert, T. Bschor: [Treatment of Alzheimer’s disease according to the S3 guidelines on dementia. Choline esterase inhibitors for all and for ever?]. In: Der Nervenarzt. Band 82, Nr. 1, Januar 2011, S. 90–91, doi:10.1007/s00115-010-3233-z. PMID 21274696.
- ↑ B. S. Wang, H. Wang, Z. H. Wei, Y. Y. Song, L. Zhang, H. Z. Chen: Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease: an updated meta-analysis. In: Journal of Neural Transmission. Band 116, Nr. 4, 2009, S. 457–465, doi:10.1007/s00702-009-0189-x, PMID 19221692.
- ↑ Huperzine A Alzheimer Research Forum
- ↑ Fangcheng Fan, Huan Liu, Xiaojie Shi, Yangwen Ai, Qingshan Liu, Yong Cheng: The Efficacy and Safety of Alzheimer’s Disease Therapies: An Updated Umbrella Review. In: Journal of Alzheimer's disease. Band 85, Nr. 3, 1. Februar 2022, S. 1195–1204, doi:10.3233/JAD-215423.
- ↑ Reza Majidazar, Erfan Rezazadeh-Gavgani, Saeed Sadigh‐Eteghad, Amirreza Naseri: Pharmacotherapy of Alzheimer’s disease: an overview of systematic reviews. In: European Journal of Clinical Pharmacology. Band 78, Nr. 10, 26. Juli 2022, S. 1567–1587, doi:10.1007/s00228-022-03363-6.
- ↑ R. McShane, A. Areosa Sastre, N. Minakaran: Memantine for dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2006, S. CD003154, doi:10.1002/14651858.CD003154.pub5. PMID 16625572. (Review).
- ↑ J. Birks, Evans J. Grimley: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. Nr. 2, 2007, S. CD003120, doi:10.1002/14651858.CD003120.pub2, PMID 17443523.
- ↑ J. Birks, E. Grimley, M. Van Dongen: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. S. CD003120, PMID 12519586.
- ↑ S. T. DeKosky, A. Fitzpatrick, D. G. Ives, J. Saxton, J. Williamson, O. L. Lopez, G. Burke, L. Fried, L. H. Kuller, J. Robbins, R. Tracy, N. Woolard, L. Dunn, R. Kronmal, R. Nahin, C. Furberg: The Ginkgo Evaluation of Memory (GEM) study: design and baseline data of a randomized trial of Ginkgo biloba extract in prevention of dementia. In: Contemp Clin Trials. Band 27, Nr. 3, 2006, S. 238–253, doi:10.1016/j.cct.2006.02.007, PMID 16627007.
- ↑ Ginkgo Biloba Does Not Reduce Dementia Risk, Study Shows. In: sciencedaily.com. 19. November 2008, abgerufen am 27. Dezember 2014.
- ↑ B. E. Snitz et al.: Ginkgo biloba for preventing cognitive decline in older adults: a randomized trial. In: JAMA. Band 302, Nr. 24, Dezember 2009, S. 2663–2670, doi:10.1001/jama.2009.1913. PMID 20040554. PMC 2832285 (freier Volltext).
- ↑ Stefan Weinmann et al.: Effects of Ginkgo biloba in dementia: systematic review and meta-analysis. In: BMC Geriatrics 2010, 10:14 doi:10.1186/1471-2318-10-14
- ↑ Abschlussbericht „Ginkgohaltige Präparate bei Alzheimer Demenz“. (PDF; 1,3 MB) Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen, 21. November 2008.
- ↑ B. Kastenholz: Phytopharmaceuticals in the therapy of younger Alzheimer patients. WebmedCentral AGING 2011; 2 (7): WMC002011.
- ↑ David Sanchez-Rodriguez et al.: Chaperone activity and protective effect against Aβ-induced cytotoxicity of Artocarpus camansi Blanco and Amaranthus dubius Mart. ex Thell seed protein extracts. In: Pharmaceuticals 2023, 16:6 doi:10.3390/ph16060820
- ↑ Neue Alzheimer-Antikörper: Was erreichen sie? Wo sind ihre Limitationen? In: dgn.org. 8. November 2023, abgerufen am 30. Juli 2024 (englisch).
- ↑ Full Site Shutdown Notice. In: handelsblatt.com. Abgerufen am 30. Juli 2024.
- ↑ Christopher H. van Dyck et.al: Lecanemab in Early Alzheimer’s Disease. In: N Engl J Med. Band 388, Nr. 1, 2023, S. 9–21, doi:10.1056/NEJMoa2212948.
- ↑ Leqembi (Lecanemab): Neues Alzheimer-Medikament. Deutsche Alzheimergesellschaft, Juni 2024, abgerufen am 24. Juli 2024.
- ↑ Leqembi recommended for treatment of early Alzheimer’s disease. In: ema.europa.eu. 14. November 2024, abgerufen am 14. November 2024 (englisch).
- ↑ Center for Drug Evaluation, Research: FDA approves treatment for adults with Alzheimer’s disease. In: fda.gov. 2. Juli 2024, abgerufen am 30. Juli 2024 (englisch).
- ↑ J. C. Breitner, K. A. Welsh et al.: Delayed onset of Alzheimer’s disease with nonsteroidal anti-inflammatory and histamine H2 blocking drugs. In: Neurobiology of Aging Volume 16, Issue 4, Pages 523-530, July 1995 PMID 8544901
- ↑ T. Wyss-Coray, L. Mucke: Ibuprofen, inflammation and Alzheimer disease. In: Nature medicine. Band 6, Nr. 9, September 2000, S. 973–974, doi:10.1038/79661. PMID 10973311.
- ↑ D. Dokmeci: Ibuprofen and Alzheimer’s disease. In: Folia medica. Band 46, Nr. 2, 2004, S. 5–10, PMID 15506544. (Review).
- ↑ T. Morihara et al.: Ibuprofen suppresses interleukin-1beta induction of pro-amyloidogenic alpha1-antichymotrypsin to ameliorate beta-amyloid (Abeta) pathology in Alzheimer’s models. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 30, Nr. 6, Juni 2005, S. 1111–1120, doi:10.1038/sj.npp.1300668. PMID 15688088.
- ↑ A. C. McKee et al.: Ibuprofen reduces Abeta, hyperphosphorylated tau and memory deficits in Alzheimer mice. In: Brain research. Band 1207, Mai 2008, S. 225–236, doi:10.1016/j.brainres.2008.01.095. PMID 18374906. PMC 2587244 (freier Volltext).
- ↑ M. Sastre et al.: Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma. In: Proceedings of the National Academy of Sciences. Band 103, Nr. 2, Januar 2006, S. 443–448, doi:10.1073/pnas.0503839103. PMID 16407166. PMC 1326151 (freier Volltext).
- ↑ N. Tabet, H. Feldmand: Ibuprofen for Alzheimer’s disease. In: The Cochrane database of systematic reviews. Nr. 2, 2003, S. CD004031, doi:10.1002/14651858.CD004031. PMID 12804498. (Review).
- ↑ B. De Strooper, G. König: An inflammatory drug prospect. In: Nature. Band 414, Nr. 6860, November 2001, S. 159–160, doi:10.1038/35102656. PMID 11700538.
- ↑ Gregor Larbig: Studien zur Identifizierung & Optimierung potentieller Wirkstoffe für die Behandlung von Morbus Alzheimer. Dissertation, TU Darmstadt, 2007
- ↑ Dina Bosnjak Kuharic, Domagoj Markovic, Tonci Brkovic, Milka Jeric Kegalj, Zana Rubic, Ana Vuica Vukasovic, Ana Jeroncic, Livia Puljak: Cannabinoids for the treatment of dementia. In: Cochrane Database of Systematic Reviews. Band 2021, Nr. 9, 17. September 2021, doi:10.1002/14651858.CD012820.pub2, PMID 34532852, PMC 8446835 (freier Volltext).
- ↑ Jacobo Mintzer, Krista L. Lanctôt, Roberta W. Scherer, Paul B. Rosenberg, Nathan Herrmann: Effect of Methylphenidate on Apathy in Patients With Alzheimer Disease: The ADMET 2 Randomized Clinical Trial. In: JAMA neurology. Band 78, Nr. 11, 1. November 2021, ISSN 2168-6157, S. 1324–1332, doi:10.1001/jamaneurol.2021.3356, PMID 34570180, PMC 8477302 (freier Volltext).
- ↑ Carolyn Fredericks: Methylphenidate for Apathy in Alzheimer Disease—Why Should We Care? In: JAMA Neurology. Band 78, Nr. 11, 1. November 2021, ISSN 2168-6149, S. 1311, doi:10.1001/jamaneurol.2021.2942.
- ↑ Nicolas Farina, David Llewellyn, Mokhtar Gad El Kareem Nasr Isaac, Naji Tabet: Vitamin E for Alzheimer's dementia and mild cognitive impairment. In: Cochrane Database of Systematic Reviews. Band 2017, Nr. 4, 18. April 2017, doi:10.1002/14651858.CD002854.pub5, PMID 28418065, PMC 6478142 (freier Volltext).
- ↑ Jenny McCleery, Rajesh P Abraham, David A Denton et al.: Vitamin and mineral supplementation for preventing dementia or delaying cognitive decline in people with mild cognitive impairment. In: Cochrane Database of Systematic Reviews. Band 2019, Nr. 2, 1. November 2018, doi:10.1002/14651858.CD011905.pub2, PMID 30383288, PMC 6378925 (freier Volltext).
- ↑ J. Cohen-Mansfield: Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. In: Am J Geriatr Psychiatry. 9 (4), 2001, S. 361–381. PMID 11739063 (Review)
- ↑ T. E. Dunne, S. A. Neargarder, P. B. Cipolloni, A. Cronin-Golomb: Visual contrast enhances food and liquid intake in advanced Alzheimer’s disease. In: Clin Nutr. Band 23, Nr. 4, 2004, S. 533–538, PMID 15297089.
- ↑ Die Transkranielle Pulsstimulation (TPS). In: www.alzheimer-forschung.de. 25. April 2022, abgerufen am 25. Juni 2023.
- ↑ Halbwahrheiten und Heilsversprechen – Update: Die Transkranielle Pulsstimulation (TPS®). Deutsche Alzheimer Gesellschaft, 29. März 2022, abgerufen am 22. Dezember 2023.
- ↑ Zu früh für die Regelversorgung: Transkranielle Pulsstimulation TPS bei Alzheimer – Kritische Stellungnahme der Deutschen Gesellschaft für Klinische Neurophysiologie und Funktionelle Bildgebung (DGKN) e. V. Deutsche Gesellschaft für Klinische Neurophysiologie und Funktionelle Bildgebung, 15. September 2022, abgerufen am 22. Dezember 2023.
- ↑ S3-Leitlinie Demenzen. 2017, doi:10.1007/978-3-662-53875-3.
- ↑ F. G. Boess, M. Lieb, E. Schneider, T. M. Zimmermann, R. Dodel: Kosten der Alzheimer-Erkrankung in Deutschland – aktuelle Ergebnisse der GERAS-Beobachtungsstudie. In: Gesundheitsökonomie & Qualitätsmanagement. Band 21, Nr. 5. Thieme, Oktober 2016, ISSN 1432-2625, S. 232–241, doi:10.1055/s-0042-100956.
- ↑ Michael Brendler, Susanne Gallus: Demenz: Gesellschaftliche Kosten können sich vervielfachen. 23. September 2019, abgerufen am 9. Juli 2021.
- ↑ APA: „Demenz fordert uns alle, Effizienz und Fürsorge sind gefragt“. Ehemals im (nicht mehr online verfügbar); abgerufen am 9. Juli 2021 (deutsch). (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ Demenzkosten in der Schweiz. Abgerufen am 9. Juli 2021 (deutsch).
- ↑ A. Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med. Band 64, Nr. 1–2, 1907, S. 146–148.
- ↑ Konrad Maurer, Ulrike Maurer: Alzheimer: the life of a physician and the career of a disease. Columbia University Press, New York 2003.
- ↑ Fred H. Hochberg, David Rottenberg: Neurological classics in modern translation. Hafner Press, New York 1977, ISBN 0-02-851180-8.
- ↑ N. C. Berchtold, C. W. Cotman: Evolution in the conceptualization of dementia and Alzheimer’s disease: Greco-Roman period to the 1960s. In: Neurobiol. Aging. Band 19, Nr. 3, 1998, S. 173–189, PMID 9661992.
- ↑ Emil Kraepelin: Textbook of Psychiatry. 1910.
- ↑ M. B. Graeber et al.: Rediscovery of the case described by Alois Alzheimer in 1911: historical, histological and molecular genetic analysis. In: Neurogenetics. Band 1, Nr. 1, Mai 1997, S. 73–80, PMID 10735278.
- ↑ U. Müller, P. Winter, M. B. Graeber: A presenilin 1 mutation in the first case of Alzheimer’s disease. In: The Lancet. Neurology. Band 12, Nr. 2, Februar 2013, S. 129–130, doi:10.1016/S1474-4422(12)70307-1. PMID 23246540.
- ↑ DHPV-Ehrenpreis an Arno Geiger auf www.dhpv.de, 10. Oktober 2011
- ↑ Aus dem Schatten treten – Warum ich mich für unsere Rechte als Demenzbetroffene einsetze von Helga Rohra auf www.demenz-support.de
- ↑ Ralph Trommer: Meister der leisen Töne. In: taz.de. 4. November 2013, abgerufen am 27. Dezember 2014.
- ↑ Michela Farabella: Italo, con te partirò. Hrsg.: Carello Edizioni. Turin 2019, ISBN 978-88-96864-81-4, S. 144 (italienisch).
- ↑ Theatermacherin Barbara Wachendorff mit Stück über Demenz
- ↑ Interview mit Regisseurin Barbara Wachendorff. In: Sommerblut – Festival der Multipolarkultur. 7. Mai 2012, archiviert vom (nicht mehr online verfügbar) am 9. August 2019; abgerufen am 9. August 2019.
- ↑ Anderland – Demenz-Theaterstück
- ↑ Jochen Wittmann: Pratchetts "Choosing to die: Selbstmord zur besten Sendezeit. In: derstandard.at. 15. Juni 2011, abgerufen am 27. Dezember 2014.
- ↑ Eines Tages… Offizielle Homepage zum Spielfilm
- ↑ DVD-Box Demenz. In: LVR-Klinikverbund. Landschaftsverband Rheinland (LVR), archiviert vom (nicht mehr online verfügbar) am 9. August 2019; abgerufen am 9. August 2019.
- ↑ Johan Dehoust: Maxim Gorki Theater: Stuhlkreis mit Kater. In: Spiegel Online. 2. Januar 2013, abgerufen am 27. Dezember 2014.
- ↑ Thomas Liesen (Buch und Regie), Ulrike Schweitzer (Redaktion): Leben, Lieben, Vergessen… Längengrad-Filmproduktion, 2013 Online bei YouTube.
- ↑ Filmdrama "Still Alice", Infos und Bewertung auf score11.de, abgerufen am 12. September 2015.
- ↑ Sommerschnee. In: Lexikon des internationalen Films. Filmdienst, abgerufen am 29. August 2023.
- ↑ Stiller Abschied. In: daserste.de. Das Erste, archiviert vom (nicht mehr online verfügbar) am 27. September 2023; abgerufen am 27. September 2023.
- ↑ Romys Salon. In: daserste.de. Das Erste, abgerufen am 18. Juni 2023.
- ↑ Noch einmal, June. In: programm.ard.de. ARD, archiviert vom (nicht mehr online verfügbar) am 13. Dezember 2023; abgerufen am 13. Dezember 2023.
- ↑ Die Vergesslichkeit der Eichhörnchen. In: rbb-online.de. rbb, abgerufen am 11. Mai 2023.
- ↑ A. Gołaszewska, W. Bik, T. Motyl, A. Orzechowski: Bridging the Gap between Alzheimer's Disease and Alzheimer's-like Diseases in Animals. In: International Journal of Molecular Sciences. Band 20, Nummer 7, April 2019, S. , doi:10.3390/ijms20071664, PMID 30987146, PMC 6479525 (freier Volltext) (Review).