Prins-Reaktion
Die Prins-Reaktion, auch Kriewitz-Prins-Reaktion[1] ist eine Reaktion der organischen Chemie, bestehend aus einer elektrophilen Addition eines Aldehyds oder Ketons an ein Alken oder Alkin, gefolgt von der Addition eines Nucleophils an das entstehende Intermediat.[2][3][4] Der Ausgang der Reaktion hängt wesentlich von den Reaktionsbedingungen ab (siehe Schema 1). So ist das Reaktionsprodukt eines Alkens mit Formaldehyd in Wasser oder in Gegenwart einer Brønstedsäure ein 1,3-Diol, während unter Ausschluss protischer Lösungsmittel eine Wasserabspaltung zum entsprechenden Allylalkohol einsetzt. Bei einem Überschuss an Formaldehyd und niedriger Reaktionstemperatur ist das Produkt ein Acetal mit Formaldehyd (1,3-Dioxan), findet die Reaktion in Essigsäure als Lösungsmittel statt, wird der entsprechende Carbonsäureester gebildet.

Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Reaktion wurde ursprünglich von dem niederländischen Chemiker Hendrik Jacobus Prins (1889–1958) im Jahre 1919 als Reaktion von Styrol (siehe Schema 2), Pinen, Campher, Eugenol, Isosafrol und Anethol mit Formaldehyd publiziert:
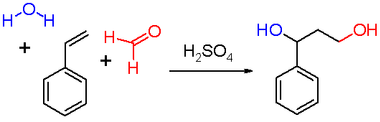
Im Jahre 1937 erlangte die Reaktion als Teil einer Synthese für Diolefine, für die Herstellung von Isopren und damit auch dem synthetischen Gummi (mit der Struktur von Naturkautschuk), Bedeutung:

Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Zunächst wird die Carbonylverbindung von der Säure protoniert, so dass das Oxoniumion resultiert. Das Elektrophil greift in einer elektrophilen Addition das Alken an, es resultiert das Carbokation-Intermediat. Es existieren Hinweise, dass dieses über einen Nachbargruppeneffekt stabilisiert wird.
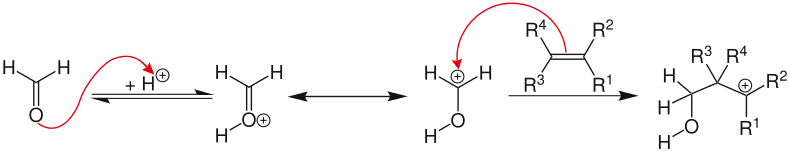
Es ergeben sich dann insgesamt vier mögliche Reaktionswege für das entstehende Oxo-Carbokation-Intermediat:
- Das Carbokation wird von Wasser oder einem anderen geeigneten Nukleophil abgefangen und reagiert zum 1,3-Addukt.
- Das Carbokation wird von einer weiteren Carbonylverbindung abgefangen. Auf diese Weise wird die positive Ladung in mesomeren Grenzformeln über Sauerstoff und Kohlenstoff delokalisiert. In einem Ringschluss entsteht Dioxan. Ein Beispiel ist die Umwandlung von Styrol zu 4-Phenyl-m-Dioxan.[5]
- Es setzt eine Eliminierungsreaktion zu einer ungesättigten Verbindung ein. Trägt das Alken eine Methylgruppe, kann auf die Eliminierung der Transfer eines Allylprotons und anschließend die Addition einer Carbonylgruppe folgen.
- Nur in sehr speziellen Fällen und nur wenn das intermediär entstehende Carbokation außerordentlich stabil ist entsteht das Oxetan. Die photochemisch induzierte Paternò-Büchi-Reaktion zwischen Alkenen und Aldehyden zu Oxetanen ist jedoch im Allgemeinen unkomplizierter.
Varianten
[Bearbeiten | Quelltext bearbeiten]Es existieren eine ganze Reihe von Variationen für die Prins-Reaktion, da sie zum einen zur Bildung von Ringen eingesetzt werden kann und zum anderen eine große Bandbreite an Nucleophilen zum Abfangen des intermediär gebildeten Oxo-Carbeniumions existieren.
Halo-Prins-Reaktion
[Bearbeiten | Quelltext bearbeiten]Die Halo-Prins-Reaktion ist eine dieser Modifikationen: Protische Lösungsmittel oder Brønstedsäuren werden durch Lewissäuren wie Zinn(IV)-chlorid, Titan(IV)-chlorid oder Bortribromid ersetzt. Das Halogen stellt jetzt das mit dem Carbokation rekombinierende Nucleophil dar. Der Ringschluss des Allyl-Pulegons in Schema 7 mit Titantetrachlorid in Dichlormethan bei −78 °C ist so ein möglicher diastereoselektiver Weg zur Synthese einer Decalinstruktur mit Hydroxy- und Chloridgruppe in cis-Stellung (de = 91 % cis).[6] Ursache ist die intermediäre Entstehung des Trichlortitanalkoxids, an das die Anlagerung des Chlorids an das Carbokation vorzugsweise von der gleichen Seite erfolgt. Das trans-Diastereomer wird bevorzugt gebildet, wenn die Reaktion in Zinntetrachlorid bei Raumtemperatur erfolgt.

Prins-Pinakol-Reaktion
[Bearbeiten | Quelltext bearbeiten]Die Prins-Pinakol-Reaktion ist eine Kaskadenreaktion, bestehend aus einer Prins-Reaktion und einer Pinakol-Umlagerung. Die Carbonylgruppe in Schema 8[7] wird als geschütztes Dimethylacetal und die Hydroxygruppe als Triisopropylsilylether (TIPS) eingesetzt. Mit der Lewissäure Zinnchlorid wird das Oxoniumion aktiviert und die Pinakol-Umlagerung des Intermediats der Prins-Reaktion führt zu einer Verkleinerung des Ringes mit Verschiebung der positiven Ladung zum TIPS-Ether, der mit mäßiger Diastereoselektivität in eine Aldehydgruppe zerfällt.

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Boy Cornils, Wolfgang A. Herrmann, Horst‐Werner Zanthoff, Chi‐Huey Wong: Catalysis from A to Z: A Concise Encyclopedia. 4. Auflage, Wiley-VCH, 2013, doi:10.1002/9783527671380, S. 1840.
- ↑ H. J. Prins: Condensation of formaldehyde with some unsaturated compounds, Chemisch Weekblad 1919, 16, 64, 1072, 1510.
- ↑ Chemical Abstracts, 1919 13, 3155.
- ↑ E. Arundale, L. A. Mikeska: The Olefin-Aldehyde Condensation. The Prins Reaction, Chem. Rev.; 1952; 51(3); 505–555.
- ↑ R. L. Shriner and Philip R. Ruby: 4-Phenyl-m-dioxane In: Organic Syntheses. 33, 1953, S. 72, doi:10.15227/orgsyn.033.0072; Coll. Vol. 4, 1963, S. 786 (PDF).
- ↑ R. Brandon Miles, Chad E. Davis, and Robert M. Coates: Syn- and Anti-Selective Prins Cyclizations of ,-Unsaturated Ketones to 1,3-Halohydrins with Lewis Acids, J. Org. Chem. 2006, 71, 1493–1501.
- ↑ Larry E. Overman and Emile J. Velthuisen: Scope and Facial Selectivity of the Prins-Pinacol Synthesis of Attached Rings, J. Org. Chem. 2006, 71, 1581–1587.



