Snouten
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Snouten | ||||||||||||
| Andere Namen |
Pentacyclo[4.4.0.02,4.03,8.05,7]dec-9-en (IUPAC) | ||||||||||||
| Summenformel | C10H10 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 130,2 g·mol−1 | ||||||||||||
| Schmelzpunkt |
60 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Snouten ist eine chemische Verbindung aus der Gruppe der ungesättigten polycyclischen aliphatischen Kohlenwasserstoffe, bestehend aus Sechs-, Fünf- und Dreiringen. Die Verbindung gehört wie die Platonischen Kohlenwasserstoffe oder die Asterane zu den Käfigverbindungen. Snouten ist ein Valenzisomer des tricyclischen C10H10-Kohlenwasserstoffs Bullvalen.
Die Verbindung wurde erstmals 1970 durch William G. Dauben beschrieben.[1] Die Bezeichnung für die Verbindung wurde 1971 durch Leo A. Paquette geprägt. Der Name leitet sich vom mittelalterlichen englischen Wort „snoute“ (deutsch „Schnauze“) ab und bezieht sich auf die Ähnlichkeit der Struktur dieses Moleküls mit der vorderen Verlängerung des Kopfes verschiedener Tiere, wie beispielsweise dem Krokodil. Für die gesättigte Stammverbindung wurde die Bezeichnung Snoutan vorgeschlagen.[3]
Synthese
[Bearbeiten | Quelltext bearbeiten]Ausgangsverbindungen für die Synthese von Snouten sind Cyclooctatetraen 1 und Maleinsäureanhydrid 2, die in einer Diels-Alder-Reaktion zu dem polycyclische Dien 3 reagieren. Durch Belichtung in Aceton erhält man durch eine intramolekulare Cyclisierung das Basketan-Derivat 4, das durch Umsetzung mit Methanol und zusätzlich mit Diazomethan in den cis-Basketan-9,10-dimethylester 5 überführt werden. Durch Silbernitrat oder Silbertetrafluoroborat katalysiert wird der Basketandimethylester zum cis-Snoutandimethylester 6 umgelagert. Durch Verseifung wird die trans-Snoutan-9,10-dicarbonsäure 7 erhalten, die mit Bleitetraacetat oder elektrolytisch zum Snouten 8 decarboxyliert wird.[1][3]
Eigenschaften
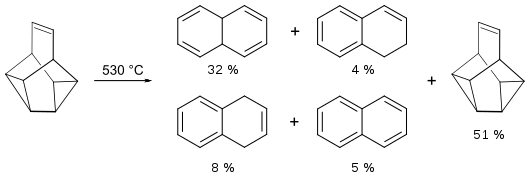
[Bearbeiten | Quelltext bearbeiten]Snouten zeigt eine bemerkenswert hohe Thermostabilität. Bei der Pyrolyse in der Gasphase bei 500 °C (Kontaktzeit 1 Sekunde) findet man zu 86 % das Ausgangsmaterial und zu 14 % cis-9,10-Dihydronaphthalin. Bei einer Temperatur von 530 °C entsteht neben 51 % Snouten, zu 32 % cis-9,10-Dihydronaphthalin, 8 % 1,4-Dihydronaphthalin, 4 % 1,2-Dihydronaphthalin und 5 % Naphthalin:[3]
Pyrolyseversuche mit deuteriertem Snouten zeigen, dass bei 500 °C eine degenerierte Umlagerung stattfindet. Ausgehend von 9,10-Dideuterosnouten – hergestellt durch Hydrolyse von Snoutan-9,10-dimethylester mit Natriumdeuteroxid in D2O und anschließender elektrolytischer Decarboxylierung – findet man nach der Pyrolyse im Reaktionsgemisch auch 4,5-Dideuterosnouten.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c W.G. Dauben, M.G. Buzzolini, C.H. Schallhorn, D.L. Whalen, K.J. Palmer: Thermal and silver ion catalyzed isomerization of the 1,1′-bishomocubane system: preparation of a new C10H10isomer. In: Tetrahedron Letters. Band 11, Nr. 10, Januar 1970, S. 787, doi:10.1016/S0040-4039(01)97830-X.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d Leo A. Paquette, John C. Stowell: Silver(I) Ion Catalyzed Rearrangements of Strained σ Bonds. III. The Synthesis and Degenerate Thermal Valence Isomerization of Pentacyclo[3.3.2.02,4.03,7.06,8]dec-9-ene. In: Journal of the American Chemical Society. Band 93, Nr. 10, Mai 1971, S. 2459, doi:10.1021/ja00739a017.