Trifluorsilan
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
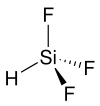
| ||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||
| Allgemeines | ||||||||||
| Name | Trifluorsilan | |||||||||
| Summenformel | SiHF3 | |||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 86,09 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||
| Dichte |
3,52 g·l−1[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
−95 °C[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Trifluorsilan ist eine chemische Verbindung aus der Gruppe der Silane.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Trifluorsilan kann durch Reaktion von Trichlorsilan mit Antimon(III)-fluorid, Zink(II)-fluorid oder Titan(IV)-fluorid[3] gewonnen werden.[4][5]
Die Verbindung kann auch durch Pyrolyse aus Difluorsilan gewonnen werden.[6] Sie wurde Anfang des 20. Jahrhunderts von Otto Ruff erstmals dargestellt.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trifluorsilan ist ein farbloses, brennbares Gas, das mit Wasser hydrolisiert und sich schon bei Raumtemperatur langsam zersetzt. Es zerfällt beim Erhitzen auf 400 °C rasch in Wasserstoff, Silicium und Tetrafluorsilan. Es zersetzt Alkohol und Ether und reduziert konzentrierte Salpetersäure. Mit Luft bildet es ein explosives Gasgemisch.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2016, ISBN 978-1-4398-8050-0, S. 87 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 254.
- ↑ C. C. Addison: Inorganic Chemistry of the Main-Group Elements. Royal Society of Chemistry, 1973, ISBN 0-85186-752-9, S. 188 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Leopold Gmelin: Silicon: Supplement volume. Springer-Verlag, 1996, ISBN 3-540-93728-5, S. 82 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Theodore M. Besmann: Proceedings of the Thirteenth International Conference on Chemical Vapor Deposition. The Electrochemical Society, 1996, ISBN 1-56677-155-2, S. 203 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Helmut Werner: Geschichte der anorganischen Chemie Die Entwicklung einer Wissenschaft in Deutschland von Döbereiner bis heute. John Wiley & Sons, 2016, ISBN 978-3-527-33907-5, S. 38 (eingeschränkte Vorschau in der Google-Buchsuche).

