Keratokonus
| Klassifikation nach ICD-10 | |
|---|---|
| H18.6 | Keratokonus |
| H19.8 | Keratokonus bei Down-Syndrom |
| Q13.4 | Kongenitaler Keratokonus |
| Q13.9 | Angeborene Fehlbildung des vorderen Augenabschnittes |
| Z94.7 | Zustand nach Keratoplastik |
| ICD-10 online (WHO-Version 2019) | |
Die Augenkrankheit Keratokonus (von altgriechisch κέρας Keras ‚Horn‘, lateinisch conus ‚Kegel‘, Hornhautkegel) bezeichnet die fortschreitende Ausdünnung und kegelförmige Verformung der Hornhaut des Auges. Die Krankheit ist immer beidseitig, kann aber auf einem Auge schwächer ausgeprägt sein oder überhaupt nicht symptomatisch werden (Forme Fruste Keratokonus). Die Erkrankung ist also durch zwei Eigenschaften charakterisiert:
- Progression (Entwicklung): Die Hornhaut wird immer dünner und spitzer
- Sehschwäche: Durch die unregelmäßige Verformung der Hornhaut nimmt die Sehschärfe ab.
In der Regel sind die Betroffenen kurzsichtig. Diese Kurzsichtigkeit kann allerdings nicht vollständig mit einer Sehhilfe korrigiert werden, da die kegelförmige Hornhautvorwölbung eine irreguläre Hornhautverkrümmung (Astigmatismus) bedingt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Der deutsche Augenarzt Burkhard David Mauchart hatte 1748 in seiner Doktorarbeit eine Krankheit beschrieben, die er „Staphylom diaphanum“ nannte.[1] Allerdings dauerte es bis 1854, bis der britische Arzt John Nottingham den Keratokonus genauer beschrieb und auch feststellte, dass er sich deutlich von anderen Ektasien der Hornhaut unterscheidet.[1] Nottingham berichtete von Fällen mit „konischer Hornhaut“ und beschrieb mehrere Merkmale der Krankheit wie Diplopie, Schwächung der Hornhaut und Schwierigkeiten beim Sehen mit Korrekturlinsen.[2]
Im Jahr 1859 benutzte der Chirurg William Bowman ein Ophthalmoskop (kurz zuvor von Hermann von Helmholtz erfunden), um den Keratokonus genauer zu diagnostizieren.[3] Bowman führte einen feinen Haken durch die Hornhaut ein, mit dem er an der Iris zog und die Pupille zu einem senkrechten Schlitz – wie bei einer Katze – ausdehnte. Diese Methode konnte er erfolgreich bei einer 18-jährigen Frau anwenden.
1869 bekam die Störung von dem Schweizer Augenarzt Johann Friedrich Horner ihren heute gültigen Namen.[4]
Epidemiologie
[Bearbeiten | Quelltext bearbeiten]Der Keratokonus tritt in den Ländern der westlichen Welt bei ca. 1 Person pro ca. 1000–2000 Einwohnern auf. In Ländern des Mittleren Ostens und Asiens ist die Häufigkeit des Vorkommens höher. In Deutschland ist etwa 0,5 ‰ der Bevölkerung, d. h. jeder 2000. (insgesamt etwa 40.000 Personen) betroffen, was aber nach Region und Untersuchungsmethode variieren kann. Bei Menschen mit Down-Syndrom liegt eine Fallzahl von bis zu 15 % vor.[5]
Meist wird der Keratokonus zwischen dem 20. und 30. Lebensjahr manifest. Er kann aber auch vom Kindesalter an und bis zum 40. oder 50. Lebensjahr symptomatisch werden.[6]
Symptome
[Bearbeiten | Quelltext bearbeiten]
Erste Anzeichen sind häufige Brillenkorrekturen mit Veränderung der Achse und wechselnde Sehstärke sowie eine zunehmende Hornhautkrümmung, oft zunächst an einem Auge. Da es sich um eine seltene Krankheit handelt, werden die Symptome im Anfangsstadium oft nicht dieser Augenkrankheit zugeordnet. Die meisten Betroffenen haben einen jahrelangen Wechsel von verschiedenen Augenärzten hinter sich, bis sie auf einen treffen, der die Erkrankung erkennt. Bei Keratokonus sehen die Betroffenen, zum Teil nur auf einem Auge, Phänomene wie z. B.: „Doppeltsehen von Gegenständen“ (monokulare Diplopie), zusätzliche Schatten an Buchstaben und Gegenständen, sowie Schlieren oder sternförmige Strahlen, die von Lichtquellen auszugehen scheinen.
Eine sichere Beurteilung der Symptome ist im Anfangsstadium nur durch eine Analyse der Hornhautoberfläche, der Hornhautrückfläche, der Hornhautdicke und ggf. noch einer Zellzahlbestimmung möglich.
Weitere Kennzeichen sind Hämosiderinringe (Fleischer’sche Ringe), bekannt als Keratokonuslinien. Hier tritt eine gelbbraune bis grünbraune Färbung auf, die als halber oder geschlossener Kreis die Basis des Kegels umzieht, sichtbar bei guter Beleuchtung. Während des weiteren Verlaufs können oberflächliche, unregelmäßige Narben und Trübungen wie auch Einrisse in der Descemetschen Membran sichtbar werden und Vogt’sche Linien auftreten.
Bei einem fortgeschrittenen Krankheitsbild lässt sich ein Keratokonus mit bloßem Auge von der Seite erkennen. Wenn es zu einem Hornhautödem (Flüssigkeitsansammlung in der Hornhaut) kommt, liegt ein akuter Keratokonus vor. Dieser kann unter Narbenbildung nach drei bis vier Monaten abheilen.
Selten kann es zu Rissen in der hinteren Hornhaut kommen, so dass Flüssigkeit aus der vorderen Augenkammer in die Hornhaut eindringt, es kommt zu einem Hydrops bzw. akuten Keratokonus. Dieser äußert sich außerdem in einer akuten, starken Eintrübung der Hornhaut (man sieht Nebel). Der Hydrops bildet sich i.a. von selbst zurück.

Wenn der Patient den Blick nach unten richtet, kann die konusförmige Ausstülpung des Auges das Unterlid V-förmig eindellen. Das ist als Munson-Zeichen bekannt, benannt nach dem amerikanischen Augenarzt Edwin Sterling Munson (1870–1958).[7]
Ursache
[Bearbeiten | Quelltext bearbeiten]Die Ursache für den Keratokonus ist bis heute, trotz umfangreicher Studien (z. B. Langzeitstudien in den USA bei 40.000 Betroffenen), noch nicht bekannt.
Ultrastrukturelle Untersuchungen zeigen, dass die reguläre Schichtung der Kollagenlamellen in der Hornhaut durchbrochen ist. Die Anordnung der Kollagenlamellen in einer orthogonalen Schichtung ist zerstört.[8] Die Zerstörung erfolgt wahrscheinlich über proteolytische Aktivität. In 23 % der Fälle ist eine genetische Disposition bekannt, als einziges Gen kommt VSX1 (Visual system homeobox gene 1; KTCN1) in Frage.[9] Übermäßiges Reiben am Auge und bestimmte Umweltfaktoren etc. können auch in Frage kommen. Das dann folgende biomechanische Ungleichgewicht zwischen Druckbelastung (Augeninnendruck) und abnehmender Gewebsstärke hält dann einen Kreislauf aufrecht, der sich im Fortschreiten der Erkrankung ausdrückt.[10]
Verlauf
[Bearbeiten | Quelltext bearbeiten]Die Veränderung der Hornhautoberfläche kann anfänglich, bei gering ausgeprägtem Keratokonus, noch oft mit einer Brille ausgeglichen werden. Manche Patienten kommen sehr lange Zeit gut mit einer Brille zurecht. Einige Patienten haben in diesem Stadium auch mehrere Brillen mit verschiedenen Stärken und Sehachsen, die zum Teil in Kombination mit Kontaktlinsen getragen werden, da sich Sehstärke und Achse zum Teil im Verlauf von Tagen ändern können.
Bei Fortschreiten des Keratokonus und stärkerer Veränderung der Hornhaut kann die Fehlsichtigkeit in der Regel mit formstabilen Kontaktlinsen vermindert werden.
Wenn auch mit Kontaktlinsen keine ausreichende Sicht mehr erzielt werden kann, weil der Konus sehr weit fortgeschritten ist oder die Kontaktlinsen nicht mehr gut angepasst werden können, kann die defekte Hornhaut gegen ein Transplantat ausgetauscht werden. Das tritt in etwa 20 % der Fälle ein. Die Transplantation wird in einer Augenklinik durchgeführt. Dort wird die defekte Hornhaut gegen eine Spenderhornhaut ausgetauscht oder seltener mit anderen Methoden stabilisiert.
Stadien
[Bearbeiten | Quelltext bearbeiten]Marc Amsler
[Bearbeiten | Quelltext bearbeiten]Bereits um 1950 hat Marc Amsler (1891–1968) den Keratokonus in vier Stadien eingeteilt. Hier die erweiterte Tabelle von Dieter Muckenhirn mit der Hornhautexcentrizität, die seit der Sagittalradienmessung (mit Ophthalmometer) dazu kam.
| Grad | Amslerwinkel | Zentrale Radien | VisusBrille | VisusCL1 | Transparenz | Dicke HH2 | Exc.3 |
|---|---|---|---|---|---|---|---|
| 1 | 0° - 3° | > 7,5 | 1,0 – 0,8 | > 1 | normal | 0,5 mm | < 0,8 |
| 2 | 4° - 9° | 7,5 – 6,5 | 0,8 – 0,2 | 1,0 – 0,8 | normal | 0,5 mm | < 0,8 |
| 3 | > 9° | 6,5 – 5,8 | 0,2 – 0,1 | 0,8 – 0,4 | leicht trüb | 0,25 mm | 1,2 – 1,5 |
| 4 | nicht messbar | < 5,8 | < 0,1 | 0,4 – 0,2 | stark trüb | < 0,2 mm | > 1,5 |
1 CL = Kontaktlinse 2 HH = Hornhaut 3 exc. = Excavation, wird in der Anatomie ein Spaltraum bezeichnet, der sich wie eine Ausbuchtung zwischen anderen Gewebestrukturen ausbreitet.
Jörg Krumeich
[Bearbeiten | Quelltext bearbeiten]Das Stadium ist festgelegt, wenn eines der jeweiligen Charakteristika zutrifft. Die Hornhautdicke bezieht sich auf die dünnste gemessene Stelle der Hornhaut.
Konusstadien nach Krumeich:[11][12][13]
| Stadium | Klinische Kriterien |
|---|---|
| Stadium 1 |
|
| Stadium 2 |
|
| Stadium 3 |
|
| Stadium 4 |
|
Auswirkungen
[Bearbeiten | Quelltext bearbeiten]- Allmähliche Sehverschlechterung
- Verschwommenes Sehen
- Verzerrungen
- Doppelt- oder Mehrfachbilder
- Geisterbilder beim Sehen
- Permanent gerötete Augen
- Übermüdung und Anspannung der Gesichtsmuskeln
- Starke Unannehmlichkeiten bei trockener, kalter, staubiger und stickiger Luft
- Extreme Blend- und Lichtempfindlichkeit
- Halos
- Vermindertes Dämmerungs- und Nachtsehen
- Verlust oder regelmäßiges Verrutschen der Kontaktlinsen
- Sterne beim Betrachten einzelner Lichtquellen
- Schlieren beim Lesen von Buchstaben
Diese Nebenwirkungen müssen nicht bei allen Betroffenen auftreten. Die Phänomene sind individuell, genau wie die Entwicklung des Keratokonus von Auge zu Auge verschieden ist.
Begleiterkrankungen
[Bearbeiten | Quelltext bearbeiten]Jeder zweite Patient leidet mehr oder minder an einer Überempfindlichkeit. Beispiele dafür sind:
- Trockene Augen
- Dunkle Augenringe
- Starke Lichtempfindlichkeit
- Weichteil-Rheumatismus
- Hautprobleme (atopischen Ekzems, Neurodermitis, Keratosis pilaris (Reibeisenhaut))
- Allergien (Hausstaub, Pollen, Heuschnupfen)
- Asthma
- Keratoconjunctivitis vernalis (Bindehautentzündung)
- Schilddrüsenunterfunktion[14][15]
- Glasknochenkrankheit[16]
- Multiple Sklerose (Autoimmunerkrankung des ZNS)
- Kollagenosen (Bindegewebserkrankung)
- Retinopathia pigmentosa (eine Netzhauterkrankung)
- Mitralklappenprolaps (eine angeborene Herzerkrankung)[17]
Erbkrankheiten
[Bearbeiten | Quelltext bearbeiten]Häufig wird eine Assoziation (Verknüpfung) mit diversen Erbkrankheiten beobachtet:
- Trisomie 21[5]
- Monosomie-X-Syndrom
- Ehlers-Danlos-Syndrom
- Marfan-Syndrom[18][19]
- Alport-Syndrom
- Silver-Russell-Syndrom
- Noonan-Syndrom
- Mulvihill-Smith-Syndrom[20]
- Urrets-Zavalia Syndrom[21]
- Floppy-Eyelid-Syndrom[22]
Die Tränenqualität ist durch eine solche Zweiterkrankung oft beeinträchtigt und kann durch Medikamente zusätzlichen Veränderungen unterworfen sein.
Diagnose
[Bearbeiten | Quelltext bearbeiten]Bei Verdacht auf einen Keratokonus sollte eine Skiaskopie durchgeführt werden, bei irregulärem Reflex (Scheren-Phänomen) besteht bereits ein erhöhter Verdacht. Zur weiteren Untersuchung sollte ein Keratoskop (Placido-Scheibe) und eine Keratometrie zur Überprüfung der Hornhaut-Topografie herangezogen werden.
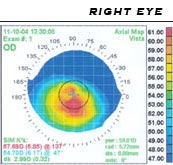
Diagnosegeräte
[Bearbeiten | Quelltext bearbeiten]- Skiaskop, ältestes Messgerät, bei Keratokonus ist der typische „Fischmauleffekt“ zu sehen
- Ophthalmometer (Keratometer) zum Messen der Hornhautradien und zum Kontaktlinsen anpassen.[23][24]
- Spaltlampe, auch Hornhautmikroskop genannt, zum Erkennen der Hornhautschichten und -dicke
- Keratograf / Placido-Scheibe (Videokeratometer), zur Erfassung der Oberflächenstruktur[25]
- Pentacam (Scheimpflugkamera)[26] und OrbScan[27][28] zur Erfassung der Topografie der Vorder- und Rückseite (Endothel), sowie Berechnung der Dicke der Hornhaut
- Optische Kohärenztomografie (OCT) zur Aufnahme eines Querschnitts des vorderen Augenabschnitts, Hornhautdicke und Verlauf der Oberfläche können dokumentiert werden[29]
Seit einiger Zeit kann zusätzlich zu den optischen Parametern auch die mechanische Stabilität[30] mit sogenannten Tonometern erfasst werden. Diese Geräte sind eine Weiterentwicklung der herkömmlichen Tonometer zur Augeninnendruckmessung und wurden u. a. mit Ultra-High-Speed-Kameras ausgerüstet. Mit diesen modernen Tonometern kann die mechanische Stabilität der einzelnen Hornhautschichten erfasst und in der Gesamtbeurteilung berücksichtigt werden.
Abgrenzung
[Bearbeiten | Quelltext bearbeiten]
Besonders im Anfangsstadium kann ein Keratokonus mit einer irregulären Hornhautverkrümmung oder aus Unerfahrenheit mit einer pelluciden marginalen Hornhautdegeneration (PMD) verwechselt werden.[31] Andere Hornhautdegenerationen, die auch eine Ausdünnung verursachen, sind der Keratoglobus (betrifft die ganze Hornhaut). Die Keratektasie, kann ein Anfangsstadium von Keratokonus sein.
Unter Keratoconus posticus wird eine Krümmungszunahme der hinteren Hornhaut verstanden, gleichzeitig bleibt aber die Hornhautoberfläche unversehrt.[32] Es scheint eine Verbindung zwischen Keratokonus und Keratoconus posticus zu bestehen.
Bei einer Fuchs-Endotheldystrophie hingegen verdickt sich die Hornhaut zentral.
Behandlung
[Bearbeiten | Quelltext bearbeiten]Brille
[Bearbeiten | Quelltext bearbeiten]Eine Möglichkeit zur Behandlung ist die Brille, welche meist zu Beginn der Erkrankung eingesetzt wird. Manche Augenärzte sind der Meinung, diese Möglichkeit sei besser als Kontaktlinsen, da Kontaktlinsen den Keratokonus auslösen oder zumindest verstärken könnten. Ein Nachweis dazu fehlt aber. Andere berichten, dass eine Behandlung mit harten Kontaktlinsen eine weitere Ausbildung des Hornhautkegels unterbindet. Es soll sogar zu einer Abflachung der Kegelspitzen kommen.
Hilfreich soll das Tragen einer Rasterbrille mit kleinen Löchern im Brillenglas sein. Durch dieses Punktraster wird der einfallende Lichtstrahl schon vor dem Auge gebündelt und ausgerichtet. Eine Heilung oder Rückentwicklung des Keratokonus ist damit aber nicht zu erreichen, einen wissenschaftlichen Beleg für die Wirksamkeit der Rasterbrille gibt es nicht.
Kontaktlinsen
[Bearbeiten | Quelltext bearbeiten]Übersicht
[Bearbeiten | Quelltext bearbeiten]| Methode | Fälle |
|---|---|
| Weiche Linsen (Standard) | Nur Ausnahmefälle, im Anfangsstadium |
| Weiche Speziallinsen | Alternative zu formstabilen Linsen1 |
| Formstabile Linsen | Mittel der Wahl |
| Sklerallinsen (neue Generation) | Alternative bei hoher Empfindlichkeit der Augen1 |
| Duo-System (Huckepacksystem) | Nur in seltenen Fällen2 |
1 Wenn zu viel Druck auf der Hornhaut ist und/oder bei zu hoher Staubempfindlichkeit
Weiche Linsen
[Bearbeiten | Quelltext bearbeiten]Im Anfangsstadium können weiche Linsen evtl. zur Korrektur benutzt werden. Im späteren Stadium ist das aber nicht mehr möglich, da sich die Linsen dem Konus nicht anpassen und so keine Sehverbesserung möglich ist. Hier sollten harte Kontaktlinsen angepasst werden, weil die Tränenflüssigkeit in Verbindung mit der Kontaktlinse die Hornhautunebenheiten ausgleicht. In späteren Stadien kann das aber immer schwerer werden. Bei leichtem oder mittelschweren Keratokonus kann eine Kerasoft IC Kontaktlinse angepasst werden. Diese ist gasdurchläßiger als die herkömmlichen weichen Kontaktlinsen. Wobei es schwer ist diese bei fortgeschrittenem Konus anzupassen.[33]
Weiche Linsen (Huckepack-System)
[Bearbeiten | Quelltext bearbeiten]In einigen Fällen von Unverträglichkeiten im Tragekomfort bei formstabilen Kontaktlinsen können heute spezielle weiche Keratokonus-Kontaktlinsen oder weiche, hochsauerstoffdurchlässige Kontaktlinsen als Trägerlinse (Schutzlinsen) unter der harten Kontaktlinse getragen werden (Huckepack-System).
Formstabile Linsen (Hybridlinsen)
[Bearbeiten | Quelltext bearbeiten]
Formstabile Kontaktlinsen werden meist dann eingesetzt, wenn mit Brille oder weichen Linsen keine ausreichende Korrektur der Sehstärke mehr erreicht werden kann, oder aufgrund von Hornhautverformungen mehrere Bilder gesehen werden.
Je stärker sich die Spitze der Hornhaut, Apex genannt, mit der Zeit vorwölbt, desto stärker muss auch die Kontaktlinse gewölbt sein, denn die Apexspitze darf keinen Druck erfahren. In diesem fortgeschrittenen Stadium werden spezielle Keratokonuslinsen individuell angepasst. Diese müssen meist eine quadrantenspezifische Form aufweisen, um einen guten und stabilen Sitz auf dem Auge aufzuweisen.
Wenn der Konus sehr weit fortgeschritten ist, kann sich jedoch die Abbildungsqualität verschlechtern und der betroffene Patient erreicht keine hundertprozentige Sehschärfe mehr. Verspitzt sich der Kegel weiter, wird schließlich ein Punkt erreicht, bei dem die normale formstabile Kontaktlinse keine effektive Behandlungsmethode mehr darstellt. Sei es, dass sie keinen Halt mehr findet oder keine Sehschärfenverbesserung mehr zu erreichen ist oder es zu Druckstellen der Linse auf der Hornhaut kommt. Das ist schmerzhaft für den Träger und auch nicht ungefährlich, da die Hornhaut aufgrund des Keratokonus bereits verdünnt ist und durch zusätzliche Belastung Schäden auftreten können.
Dann muss eine Hornhauttransplantation in Erwägung gezogen werden. Dazu kommt es allerdings nur in ca. 20 % aller Fälle. Die meisten Patienten kommen ihr Leben lang mit Kontaktlinsen gut zurecht.
Falls auch mit formstabilen Keratokonuslinsen keine ausreichende Sehstärke erreicht werden kann oder diese nicht vertragen werden, können auch Sklerallinsen oder auch Minisklerallinsen angepasst werden. Diese überdecken die gesamte Hornhaut und liegen auf der Lederhaut auf.
Eine weitere Möglichkeit stellen die sogenannten hart-weichen Hybridkontaktlinsen dar. Sie bestehen aus einem harten formstabilen, sauerstoffdurchlässigen Kern und einer weichen Ummantelung. Diese erhöhen den Tragekomfort und reduzieren die Irritationen und Unverträglichkeiten, welche durch die kleinen formstabilen Linsen häufig hervorgerufen werden. Auch der Verlust einer Linse direkt aus dem Auge ist weniger wahrscheinlich.[34]
Sklerallinsen
[Bearbeiten | Quelltext bearbeiten]Spezielle Linsen
[Bearbeiten | Quelltext bearbeiten]Januslinsen haben einen stabilen Kern und einen weichen Außenbereich. Da die Herstellung dieser Kontaktlinsen sehr aufwendig ist, haben sie sich nie richtig durchsetzen können. Diese Linsenart ist wenig gasdurchlässig, so dass die Hornhaut nicht ausreichend mit Sauerstoff versorgt wird. Deshalb sollten diese Linsen nur in speziellen Fällen verwendet werden.
In seltenen Fällen (bei hoher Sensibilität oder stark erhöhter Empfindlichkeit gegen Staub) kommt auch ein „Huckepack-System“ in Frage, bei dem auf eine weiche Linse eine harte Kontaktlinse angepasst wird.
Für Patienten mit einer Unverträglichkeit, oder welche, die in einer staubigen Umgebung Probleme haben, gibt es eine neue Versorgungsmöglichkeit mit HydroCone-Kontaktlinsen (weiche Keratokonus Linsen), um die Sehleistung und den Tragekomfort zu erhöhen.
Operationen
[Bearbeiten | Quelltext bearbeiten]Ziel von operativen Behandlungen ist die visuelle Rehabilitation (Sehverbesserung) und das Aufhalten einer weiteren Krankheitsentwicklung. Als bisher einzig wirksame Methode dafür gilt das Cross-Linking.
CrossLinking (CXL)
[Bearbeiten | Quelltext bearbeiten]Als Entdecker und Entwickler des CrossLinking (Kollagen-Vernetzungshandlung) gilt Augenarzt Theo Seiler[35]. Die Wirksamkeit dieser Therapie, die Keratokonus-Progression zum Stillstand zu bringen und damit eventuell einer Hornhaut-Transplantation aus dem Wege zu gehen, wurde in vielen Studien nachgewiesen. In den letzten 10 Jahren wurden viele verschiedene Vorgehensweisen klinisch getestet und unterschiedliche Behandlungsprotokolle miteinander verglichen. CrossLinking beugt dem Fortschreiten vor und wird mittlerweile auch von den gesetzlichen Krankenkassen im Stadium I und II empfohlen. Es ist die bisher einzige Behandlungsmethode, die das Fortschreiten des Keratokonus nachweislich für einige Jahre zu stoppen vermag. Möglicherweise ist sie sogar dauerhaft wirksam. Bei wenigen Betroffenen hat das Crosslinking kaum Wirkung. Dabei wird durch den von Riboflavin und Ultraviolettstrahlung (UVA) vermittelten Photochemischen Prozess das Kollagen der Hornhaut miteinander vernetzt und so eine stabilisierende Wirkung erreicht.[36][37] Um CXL durchführen zu können, ist eine Hornhautdicke von mindestens 400 µm gefordert. Gegenwärtiger Forschungsgegenstand ist nach der damit erreichten biomechanischen Versteifung der Hornhaut eine topographisch geführte transPRK oder Standard-PRK mit dem Excimerlaser durchzuführen, um damit die Hornhaut wieder in eine optimale optisch wirksamere Kontur zurückzuführen und somit auch eine Verbesserung der Sehschärfe zu erreichen. Auch gibt es Behandlungsprotokolle die zeitgleich in einer Sitzung die topographisch geführte PRK mit anschließendem CrossLinking durchführen. Allerdings scheint das zeitgleiche Zusammenwirken der beiden Behandlungen erheblich stärkere Auswirkungen[38] auf die Transparenz der Hornhaut („Haze“-Bildung) zu haben als eine CrossLinking-Behandlung alleine, deren geringe Gefahr der Haze-Bildung inzwischen in der Literatur belegt ist.[39]
Es ist zweifelhaft ob den nachgewiesenen Erfolgen der Crosslinking-Behandlung Bedenken gerechtfertigt sind, dass die Prognose einer Hornhauttransplantation zu verschlechtern[40].
Intracorneale Implantate
[Bearbeiten | Quelltext bearbeiten]Bevor in sehr fortgeschrittenen Fällen eine Hornhauttransplantation durchgeführt wird, kann durch intracorneale Implantate eine visuelle Rehabilitation erreicht werden und die Notwendigkeit einer Hornhauttransplantation in vielen Fällen hinausgezögert oder überhaupt verhindert werden.
ICRS - Intracorneale Ringsegmente
[Bearbeiten | Quelltext bearbeiten]Ein intrastromales corneales Ringsegment (ICR oder ICRS oder Intacs) ist ein Implantat für die Hornhaut (Cornea) des Auges. Die ICRS finden seit 1996 Anwendung. Der ICR besteht aus zwei kleinen Ringsegmenten, die zusammen einen Innendurchmesser von 6,7 mm haben. Diese durchsichtigen Kunststoffsegmente bestehen aus dem Kunststoff Polymethylmethacrylat (PMMA), demselben Material, das seit ca. 30 Jahren als Linsenersatz beim Grauen Star implantiert wird. Sie werden am Hornhautrand in (intra) die Schichten (Stroma) der Hornhaut eingeschoben, dadurch wird die zentrale Hornhaut abgeflacht. Den dafür notwendigen Tunnelschnitt kann man mit einem stumpfen Messer oder aber auch mit dem Femtosekundenlaser präparieren. Je nach Ringstärke kann somit eine Kurzsichtigkeit zwischen −1 dpt. und −4 dpt. korrigiert werden. Eine Hornhautverkrümmung sollte nicht vorliegen.
Die Operation sollte nur von einem erfahrenen Hornhautchirurgen vorgenommen werden. Das Risiko eines Schnittfehlers kann durch Einsatz des Femtosekundenlasers reduziert werden. Im Fall einer Über- oder Unterkorrektur können die Ringsegmente im Prinzip ausgetauscht oder auch wieder entfernt werden. Die Wunde muss wegen des radiären Einschnittes in der Hornhaut jedoch immer mit einer Naht verschlossen werden. Eine Entfernung bzw. ein Austausch kann daher nur über die Öffnung der bereits vernarbten Wunde geschehen, und diese muss dann anschließend wieder vernäht werden.[41]
Die ICRS werden meist zur visuellen Rehabilitation bei Keratokonus eingesetzt.[42] Allerdings haben die Segmente Enden und können daher häufig zu einer Druckatrophie des Hornhautgewebes als Komplikation führen, die ein „Herauswachsen“ der Segmente aus der Hornhautoberfläche bewirkt, was als „Extrusion“ oder „corneal melting“ bezeichnet wird.[41][43]
CISIS (MyoRing)
[Bearbeiten | Quelltext bearbeiten]Hier wird ein Vollringimplantat (MyoRing) zur Behandlung des Keratokonus in die Hornhaut eingebracht.[44] Die Behandlungsmethode wird CISIS (Corneal Intrastromal Implantation Surgery) genannt und ist seit ca. 2007 zugelassen. Der Ring wird in die Hornhaut zwischen einer vorderen und hinteren Hornhautlamelle in einen virtuellen Spalt (geschlossene Hornhauttasche) eingesetzt. Wegen der lamellären Struktur der Hornhaut ist die Hornhauttasche biomechanisch neutral.[45] Das Verfahren kann mit Crosslinking in einer Behandlungssitzung kombiniert werden.[46][47] Es sind keine Nähte notwendig.[48][49] Die MyoRing Implantation kann in vielen Fällen eine Hornhauttransplantation ersetzen.[50][51] CISIS kann nicht mehr angewandt werden, wenn die Hornhautdicke 350 Mikrometer unterschreitet oder die zentralen K-Werte über 60 Dioptrien liegen.[52] Neueste Ergebnisse zeigen, dass der MyoRing nicht nur zu einer visuellen Rehabilitation führt, sondern wegen seiner geschlossenen Konstruktion auch des Fortschreiten des Keratokonus stoppen kann.[53][54]
Hornhauttransplantation (Keratoplastik)
[Bearbeiten | Quelltext bearbeiten]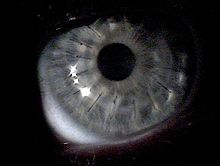
Es kann vorkommen, dass Kontaktlinsen nicht vertragen werden, wenn beispielsweise das Auge nicht genug Tränenflüssigkeit produziert. Dann muss trotz evtl. besserer Korrektur ein operativer Eingriff in Erwägung gezogen werden. Ansonsten wird eine Transplantation erst vorgenommen, wenn mit Kontaktlinsen keine ausreichende Sehschärfe mehr erreicht wird (Visus unter 0,3) oder eine Behandlung mit intra-cornealen Implantaten nicht mehr möglich ist.
Bei einer Keratoplastik wird die Hornhaut ausgestanzt, sodass nur ein kleiner Rand übrig bleibt (Trepanation). Das ausgeschnittene Stück wird durch Spendergewebe ersetzt und durch eine Doppelnaht wasserdicht vernäht. Die Universitäts-Augenklinik Heidelberg setzt als erste in Deutschland ein neues Lasergerät für die Hornhaut-Transplantation ein, mit dem möglicherweise in Zukunft auf die Nähte verzichtet werden kann. Es gibt eine lamelläre (schichtweise) Keratoplastik und eine perforierende (durchgreifende) Keratoplastik.
Ziel muss es immer sein, die eigene Hornhaut so lange wie möglich zu erhalten. Denn der Heilungsprozess nach einer Transplantation kann bis zu zwei Jahre andauern und auch nach einer Transplantation müssen ca. 85–90 % der Betroffenen wieder formstabile, meist spezielle Kontaktlinsen tragen. Von einer vorschnellen Keratoplastik ist abzuraten, evtl. helfen auch unten aufgeführte Alternativen weiter. Diese sind meist aber relativ neu oder es liegen keine Langzeitstudien vor. Zur Frage, in welchen Stadien welche Methode sinnvoll ist, gibt es nur Richtwerte, der behandelnde Arzt kann aber am besten beurteilen, wann welche Art der Keratoplastik weiterhelfen kann.[55]
Alternativen
[Bearbeiten | Quelltext bearbeiten]Neben den genannten Methoden gibt es auch noch andere, die hier nicht weiter ausgeführt werden:
- CKT Cirkuläre Keratotomie
- Verisyse (Artisan) Linse
- Die refraktive Epikeratophakie (EPI) wird im Stadium II und III angewandt[56]
- Keraform-Behandlung
- Bedingt mit einem Excimerlaser.
- Keratoplastik
- Keratotomie
- Mini-asymmetrische radiale Keratotomie (MARK), entworfen von Marco Abbondanza. Stadium I und II.[61][62][63][64]
- Radiale asymmetrische Keratotomie (ARK oder mini ARK), angewandt von Professor Massimo Lombardi. Obwohl diese Behandlung seit 1993 von Lombardi angewandt wird, gibt es bis heute keine wissenschaftlichen Studien.
- Bowman Layer Transplantation, bei fortgeschrittenem Keratokonus[65]
Eine Laserbehandlung (PRK, LASIK) ist kontraindiziert.[66]
Andere Behandlungen wie Hormontherapie, mittels Vitamin-D-Komplexen oder Vitamin E sowie örtlich eingesetztes Cortison haben keine sicheren Erfolge gezeigt.
Prophylaxe (Vorbeugung)
[Bearbeiten | Quelltext bearbeiten]Nach allem was bisher bekannt ist, kann man sich nicht aktiv gegen Keratokonus schützen, da die Krankheit wohl mindestens eine genetische Disposition als zusätzliche Ursache hat.
Allgemein ist es sicher sinnvoll, alles zu vermeiden, was eine hohe Belastung der Augen und der Augenhornhaut darstellt. Das ist insbesondere das „Reiben der Augen“, das seine Ursache wohl in zu wenig Tränenflüssigkeit oder zu häufiger Bildschirmarbeit hat. Der Aufenthalt in Räumen mit staubiger, verrauchter Luft oder Luft aus Klimaanlagen wird von vielen Betroffenen als Belastung empfunden.
Von Vorteil ist es auf jeden Fall, viel zu trinken, sich an der frischen Luft zu bewegen sowie rauchige oder staubige Umgebung zu meiden.
Viele Behandelnde und Betroffene sind auch der Meinung, dass das Tragen von Kontaktlinsen eine ganz erhebliche Belastung für die Hornhaut des Auges ist und so weit wie möglich vermieden werden sollte. Bis heute ist es nicht durch Studien belegt, dass ein Tragen von Kontaktlinsen den Keratokonus fördert.
Kostenübernahme (spezifisch für Deutschland)
[Bearbeiten | Quelltext bearbeiten]Seit der Gesundheitsreform von 2004 hat sich eine Kostenübernahme für Kontaktlinsen seitens der Krankenkassen als schwierig erwiesen. Besonders schwer ist es, eine Übernahme der Kosten im Anfangsstadium zu bekommen, wenn Keratokonuslinsen angepasst werden. Viele der oben genannten Alternativen werden auch nicht bezahlt, da meist Langzeitstudien fehlen oder die Operationsmethoden umstritten sind.
Das aktuelle (2013) Hilfsmittelverzeichnis des GKV-Spitzenverbandes führt unter anderem in der Kategorie „Optisch korrigierende Speziallinsen“ sogenannte Keratokonuslinsen (Einzelanfertigung), deren Kosten bis zu einem vereinbarten Festbetrag unter einer entsprechenden medizinischen Indikation übernommen werden.[67]
Laut einer Pressemitteilung des Gemeinsamen Bundesausschusses, vom 19. Juni 2014[68] wurde geprüft, ob eine Behandlung des Keratokonus mittels UV-Vernetzung mit Riboflavin von der gesetzlichen Krankenversicherung übernommen werden muss.[69][70]
Der Gemeinsame Bundesausschuss (G-BA) beschloss am 19. Juli 2018, die UV-Vernetzung mit Riboflavin bei Keratokonus[71] in den Leistungskatalog der gesetzlichen Krankenversicherung zu übernehmen. Der Beschluss trat nach der Veröffentlichung im Bundesanzeiger am 12. Oktober 2018 in Kraft (BAnz AT 11.10.2018 B2). Am 29. März 2019 legte der Gemeinsame Bewertungsausschuss die Vergütung im EBM fest. Damit können die gesetzlichen Krankenkassen ihren Mitgliedern nun diese Leistung anbieten, mehr als 20 Jahre nach der Erfindung der Methode.
Prognose
[Bearbeiten | Quelltext bearbeiten]
Eine Prognose zum Verlauf des Keratokonus ist nicht möglich, da weder die Ursachen der Krankheit noch die Umwelteinflüsse auf den Verlauf ausreichend untersucht sind.
Bei einigen Betroffenen ist bereits nach kurzer Zeit, zum Beispiel in Wochen oder Monaten nach dem ersten Auftreten der Erkrankung, eine Transplantation notwendig, andere kommen Jahrzehnte oder dauerhaft mit Brille oder Kontaktlinsen zurecht.
Die einzige Beobachtung, die von Betroffenen und Behandlern allgemein bestätigt wird, ist die Erfahrung, dass ein Keratokonus häufig zwischen dem 15. und 20. Lebensjahr beginnt und oft zwischen dem 35. und 45. Lebensjahr zum Stillstand kommen kann.
Probleme
[Bearbeiten | Quelltext bearbeiten]Alltag
[Bearbeiten | Quelltext bearbeiten]Ein großes Problem ist es, dass immer wieder Linsen verloren gehen und nachgekauft bzw. bei den Krankenkassen beantragt werden müssen. Es kommt auch häufig zur Überreizung der Augen (Rötung, extremer Tränenfluss etc.) dann hilft nur noch die Entfernung der Kontaktlinsen. Ob eine Beeinträchtigung des Führens von Kraftfahrzeug vorliegt, muss der Augenarzt abklären.
Die Sehschärfe kann mehrmals am Tag schwanken. Durch diese veränderten Sehbedingungen kann es zu Verschlechterungen in Denk-, Merk- und Konzentrationsprozessen kommen.
Da der Keratokonus und seine Besonderheiten in der Bevölkerung noch relativ unbekannt sind, kann es zu Erklärungsnöten kommen (Warum muss man Kontaktlinsen tragen und keine Brille? Warum sieht man heute schlecht und morgen gut? Warum kann man nicht arbeiten, nur weil die Kontaktlinse verloren gegangen ist? …)
Führerschein
[Bearbeiten | Quelltext bearbeiten]Für den Straßenverkehr ist laut einer Empfehlung der Deutschen Ophthalmologischen Gesellschaft (DOG) und des Berufsverbandes der Augenärzte Deutschlands (BVA) eine jährliche Nachuntersuchung erforderlich. Eine Nachbegutachtung ist aber erst nach zwei Jahren möglich.[72]
Flugschein
[Bearbeiten | Quelltext bearbeiten]Eine Tauglichkeitszeugnis Klasse 2 kann nur durch eine Prüfung durch das Luftfahrt-Bundesamt oder der zuständigen Stelle erteilt werden.[73] Die Mindestanforderungen sind, dass mit einer Sehhilfe die erforderliche Sehleistung erfüllt und eine regelmäßige Kontrolle gemacht wird. Die Intervalle werden dabei von flugmedizinischen Zentren oder flugmedizinischen Sachverständigen festgelegt.[74]
Polizei
[Bearbeiten | Quelltext bearbeiten]In Deutschland gibt es bei der Landespolizei,[75] Bundespolizei,[76] beim SEK, MEK und bei der GSG 9[77] Ausschlusskriterien für Kontaktlinsenträger und bei Augenlaseroperationen in den letzten 12 Monaten. Ein ausreichendes Sehvermögen auch ohne Brille ist erforderlich. Das BKA fordert, dass bei einer Sehhilfe mit dem guten Auge 100 % und beim schlechteren Auge mindestens 80 % gesehen werden muss. Nach einer OP muss 12 Monate gewartet werden und die Hornhautdicke ausreichend sein, um eine Dienstfähigkeit zu bekommen. Eine Weitsichtigkeit über 2,5 dpt. darf nicht vorhanden sein. Die unkorrigierte Sehleistung darf nicht unter 50 % reichen bis man 20 Jahre alt ist oder unter 30 % ab dem 20. Lebensjahr.[78] Weiteres zur Verwendungsfähigkeit kann auch der Polizeidienstvorschrift 300 (PDV 300) – Ärztliche Beurteilung der Polizeidiensttauglichkeit und Polizeidienstfähigkeit (Ausgabe 2012) entnommen werden.
Militär
[Bearbeiten | Quelltext bearbeiten]- Bei der Bundeswehr wird der Keratokonus mit der Gradation VI angegeben (siehe: ZDv 46/1 Anlage 3.1[79] und 3.2[80]). D. h., dass eine Wehrfähigkeit dauerhaft ausgeschlossen werden kann,[81] der Tauglichkeitsgrad ist somit T5 (nicht wehrdienstfähig).
- Zum Österreichischen Bundesheer kann der Soldat nach der Stellung (Musterung) trotz Keratokonus eingezogen werden.[82]
- In der Schweizer Armee ist ein Soldat untauglich, außer die Fehlsichtigkeit wird operiert und nach einem fachärztlichen Zeugnis für gut bescheinigt.[83]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- A. Bochert, J. Berlau, D. Koczan, B. Seitz, H. J. Thiessen, R. Guthoff: Genexpression bei Keratokonus. erster Einsatz von DNA-Microarrays. . In: Der Ophthalmologe. 7/2003, ISSN 0941-293X.
- John W. Chandler, Joe Sugar, Henry F. Edelhauser: Erkrankung des äußeren Auges - Kornea, Konjunktiva, Sklera, Augenlider, Tränensystem. Urban & Fischer, München, 1999, ISBN 3-86126-129-4.
- C. Edmund: Corneal topography and elasticity in normal and keratoconic eyes: A methodological study concerning the pathogenicity of keratoconus. In: Acta Ophthalmol Suppl. Band 193, 1989, S. 1–36. (englisch).
- Nathan Efron: Cornea. Butterworth Heinemann, 2001, ISBN 0-7506-4798-1 (englisch).
- R. Eschmann, D. Roth-Muff: Der Keratokonus im subklinischen Stadium. In: NOJ. 2/1994.
- Achim Langenbucher, Gabriele C. Gusek-Schneider, Murat M. Kus, Berthold Seitz: Topographiegestützte Berechnung der Keratokonus-Dimensionen. In: Augenheilkunde. 214/1999, S. 372–377.
- James N. Parker, Philip M. Parker: The Official Patient’s Sourcebook on Keratoconus. Icon Health, 2002, ISBN 0-597-83187-4. (englisch).
- Anne Christina Preclik: Langzeitverlauf nach perforierender Keratoplastik bei Keratokonus – Auswirkungen von präoperativem Visus und Astigmatismus auf die funktionellen Ergebnisse. Dissertation. Friedrich-Alexander-Universität, Erlangen-Nürnberg 2010.
- O. Stachs, T. Gerber, D. Koczan, U. Sommer, H.-J. Thiessen, R. Guthoff: Die Struktur der Extrazellulärmatrix bei Keratokonus. In: Der Ophthalmologe. 09/2002 und 04/2004.
- Theo Seiler: Refraktive Chirurgie der Hornhaut. Georg Thieme Verlag, 2000, ISBN 3-13-118071-4.
- Karl Velhagen: Der Augenarzt. Band 3,2: (Tränenorgane, Augenlider, Orbita, Bindehaut, Hornhaut, Lederhaut, Linse, Glaskörper, Kammerwasser) 1975.
- Irina Wahrendorf: Lebenserschwerung und Lebensgestaltung von Menschen mit der Sehschädigung Keratokonus. www.wahrendorf-kontaktlinsen.de, 2004.
- Karla Zadnik, Joseph T. Barr: Diagnosis Contact Lens Prescribing, and Care of the Keratoconus Patient: Clinical Practice in Contact Lenses. Butterworth-Heinemann, 1999, ISBN 0-7506-9676-1. (englisch)
- Karla Zadnik, Joseph T. Barr: Keratoconus - A Medical Dictionary, Bibliography, and Annotated Research Guide to Internet References. ICON Health Publications, 1999, ISBN 0-497-00623-5. (englisch)
- Centre for Contact Lens Research, School of Optometry, University of Waterloo, Canada: Die Korrektion des Keratokonus mit formstabilen Kontaktlinsen. (Anhang (PDF) )
- Klinische Monatsblätter für Augenheilkunde. Band 211, Heft 3, September 1997.
- Neue Behandlungsmöglichkeiten des Keratokonus. (PDF; 792 kB)
- Der Keratokonus - Eine Informationsschrift für Interessierte und Betroffene. (PDF; 7,1 MB)
- Keratokonus. (PDF; 306 kB)
- Medizin: Kunststoffringe gegen Keratokonus. Netnews, 29. August 2005
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Global Keratoconus Foundation (englisch)
- National Keratoconus Foundation (multilingual)
- About Keratoconus Eye Disease and Hybrid Contact Lens. Seite zu Keratokonus des Keratokonus-Hybridlinsenherstellers Synergeye (englisch)
- About Keratoconus Eye and Soft Keratoconus Contact Lens. (PDF; 73 kB) Seite zu Keratokonus des Speziallinsen Herstellers SwissLens
- Atlas of Ophthalmology Bilder der verschiedenen Keratokonus-Stadien
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b P. Caroline, M. Andre, B. Kinoshita, J. Choo: Etiology, Diagnosis, and Management of Keratoconus: New Thoughts and New Understandings. In: Pacific University College of Optometry. Archiviert vom (nicht mehr online verfügbar) am 7. Januar 2009; abgerufen am 15. Dezember 2008.
- ↑ J. Nottingham: Practical observations on conical cornea: and on the short sight, and other defects of vision connected with it. J. Churchill, London 1854.
- ↑ W. Bowman: On conical cornea and its treatment by operation. In: Ophthalmic Hosp Rep and J R Lond Ophthalmic Hosp. Band 9, 1859, S. 157.
- ↑ J. F. Horner: Zur Behandlung des Keratoconus. In: Klinische Monatsblätter für Augenheilkunde. 1869.
- ↑ a b R. Rochels: Akuter Keratokonus beim Down-Syndrom. In: Albrecht von Graefes Archiv für Klinische und Experimentelle Ophthalmologie. Band 212, 1979, S. 117–128, doi:10.1007/BF00587603.
- ↑ W. Messikommer, Universitäts-Augenklinik Zürich: Akuter Keratokonus bei einem Kinde. ( des vom 27. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Ophthalmologica. Band 123, 1952, S. 326–329.
- ↑ Grace A. Borchert, Jin Tan: Munson's sign in keratoconus. New England Journal of Medicine 2023, Band 389, Ausgabe 10 vom 7. September 2023, Seite 939, DOI:10.1056/NEJMicm2300297
- ↑ A. Daxer, P. Fratzl: Collagen fibril orientation in the human corneal stroma and its implications in keratoconus. In: Invest Ophthalmol Vis Sci., 38, 1997, S. 121–129.
- ↑ Keratoconus 1; KTCN1. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ A. Daxer: Biomechanics of the cornea. In: International Journal of Keratoconus and Ectatic Corneal Diseases, Band 3, 2014, S. 57–62.
- ↑ Klinische Klassifikation des Keratokonus nach Dr. Krumeich.
- ↑ Klinisches Monatsblatt Augenheilkunde. Band 211, 1997, S. 94–100.
- ↑ Journal of Refractive Surgery. September 2008.
- ↑ B. Seitz: Keratokonus und Schilddrüse. In: Ophthalmologische Nachrichten. 09.2012, DOG Kongressausgabe 1, 22
- ↑ B. Seitz: Keratokonus Keratometerwerte und Schilddrüsendysfunktion bei Keratokonus. (Seite nicht mehr abrufbar, festgestellt im Dezember 2018. Suche in Webarchiven) (PDF; 262 kB) 2012.
- ↑ P. Biro, D. A. Vagts, U. Emmig, T. Pasch: Anästhesie bei seltenen Erkrankungen. Springer-Verlag, 2010, ISBN 978-3-642-01046-0. (books.google.de)
- ↑ C. Grünauer-Kloevekorn, G. Duncker: Keratokonus: Epidemiologie, RisikofaktorenundDiagnostik. In: Klinische Monatsblätter für Augenheilkunde. Band 223, 2006, S. 493–502, doi:10.1055/s-2005-859021.
- ↑ Wikibooks: Sammlung Medizin:Auge
- ↑ Keratokonus - das Rätsel der Pathogenese. (PDF) In: Klinische Monatsblätter für Augenheilkunde, 1986, S. 365 f.
- ↑ Stefan Rau, Gernot Duncker: Keratokonus bei Mulvihill-Smith-Syndrom. In: Klinische Monatsblätter für Augenheilkunde. Band 205, 1994, S. 44–46, doi:10.1055/s-2008-1045490.
- ↑ EyeWiki: Urrets-Zavalia Syndrome
- ↑ E. D. Donnenfeld, H. D. Perry, R. P. Gibralter, H. J. Ingraham, I. J. Udell: Keratoconus associated with floppy eyelid syndrome. In: Ophthalmology, Band 98, Nummer 11, November 1991, S. 1674–1678. PMID 1800928.
- ↑ Karsten Bronk: Die Anpassung formstabiler Kontaktlinsen. (PDF; 380 kB)
- ↑ Katrin Warken: Messverfahren zur Bestimmung der peripheren Hornhautradien. (PDF; 334 kB). (= Galifa Augenblick. 05/2009).
- ↑ Topographie - the whole cornea (Seite nicht mehr abrufbar, festgestellt im Dezember 2018. Suche in Webarchiven)
- ↑ Michael W. Belin, Renato Ambrósio Jr., Andreas Steinmueller: Das Prinzip hinter der Keratokonus-Früherkennung nach Belin/Ambrosio. ( des vom 19. März 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF) 2009.
- ↑ Help Keratokonus: Orbscan, Keratoconus ( vom 24. September 2012 im Internet Archive)
- ↑ Subclinical Keratoconus
- ↑ Lisa Müßig: Screeningmethoden bei Keratokonus. (PDF) 2014.
- ↑ Z. Gatzioufas · B. Seitz: Neues zur Biomechanik der Kornea beim Keratokonus. (PDF; 931 kB) In: Ophthalmologe, 2013, 110, S. 810–817.
- ↑ Corneale Wellenfrontanalyse zur Unterscheidung zwischen Keratokonus und pellucider marginaler Degeneration (PDF; 165 kB)
- ↑ Nisha Garg, Ta C. Chang, Bibiana Jin Reiser, Kara M. Cavuoto: A novel characterization of posterior keratoconus using anterior segment optical coherence tomography in an infant: a case report. In: BMC Ophthalmol. Nr. 15, 4. November 2015, S. 158, doi:10.1186/s12886-015-0139-3, PMC 4634598 (freier Volltext).
- ↑ Varsha M Rathi, Preeji S Mandathara, Srikanth Dumpati: Contact lens in keratoconus. In: Indian J Ophthalmol. Band 61, Nr. 8, 2013, S. 410–415, doi:10.4103/0301-4738.116066, PMC 4631016 (freier Volltext).
- ↑ Centre for Contact Lens Research, School of Optometry, University of Waterloo, Canada: Die Korrektion des Keratokonus mit formstabilen Kontaktlinsen ( vom 7. September 2012 im Internet Archive).
- ↑ G. Wollensak, E. Spoerl, T. Seiler: Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. In: Am J Ophthalmol. Band 135, Nr. 5, 2003, S. 620–627.
- ↑ Lutz Bloomberg: Kollagenvernetzung mit Riboflavin und UVA Licht statt Hornhauttransplantation. (PDF; 783 kB) 2007.
- ↑ UV-Crosslinking: Hornhautvernetzung mit UVA-Bestrahlung und Riboflavin. ( des vom 16. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Renata L. B. Morales u. a.: Haze ans Visual Acuity Loss After Sequential Photorefractive Keratetomy and Corneal Cross-linking for Keratokonus. In: ISRS (Hrsg.): J Refract Surg. Band 35, Nr. 2. SLACK Incorporated, Thorofare NJ 2019, S. 109–114.
- ↑ T. Koller, M. Mrochen, T. Seiler: Complication and failure rates after corneal cross linking. In: ASCRS (Hrsg.): J Cataract Refract Surg. Band 35. Elsevier, 2009, ISSN 0886-3350.
- ↑ J. H. Krumeich, B. Brand-Saberi, V. Chankiewitz, E. Chankiewitz, R. Guthoff: Induction of neoplasia after deep anterior lamellar keratoplasty in a CXL-treated cornea. In: Cornea. Band 33, Nummer 3, März 2014, S. 313–316, doi:10.1097/ICO.0000000000000047. PMID 24452218.
- ↑ a b C. Ferrer u. a.: Causes of intrastromal corneal ring segment explantation: clinicopathologic correlation analysis. In: Journal of Cataract and Refractive Surgery. Band 36, 2010, S. 970–977.
- ↑ J. Colin u. a.: Correcting keratoconus with intracorneal rings. In: Journal of Cataract and Refractive Surgery. Band 26, 2000, S. 1117–1122.
- ↑ K. Jaddidi u. a.: Complications of intrastromal corneal ring implantation (Keraring 355°) using a Femtosecond Laser for Channel creation. In: International Journal of Keratoconus and Ectatic Corneal Diseases. Band 3, 2014, S. 53–56.
- ↑ A. Daxer, H. Mahmoud, R. S. Venkateswaran: Intracorneal continuous ring implantation for keratoconus: One year follow-up. In: J Cataract Refract Surg. 36, 2010, S. 1296–1302.
- ↑ A. Daxer: Adjustable Intracorneal Ring in a Lamellar Pocket for Keratoconus. In: Journal of Refractive Surgery. Band 26, 2010, S. 217–221.
- ↑ A. Daxer, H. Mahmoud, R. S. Venkateswaran: Corneal Crosslinking and Visual Rehabilitation in Keratoconus in One Session Without Epithelial Debridement: New Technique. In: Cornea. Band 29, 2010, S. 1176–1179.
- ↑ Pavel Studeny, Deli Krizova, Zbynek Stranak: Clinical Outcomes after Complete Intracorneal Ring Implantation and Corneal Collagen Cross-Linking in an Intrastromal Pocket in One Session for Keratoconus. In: Journal of Ophthalmology. 2014, S. 1, doi:10.1155/2014/568128. PMC 4172981 (freier Volltext)
- ↑ H. Mahmoud, R. S. Venkateswaran, A. Daxer: Implantation of a complete ring in an intracorneal pocket for keratoconus. In: Journal of Refractive Surgery. Band 27, 2011, S. 63–68.
- ↑ A. Daxer: MyoRing for Central end Noncentral Keratoconus. In: International Journal of Keratoconus and Ectatic Corneal Diseases. Band 1, 2012, S. 117–119.
- ↑ M. Jabbarvand, A. Salamatrad, H. Hashemian, M. Khodaparast: Continuous corneal intrastromal ring implantation for treatment in keratoconus in an Iranian population. In: American Journal of Ophthalmology. Band 155, 2013, S. 837–842.
- ↑ A. Daxer: Corneal thickness after MyoRing implantation for keratoconus. In: International Journal of Keratoconus and Ectatic Corneal Diseases. Band 3, 2014, S. 15–19.
- ↑ MyoRing Behandlung des Keratokonus. cisis.com
- ↑ A. Daxer, A. Ettl, R. Hörantner: Long-Term Results of MyoRing Treatment of Keratoconus. In: Journal of Optometry. Band 10, Nr. 2, 2017, S. 123–129.
- ↑ A. Prangl, A. Ettl, R. Hörantner, A. Daxer: Individual long-term visual stability after MyoRing treatment of keratoconus. In: International Journal of Keratoconus and Ectatic Corneal Diseases. Band 5, 2015, S. 53–56.
- ↑ J. Krumeich, J. Daniel: Lebend-Epikeratophakie und Tiefe Lamelläre Keratoplastik zur Stadiengerechten Chirurgischen Behandlung des Keratokonus (KK). In: Augenheilkunde. Band 18, 1997, S. 351–362.
- ↑ Epikeratophakie. Laser Vision Center
- ↑ Verschiedene Techniken der Keratoplastik. ( vom 24. Februar 2014 im Internet Archive) Universitätsklinikum Düsseldorf
- ↑ Keratoplastik: Indikationen und Techniken ( des vom 21. Februar 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF)
- ↑ Tiefe anteriore lamelläre Keratoplastik (DALK) mittels "big bubble"-Technik zur Behandlung des fortgeschrittenen Keratoconus. In: Augenheilkunde, 1. September 2011.
- ↑ Perspektiven der tiefen anterioren lamellären Keratoplastik ( vom 22. Februar 2014 im Internet Archive) In: Der Ophthalmologe, 2011.
- ↑ M. Lombardi, M. Abbondanza: Asymmetric radial keratotomy for the correction of keratoconus. In: Journal of Refractive Surgery. Band 13, Nummer 3, 1997 Mai – Juni, S. 302–307. PMID 9183763.
- ↑ Mini cheratomia radiale asimmetrica (mini A.R.K.) per la correzione chirurgica del cheratocono in fase iniziale, nell'ipermetropia e nelle miopie lievi. ( vom 20. Dezember 2013 im Internet Archive) centronazionalelaser.com
- ↑ Felicita Donalisio: La curva pericolosa della cornea. ilgiornale.it
- ↑ M. Kohlhaas, J. Draeger, A. Böhm, M. Lombardi, M. Abbondanza, M. Zuppardo, M. Görne: Zur Aesthesiometrie der Hornhaut nach refraktiver Hornhautchirurgie. In: Klinische Monatsblätter für Augenheilkunde, Band 201, 1992, S. 221, doi:10.1055/s-2008-1045898.
- ↑ Jack Parker: Bowman layer transplantation effective in advanced keratoconus. In: Ophtalmology Times. 1. November 2016, archiviert vom (nicht mehr online verfügbar) am 1. Mai 2017; abgerufen am 9. Mai 2017.
- ↑ Keratokonus und verwandte Veränderungen Abgerufen: 18. August 2013.
- ↑ Hilfsmittelverzeichnis des GKV-Spitzenverbandes
- ↑ Gemeinsamer Bundesausschuss, 19. Juni 2014: Hornhauterkrankung des Auges: G-BA prüft Behandlungsmethode, abgerufen am 12. Juni 2015.
- ↑ Einleitung des Beratungsverfahrens: Bewertung der UV-Vernetzung mit Riboflavin bei Keratokonus gemäß § 135 Absatz 1 SGB V. Gemeinsamer Bundesausschuss, 19. Juni 2014; abgerufen am 12. Juni 2015.
- ↑ [N15-05] UV-Vernetzung mit Riboflavin bei Keratokonus. IQWiG, 5. Februar 2016; abgerufen am 27. März 2016.
- ↑ Richtlinie Methoden vertragsärztliche Versorgung: UV-Vernetzung mit Riboflavin bei Keratokonus - Gemeinsamer Bundesausschuss. Gemeinsamer Bundesausschuss, abgerufen am 11. August 2018.
- ↑ Fahreignungsbegutachtung für den Straßenverkehr 2013. ( vom 23. November 2015 im Internet Archive; PDF) DOG
- ↑ Die 98 Untauglichkeitskriterien
- ↑ Flugverkehr JAR-FCL (PDF)
- ↑ Untersuchung auf Polizeidiensttauglichkeit. Abgerufen: 2. Mai 2017.
- ↑ Informationsblatt des Polizeiärztlichen Dienstes der Bundespolizei für Bewerberinnen/Bewerber über die Polizeiärztliche Untersuchung. (PDF) Bundespolizeiakademie; abgerufen: 2. Mai 2017.
- ↑ Polizeiausbildung - Voraussetzungen zur Einstellung. sek-einsatz.de; abgerufen: 2. Mai 2017.
- ↑ Informationsblatt des Ärztlichen Dienstes des Bundeskriminalamtes für Bewerberinnen und Bewerber für den Polizeivollzugsdienst des Bundes. (PDF) BKA; abgerufen: 2. Mai 2017.
- ↑ Tabelle der Gesundheitsnummern und -ziffern (für Wehr- und Zivildienstpflichtige) (PDF; 354 kB)
- ↑ Tabelle der Gesundheitsnummern und -ziffern (ausschließlich für Zeit- und BerufssoldatInnen) (PDF; 373 kB)
- ↑ ZDv 46/1 Anlage 1/1: Begriffsbestimmungen, Erläuterungen (PDF)
- ↑ Bundeskanzleramt, 24. Februar 2005: VwGH 2003/11/0308.
- ↑ Zivilarzt – Militärdienst III (PDF)