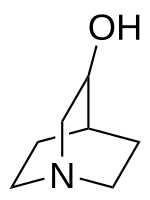
3-Chinuclidinol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Chinuclidinol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H13NO | ||||||||||||||||||
| Kurzbeschreibung |
beiger geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 127,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
221–223 °C[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die chemische Verbindung 3-Chinuclidinol (englisch 3-Quinuclidinol) ist ein stickstoffhaltiger bicyclischer Alkohol mit dem Chinuclidin-Gerüst. Der (sekundäre) Alkohol diente als Edukt für die Herstellung zahlreicher Ester, die pharmakologisch wirksam sind.
Herstellung
[Bearbeiten | Quelltext bearbeiten]3-Chinuclidinol wurde um 1950 in den Laboratorien der US-amerikanischen Tochter des Pharma-Konzerns Hoffmann-La Roche von Leo Sternbach und S. Kaiser durch Reduktion des Ketons 3-Chinuclidinon hergestellt, z. B. durch Hydrierung mit Raney-Nickel als Katalysator. Im Labor kann die Reduktion auch mit Lithiumaluminiumhydrid in Diethylether durchgeführt werden. Auch aus dem Hydrochlorid oder Acetat des 3-Chinuclidinons – der Vorstufe der freien Base – kann durch katalytische Hydrierung über Platin(IV)oxid der bicyclische Alkohol gewonnen werden. Bei der Reduktion des achiralen Ketons (Spiegelsymmetrie) wurde ein Racemat gebildet; die Trennung des racemischen Gemischs gelang durch Umsetzung mit dem chiralen Hilfsreagens Camphersulfonsäure. Die so erzeugten Diastereomere wurden durch fraktionierende Kristallisation getrennt. Das die Ebene des polarisierten Lichts „nach links“ drehende, d. h. (−)-3-Chinuclidinol, wurde isoliert. Das (+)-Enantiomer wurde auf anderem Weg gewonnen.[2][4]
Stereochemie
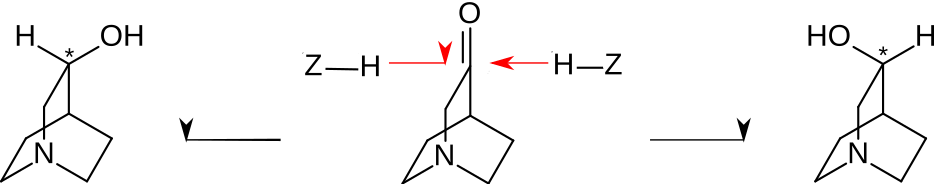
[Bearbeiten | Quelltext bearbeiten]Das Molekül 3-Chinuclidinon weist enantiotope Flächen/Seiten auf. Wasserstoff-liefernde Agenzien (im Bild symbolisiert als Z-H) können an beiden Seiten assoziiert werden, was letztlich zur Addition der Wasserstoffatome an die Carbonylgruppe führt. Dadurch wird ein Chiralitätszentrum erzeugt (im Bild mit Stern markiert). Es können zwei enantiomere Alkohole mit (R)- oder (S)-Konfiguration gebildet werden. Links: (R)-Konfiguration, rechts: (S)-Konfiguration.
Das „links drehende“ (−)-3-Chinuclidinol ist (R)-konfiguriert, also (R)-(−)-3-Chinuclidinol, was durch verschiedene Untersuchungen bewiesen wurde. Es ist pharmakologisch interessanter als sein Enantiomer und wird als chiraler Baustein zur Herstellung verschiedener antimuskarinischer Wirkstoffe benutzt.
In neuerer Zeit wurde versucht, aus dem Keton durch enantioselektive Methoden der Reduktion („asymmetrische Hydrierung“) gezielt das (R)-Enantiomer herzustellen. Um gezielt eines der Enantiomeren synthetisieren zu können, muss das 3-Chinuclidinon mit chiralen Reagenzien umgesetzt werden. In der Regel entsteht dabei ein Gemisch der (R)- und (S)-Moleküle/Verbindungen (enantioselektive Synthese). Anstelle des Mengenverhältnisses der Enantiomeren (R)/(S) oder (S)/(R) berechnet man in der Stereochemie den Enantiomerenüberschuss (enantiomeric excess, abgekürzt ee).
Im Falle der Chinuclidinole wurde als chirales Hilfsreagens (Auxiliar) mit bestem Erfolg die von Ryōji Noyori und Mitarbeitern entwickelten Ruthenium-Komplexe eingesetzt. So wurden asymmetrische Hydrierungen mit einem ee von bis zu 89 % in Ausbeuten bis zu 96 % erreicht.[5]
Bekanntlich sind die meisten Enzyme chirale Katalysatoren. So gelangen in biotechnologischen Verfahren mit verschiedenen Oxidoreduktasen (hoch)stereoselektive Hydrierungen.[6][7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Aus 3-Chinuclidinol wurden zahlreiche Ester synthetisiert, im einfachsten Fall das Acetat 3-Chinuclidinylacetat bzw. 3-Acetoxychinuclidin. Die Ester wurden wegen ihrer krampflösenden (antispasmodischen) Wirkung als Parasympatholytika pharmakologisch untersucht.[8][9] Die anticholinerge Wirkung der Ester beruht auf der Interaktion mit dem (muskarinischen) Acetylcholin-Rezeptor.
Literatur
[Bearbeiten | Quelltext bearbeiten]- The Merck Index. 11. Auflage. Eintrag No. 8110, S. 1287.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt 3-Quinuclidinol, 98+% bei Alfa Aesar, abgerufen am 14. Februar 2021 (Seite nicht mehr abrufbar).
- ↑ a b L. H. Sternbach, S. Kaiser: Antispasmodics. I. Bicyclic Basic Alcohols*. In: Journal of the American Chemical Society. Band 74, Nr. 9, 1. Mai 1952, S. 2215–2218, doi:10.1021/ja01129a019.
- ↑ 3-Quinuclidinol: 3-Quinuclidinol, abgerufen am 14. Februar 2021
- ↑ A. Kalir E. Sali E. Shirin: Preparation of (+)‐3‐Quinuclidinol. In: Israel Journal of Chemistry. Volume9, Issue2, 1971, S. 267–268, doi:10.1002/ijch.197100040.
- ↑ Patent US8212037B2: Veröffentlicht am 3. Juli 2012, Erfinder: R. Noyori, T. Okuma, K. Tsutsumi, N Utsumi et al..
- ↑ A. Uzura, F. Nomoto, A. Sakoda et al. Stereoselective synthesis of (R)-3-quinuclidinol through asymmetric reduction of 3-quinuclidinone with 3-quinuclidinone reductase of Rhodotorula rubra. In: Applied Microbiol Biotechnology. Bd. 83, 2009, S. 617–626, doi:10.1007/s00253-009-1902-2.
- ↑ Wen-Xia Zhang, Guo-Chao Xu, Lei Huang, Jiang Pan, Hui-Lei Yu, Jian-He Xu, Highly Efficient Synthesis of (R)-3-Quinuclidinol in a Space–Time Yield of 916 g L–1 d–1 Using a New Bacterial Reductase ArQR. In: Organic Letters. Bd. 15, Heft 19, 2013, S. 4917–4919, doi:10.1021/ol402269k.
- ↑ L. H. Sternbach, S. Kaiser: Antispasmodics. II. Esters of Basic Bicyclic Alcohols*. In: Journal of the American Chemical Society. Band 74, Nr. 9, 1. Mai 1952, S. 2219–2221, doi:10.1021/ja01129a020.
- ↑ Patent US2648667: Esters of 1-Azabicycloalkanols. Angemeldet am 18. April 1951, Anmelder: Hoffmann-La Roche Inc., Nutley, New Jersey, Erfinder: Leo Henryk Sternbach.