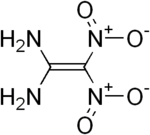
Diaminodinitroethylen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diaminodinitroethylen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H4N4O4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 148,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
ab 180 °C Zersetzung[1] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, wenig löslich in Acetonitril und Cyclohexanon, löslich in DMSO, Dimethylformamid und N-Methylpyrrolidon[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Für Diaminodinitroethylen können drei isomere Strukturen formuliert werden. Von den möglichen Isomeren 1,1-Diamino-2,2-dinitroethylen (1), trans-1,2-Diamino-1,2-dinitroethylen (2) und cis-1,2-Diamino-1,2-dinitroethylen (3) ist bisher nur Ersteres synthetisch zugänglich.[1]
1,1-Diamino-2,2-dinitroethylen (FOX-7 oder DADE) ist eine energiereiche chemische Verbindung, die als Basis für unempfindliche und zugleich hochbrisante Sprengstoffe geeignet ist. Für die beiden 1,2-Diamino-1,2-dinitroethylen-Isomere gibt es bisher nur theoretische, quantenchemische Berechnungen.[4] Eine reale Herstellung und Charakterisierung der beiden Verbindungen steht noch aus.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Synthese von 1,1-Diamino-2,2-dinitroethylen-Derivaten wurde 1992 beschrieben. Ausgehend vom 1,1-Diiodo-2,2-dinitroethylen können durch den Umsatz mit Alkylaminen die entsprechenden 1,1-Dialkylamino-2,2-dinitroethylen-Verbindungen erhalten werden. Die Umsetzung mit Ammoniak ergibt als Reaktionsprodukt das Ammoniumsalz von Cyanodinitromethan und somit nicht die Basisverbindung 1,1-Diamino-2,2-dinitroethylen.[5] 1,1-Diamino-2,2-dinitroethylen (FOX-7) wurde erstmals 1998 am FOI (Swedish Defence Research Agency) synthetisiert.[6] Mit einer Ausbeute < 10 % ist dieser Syntheseweg trotz des billigen Ausgangsstoffes 2-Methylimidazol kommerziell nicht sinnvoll.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Herstellung von Diaminodinitroethylen wird nur in kleinen Ansatzgrößen durchgeführt, woraus ein relativ hoher Preis für die Verbindung resultiert. Eine optimierte Synthese mit einer Ausbeute >90 % geht vom 2,6-Dihydroxy-4-methylpyrimidin aus, welches durch Nitrierung in Nitriersäure zu einem Tetranitrozwischenprodukt umgesetzt wird. Das Zwischenprodukt wird danach hydrolytisch zur Zielverbindung, Dinitromethan und Kohlenstoffdioxid gespalten.[7] Die Ausgangsverbindung 2,6-Dihydroxy-4-methylpyrimidin ist durch die Cyclisierung von Acetamidinhydrochlorid mit Malonsäurediethylester in Gegenwart von Natrium und Ethanol zugänglich.[8]
Eine Umsatzkontrolle ist hier über eine flüssigchromatographische Auftrennung über spezielle Graphitsäulen möglich.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,1-Diamino-2,2-dinitroethylen bildet gelbe Kristalle.[10] Die Verbindung zeigt ein polymorphes Verhalten.[11] Bei Raumtemperatur liegt die α-Form vor, die sich beim Aufheizen bei 114 °C mit einer Umwandlungsenthalpie von 18 J·g−1 bzw. 2,66 kJ·mol−1 in die β-Form umwandelt. Dieser Phasenübergang ist reversibel. Eine weitere Umwandlung zur γ-Form wird bei 173 °C beobachtet. Die γ-Form ist metastabil und wandelt sich beim Abkühlen nur langsam und unvollständig in die Tieftemperaturform α um.[12] Für die Verbindung kann kein Schmelzpunkt gefunden werden, da DSC-Messungen schon ab 180 °C eine stark exotherme Zersetzungsreaktion anzeigen.[1] Einkristalluntersuchungen an aus NMP/Wasser kristallisierter α-Form ergaben eine monokline Kristallstruktur.[13] Die Anwesenheit von elektronendrückenden und elektronenziehenden Gruppen im Molekül führt zu veränderten Bindungslängen. Die Bindungslänge der Kohlenstoff-Kohlenstoff-Bindung liegt mit 145,6 pm zwischen den typischen Bindungslängen für eine Einfachbindung mit 154 pm bzw. Doppelbindung mit 134 pm.[14] Die Verbindung besitzt somit keinen reine Doppelbindungsstruktur. Es können zwei Resonanzstrukturen formuliert werden, wobei die polare Iminstruktur eher vorliegt.[15] Dies bestätigt sich auch an den beobachteten chemischen Eigenschaften wie z. B. bei elektrophilen Additionen.
Im Molekül existieren zwei starke intramolekulare Wasserstoffbrückenbindungen zwischen den NH- und NO-Funktionen. Daraus resultiert eine planare Grundstrukturdes Moleküls. Im Kristallgitter bildet sich auf Grund intermolekulerer Wasserstoffbrücken eine wellenförmige Schichtstruktur aus.[14] Die Kristallstruktur der β-Form ist orthorhombisch.[14] Die γ-Form zeigt ein monoklines Kristallgitter mit der Raumgruppe P21/n.[16]
Die Verbindung ist in Wasser praktisch unlöslich. In andern Lösungsmitteln wie Aceton, Ethylacetat oder Acetonitril ist die Löslichkeit mit <0,5 g/100 ml gering.[1] Bessere Löslichkeiten werden in Dimethylformamid mit 21 g/100 ml, in N-Methyl-2-pyrrolidon mit 32 g/100 ml und in Dimethylsulfoxid mit 45 g/100 ml beobachtet.[1]
Die molare Bildungsenthalpie beträgt ΔfH0 = −130 kJ/mol.[1] Die NMR-Spektren der Verbindung stellen sich recht einfach dar. Das 1H-NMR-Spektrum zeigt nur bei 8,77 ppm einen breiten Peak resultierend aus den NH-Protonen.[6] Im 13C-NMR-Spektrum findet man zwei Peaks bei 128,5 ppm für das nitrogruppensubstituierte Kohlenstoffatom sowie bei 158,8 ppm für das die Aminogruppen tragende Kohlenstoffatom.[6]
Thermische Stabilität und Explosionsfähigkeit
[Bearbeiten | Quelltext bearbeiten]1,1-Diamino-2,2-dinitroethylen zeigt beim Erhitzen keinen Schmelzpunkt. Bei thermoanalytischen Messungen wird ab 180 °C eine zweistufige Zersetzung mit einer Zersetzungswärme von −1427 J/g beobachtet.[1][11] Der Zersetzungsmechanismus wurde hinsichtlich auftretender Zwischenverbindungen theoretisch betrachtet und führt zu den finalen Produkten Kohlenmonoxid, Stickstoff und Wasser.[17]
Wichtige Explosionskennzahlen wie die Explosionswärme, die Detonationsgeschwindigkeit oder der Detonationsdruck wurden über verschiedene Rechenmethoden abgeschätzt bzw. mittels verschiedener Messmethoden experimentell bestimmt.[1][2][18] Die berechneten Werte liegen für die Explosionswärme zwischen 4442 J·g−1 und 4884 J·g−1, für die Detonationsgeschwindigkeit zwischen 8453 m·s−1 und 8869 m·s−1[1][2][18] und für den Detonationsdruck zwischen 29,3 GPa und 34,0 GPa.[1][18] Die experimentell bestimmten Werte betragen für die Detonationsenergie 4860 J·g−1, die Detonationsgeschwindigkeit zwischen 8325 m·s−1 und 8405 m·s−1 und dem Detonationsdruck 28,4 GPa.[18] Der Grenzdurchmesser im Stahlhülsentest wurde mit 6 mm bestimmt.[19][20] Die Verbindung ist mit einer Schlagenergie von 11 – 40 Nm schlagempfindlich.[2][18] Die Schlagempfindlichkeit hängt von der Korngrößenverteilung des geprüften Materials ab.[18] Bis zu einer Reibkraft von 353 N konnte keine Reibempfindlichkeit festgestellt werden.[1][18] Die Verbindung lässt sich durch Laserbestrahlung entzünden. Dieser Effekt kann durch den Zusatz von bis zu 5 % Aktivkohle verstärkt werden.[21]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Verbindung besitzt acide Eigenschaften. In Gegenwart von Basen kann eine Deprotonierung erfolgen. Der pKa-Wert liegt bei etwa 10,6.[1] Bei einer Umsetzung mit Kalilauge bei niedrigen Temperaturen lässt sich das Kaliumsalz als weißer, kristalliner Feststoff isolieren. Das Erhitzen auf 70 °C mit Kalilauge führt zu einer basischen Hydrolyse, wobei das Kaliumsalz des Dinitromethans und Harnstoff gebildet werden.[1]
Auf Grund der hohen Polaritätsunterschiede im Molekül ergeben sich interessante Aspekte für chemische Umsetzungen. Die Verbindung kann in Gegenwart von Acetanhydrid oder Trifluoressigsäureanhydrid mittels Salpetersäure weiter nitriert werden.[22] Die resultierende Tetranitroverbindung ist thermisch instabil. Eine Zersetzung ist schon ab Raumtemperatur relevant. Bei −20 °C kann die Verbindung etwa eine Woche gelagert werden.[22] Eine Zersetzung in ammoniakalischer Acetonitril-Lösung ergibt das Ammoniumsalz des Trinitromethans und Nitroguanidin.[22]
Die Halogenierung mit N-Bromsuccinimid oder N-Chlorsuccinimid erfolgt analog wie die Nitrierung am die geminalen Nitrogruppen tragenden C-Atom und an einer Aminogruppe.[22] Die Oxidation mit 30%igen Wasserstoffperoxid in Schwefelsäure oder mit Trifluoressigsäure führt unter Freisetzung von Salpetriger Säure und Distickstofftrioxid zur Diaminoessigsäure.[15]
1,1-Diamino-2,2-dinitroethylen kann als Ausgangsstoff für die Herstellung von Tetrazolen genutzt werden. So gelingt durch die Umsetzung mit Trimethylsilylazid in DMSO mit der Bildung des 5-Amidinotetrazols die Tetrazolringbildung. Durch basische Hydrolyse kann das Kaliumsalz des Tetrazol-5-carbonsäureamids erhalten werden. Dessen Umsetzung mit Methyliodid ergibt die beiden Isomere 1-Methyltetrazol-5-carbonsäureamid und 2-Methyltetrazol-5-carbonsäureamid.[15]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Auf Grund seiner aciden Eigenschaften kann FOX-7 mit basischen und nucleophilen Stoffen umgesetzt werden, um weitere hochenergetische Substanzen herzustellen. So gibt die Umsetzung mit Guanidiniumchlorid in Gegenwart von Kalilauge das Guadidiniumsalz G(FOX-7).[23] Der höhere Stickstoffgehalt im Molekül bewirkt bei thermischen Zersetzungen eine höhere Gasentwicklung, was eine Anwendung in Treibsätzen ermöglicht.[23] Die Kompatibilität mit anderen Explosivstoffen wurde mittels thermischer Analyse überprüft, wobei sich mit CL-20, Octogen (HMX), Trinitrotoluol (TNT) und Nitrotriazolon eine gute, mit TATB und Hexanitrostilben eine begrenzte, und mit DNTF und RDX eine schlechte Kompatibilität zeigte.[24]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n A.J. Bellamy: FOX-7 (1,1-Diamino-2,2-dinitroethene) in Struc. Bond. 125 (2007) 1–33. doi:10.1007/430_2006_054 (Structure & Bonding, Vol. 125: High energy density materials, Ed. Thomas M. Klapötke. Springer 2007, doi:10.1007/978-3-540-72202-1, ISBN 978-3-540-72201-4, S. 14, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, S. 69, ISBN 978-3-527-32009-7.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1,1-Ethenediamine, 2,2-dinitro- im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Juli 2019.
- ↑ P. Politzer, M.C. Concha, M.E. Grice, J.S. Murray, P. Lane, D. Habibollazadeh: Computational investigation of the structures and relative stabilities of amino/nitro derivatives of ethylene in J. Mol. Struct. 452 (1998) 75–83, doi:10.1016/S0166-1280(98)00136-5.
- ↑ K. Baum, S.S. Bigelow, Nguyen Nghi Van, T.G. Archibald, R. Gilardi, J.L. Flippen-Anderson, C. George: Synthesis and reactions of 1,1-diiododinitroethylene in J. Org. Chem. 57 (1992) 235–241, doi:10.1021/jo00027a042.
- ↑ a b c N.V. Latypov, J. Bemm, A. Langlet, U. Wellmar, U. Bemm: Synthesis and reactions of 1,1-diamino-2,2-dinitroethylene in Tetrahedron 54 (1998) 11525–11536, doi:10.1016/S0040-4020(98)00673-5.
- ↑ N.V. Latypov, M. Johansson, E. Holmgren, E.V. Sizova, V.V. Sizov, A.J. Bellamy: On the Synthesis of 1,1-Diamino-2,2-dinitroethene (FOX-7) by Nitration of 4,6-Dihydroxy-2-methylpyrimidine in Org Process Res Dev. 11 (2007) 56–59, doi:10.1021/op068010t.
- ↑ M. Anniyappan, M.B. Talawar, G.M. Gore, S. Venugopalan, B.R. Gandhe: Synthesis, characterization and thermolysis of 1,1-diamino-2,2-dinitroethylene (FOX-7) and its salts in J. Hazard. Mat. B137 (2006) 812–819, doi:10.1016/j.jhazmat.2006.03.034.
- ↑ B. Buszewski, M. Michel, S. Cudzilo, Z. Chylek: High performance liquid chromatography of 1,1-diamino-2,2-dinitroethene and some intermediate products of its synthesis in J. Hazard. Mat. 164 (2009) 1051–1058, doi:10.1016/j.jhazmat.2008.09.018.
- ↑ H. Cai, Y. Shu, H. Huang, B. Cheng, J. Li: Study on Reactions of 2-(Dinitromethylene)-4,5-imidazolidinedione in J. Org. Chem. 69 (2004) 4369–4374, doi:10.1021/jo030395f.
- ↑ a b Klapötke, T.M.: Chemistry of High-Energy Materials, 2nd Edition, 2012 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-027358-8, S. 11–13, (abgerufen über De Gruyter Online).
- ↑ P.B. Kampa, M. Herrmann: Temperature resolved X-ray diffraction for the investigation of the phase transitions of FOX-7 in Part. Part. Syst. Char. 22 (2005) 418–422, doi:10.1002/ppsc.200501006.
- ↑ U. Bemm, H. Östmark: 1,1-Diamino-2,2-dinitroethylene. A novel energetic material with infinite layers in two dimensions in Acta Cryst. C 54 (1998) 1997–1999, doi:10.1107/S0108270198007987.
- ↑ a b c J. Evers, T. M. Klapötke, P. Mayer, G. Oehlinger, J. Welch: α- and β-FOX-7, Polymorphs of a High Energy Density Material, Studied by X-ray Single Crystal and Powder Investigations in the Temperature Range from 200 to 423 K in Inorg. Chem. 45 (2006) 4996–5007, doi:10.1021/ic052150m.
- ↑ a b c G. Herve; G. Jacob: Novel illustrations of the specific reactivity of 1,1-diamono-2,2-dinitroethene (DADNE) leading to new unexpected compounds in Tetrahedron 63 (2007) 953-959, doi:10.1016/j.tet.2006.11.031.
- ↑ M.-J. Crawford, J. Evers, M. Göbel, T.M. Klapötke, M. Mayer, G. Oehlinger, J.M. Welch: γ–FOX-7: Structure of a high energy density material immediately prior to decomposition in Propellants, Explosives, Pyrotechnics 32 (2007) 478–495, doi:10.1002/prep.200700240.
- ↑ A. Gindulyte, L. Massa, L. Huang, J. Karle: Proposed Mechanism of 1,1-Diamino-Dinitroethylene Decomposition: A Density Functional Theory Study in J. Phys. Chem. A 103 (1999) 11045–11051, doi:10.1021/jp991794a.
- ↑ a b c d e f g W.A. Trzcinski, S. Cudzilo, Z. Chylek, L. Szymanczyk: Detonation properties of 1,1-diamino-2,2-dinitroethene (DADNE) in J. Hazard. Mat. 157 (2008) 605–612, doi:10.1016/j.jhazmat.2008.01.026.
- ↑ Klapötke, T.M.: Energetic Materials Encyclopedia, Vol. E–N, Walter de Gruyter GmbH Berlin/Boston 2021, ISBN 978-3-11-067242-8, S. 707–723.
- ↑ Klapötke, T.M.; Wahler, S.: Approximate estimation of the critical diameter in Koenen tests in Z. Naturforsch. B 76 (2021) 341–344, doi:10.1515/znb-2021-0063.
- ↑ Fang, X.; McLuckie, W.G.: Laser ignitibility of insensitive secondary explosive 1,1-diamino-2,2-dinitroethene (FOX-7) in J. Hazard. Mat. 285 (2015) 375–382, doi:10.1016/j.jhazmat.2014.12.006.
- ↑ a b c d G. Herve; G. Jacob; N. Latypov: The reactivity of 1,1-diamino-2,2-dinitroethylene (FOX-7) in Tetrahedron 61 (2005) 6743–6748, doi:10.1016/j.tet.2005.05.010.
- ↑ a b Kangzhen Xu, Jirong Songa, Fengqi Zhao, Haixia Ma, Hongxu Gao, Chunran Changa Yinghui, Rena Rongzu Hu: Thermal behaviour, specific heat capacity and adiabatic time-to-explosion of G(FOX-7) in J. Hazard. Mat. 158 (2008) 333–339, doi:10.1016/j.jhazmat.2008.01.077.
- ↑ Yuan-ping Zhang, Cong-hua Hou, Xin-lei Jia, Ying-xin Tan, Jing-yu Wang: Compatibility Study of 1,1-Diamino-2,2-Dinitroethene (FOX-7) with Some Energetic Materials in Hindawi Journal of Chemistry, 2020, ID 7605140, doi:10.1155/2020/7605140, pdf.












