Schilddrüse

Die Schilddrüse (lateinisch Glandula thyreoidea[1][2][3][4] oder Glandula thyroidea[5]) ist eine Hormondrüse bei Wirbeltieren, die sich bei Säugetieren am Hals unterhalb des Kehlkopfes vor der Luftröhre befindet. Beim Menschen hat sie die Form eines Schmetterlings. Sie besteht aus zwei Lappen, die durch eine Isthmus genannte schmale Brücke miteinander verbunden sind.
Die Hauptfunktion der Schilddrüse besteht in der Speicherung von Iod und Bildung der iodhaltigen Schilddrüsenhormone Triiodthyronin und Thyroxin sowie des Peptidhormons Calcitonin. Die iodhaltigen Schilddrüsenhormone werden von den Follikelepithelzellen der Schilddrüse (Thyreozyten) gebildet und spielen eine wichtige Rolle für den Energiestoffwechsel, für das Wachstum einzelner Zellen und für den Gesamtorganismus. Calcitonin wird von den parafollikulären oder C-Zellen der Schilddrüse gebildet. Es hemmt den Knochenabbau durch Einbau von Calcium und Phosphat in den Knochen und durch Hemmung der Osteoklasten, die im aktivierten Zustand zu einer Verminderung der Knochensubstanz führen.
Die Schilddrüse ist Ausgangspunkt für zahlreiche Erkrankungen, die unter anderem zu Störungen des Hormonstoffwechsels führen und eine Unter- oder Überfunktion der Schilddrüse (Hypothyreose bzw. Hyperthyreose) hervorrufen können. In Jodmangel-Gebieten kann kompensatorisch ein Kropf (Struma) oder Knoten entstehen. In Deutschland befasst sich die Deutsche Gesellschaft für Endokrinologie (DGE) mit ihrer Sektion „Schilddrüse“ mit diesem Organ und seinen Erkrankungen.
Anatomie und Entwicklung
[Bearbeiten | Quelltext bearbeiten]Menschliche Schilddrüse
[Bearbeiten | Quelltext bearbeiten]
Die menschliche Schilddrüse besteht aus zwei Lappen (Lobus dexter und Lobus sinister), die durch einen schmalen Streifen (Isthmus) verbunden sind. Dieser Isthmus befindet sich unmittelbar vor der Luftröhre (Trachea) unterhalb des Kehlkopfs (in Höhe der 2. bis 3. Knorpelspange). Die beiden Lappen der Schilddrüse lagern sich den Seitenflächen der Luftröhre auf, umgreifen diese und sind durch Bindegewebe an sie angeheftet. Die sehr variable Form der Schilddrüse ist am ehesten mit einem „H“ vergleichbar, wobei die unteren Anteile der Längsbalken – die Unterhörner – kurz und breit sind, die oberen Anteile – die Oberhörner – dagegen lang und schmal sind sowie leicht auseinanderdriften.
Die Schilddrüse ist die größte endokrine Drüse des Menschen.[6] Durchschnittlich wiegt die Schilddrüse des Erwachsenen 18–60 g, beim Neugeborenen 2–3 g. Die Normalwerte für die Höhe und Dicke der Schilddrüsenlappen betragen 3–4 beziehungsweise 1–2 cm. Die Breite wird mit 7–11 cm angegeben.[7] Hinsichtlich des Volumens gilt bei Frauen ein Gesamtvolumen der Schilddrüse von bis zu 18 ml und bei Männern von bis zu 25 ml noch als normal. Gewicht und Größe der Schilddrüse schwanken auch intraindividuell; so sind beispielsweise bei Frauen geringe zyklusabhängige Volumenveränderungen möglich.[8]
Die Blutversorgung erfolgt durch die Arteria thyroidea superior aus der Arteria carotis externa und durch die Arteria thyroidea inferior aus dem Truncus thyrocervicalis der Arteria subclavia (bei Tieren als Arteria thyroidea cranialis und caudalis bezeichnet). Bei etwa fünf Prozent der Menschen existiert eine zusätzliche, unpaare Arteria thyroidea ima. Diese entspringt direkt dem Aortenbogen und erreicht die Schilddrüse am Isthmus oder an ihrem unteren Pol. Weiterhin versorgen auch kleine Arterienäste aus der Vorder- und Seitenfläche der Luftröhre das Schilddrüsengewebe mit Blut. Alle kleinen Äste der Arterien der Schilddrüse bilden innerhalb des Organs ein Geflecht. Nachdem das arterielle Blut die Schilddrüsenzellen passiert hat, sammelt es sich in kleinen Venen, die unterhalb der Schilddrüsenkapsel ein Geflecht bilden. Der venöse Abfluss erfolgt also hauptsächlich über einen Venenplexus (Plexus thyroideus impar), der über die Vena thyroidea inferior, in die Vena brachiocephalica mündet.[8][9]
Die zwischen den Zellen der Schilddrüse befindliche Gewebsflüssigkeit (Lymphe) fließt über Lymphgefäße in Lymphknoten ab. Dieser lymphatische Abfluss der Schilddrüse wird über ein gut ausgebildetes System von Lymphgefäßen sichergestellt. Zwischen den einzelnen Lymphgefäßen und Lymphknoten bestehen viele Verzweigungen. Die Lymphgefäße münden im Wesentlichen in die regionären Lymphknoten, die vor allem entlang der großen Halsvenen (Jugularvenen) anzutreffen sind. Die Lymphe eines Seitenlappens kann über Lymphknoten, die sich vor der Luftröhre befinden, auch die nachgeschalteten Lymphknoten des anderen Schilddrüsenlappens erreichen. Dies ist für die Schilddrüsenchirurgie von Bedeutung, da auch Krebszellen sich über Lymphgefäße ausbreiten können.[9]
Die Schilddrüse wird von Nervenfasern des vegetativen Nervensystems versorgt (innerviert). Die sympathischen Fasern stammen aus dem Ganglion cervicale superius (Ganglion cervicale craniale), die parasympathischen kommen aus den Nervi laryngei des Nervus vagus.
Phylogenetische Entwicklung
[Bearbeiten | Quelltext bearbeiten]Die Entstehung und Entwicklung der Schilddrüse im Verlauf der Stammesgeschichte der Lebewesen wird als phylogenetische Entwicklung bezeichnet. In dieser lässt sich die Schilddrüse auf das bei den basalen Chordatieren vorhandene Endostyl zurückführen, bei anderen wirbellosen Tieren sind keine homologen Strukturen vorhanden. Das Endostyl bildet bei den Schädellosen, den Manteltieren sowie den Ammocoetes-Larven der Neunaugen eine am Boden des Kiemendarms gelegene Flimmerrinne, die Hypobranchialrinne, mit einem Drüsenepithel. Die Zellen des Endostyls reichern Iod aus der Umgebung an und bauen dieses in Moleküle des Hormons Thyroxin ein. Das Drüsenepithel produziert ein Schleimnetz, welches sich über die Kiemenspalten legt und mit dem im Kiemendarm gefilterte Nahrungspartikel eingefangen werden. Dieses wird in der Epibranchialrinne gesammelt und gibt die enthaltenen Nährstoffe an das darüberliegende Dorsalgefäß ab.[10]
In der weiteren Entwicklung innerhalb der Wirbeltiere verliert der Kiemendarm seine Funktion bei der Nahrungsaufnahme und dient weitgehend zur Atmung, während die Nahrung über die nun kieferbewehrte Mundöffnung aufgenommen und im Darm verdaut wird. Das Schilddrüsengewebe befindet sich entsprechend bei den basalen Wirbeltieren (Knorpel- und Knochenfische) ventral im Bereich der Kiemen, während sie bei den Landwirbeltieren vor der Luftröhre im Bereich des Kehlkopfes lokalisiert ist. Embryonal wird sie bei allen Wirbeltieren im ventralen Kiemendarmepithel gebildet. Die Schilddrüsenanlage stellt bei allen Wirbeltieren eine Ansammlung von Drüsenzellen dar, die von Bindegewebe umgeben ist.[11]
Bei den Knorpelfischen liegt die Schilddrüse als scheibenförmige Drüse im Bereich des Unterkiefers. Bei vielen Knochenfischen ist die kompakte Drüse aufgelöst und bildet mehrere Zellhaufen im Bereich der Verzweigung der Ventralaorta, wobei häufig mehrere kleine akzessorische Schilddrüsen weitab der Hauptschilddrüse liegen.[12] Bei ihnen treten auch die zwei paarigen Nebenschilddrüsen (Glandulae parathyreoideae) erstmals auf, die sich gemeinsam mit dem Thymus und dem Ultimobranchialkörper im Epithel des Kiemendarms im Bereich der vierten und fünften Kiementaschen entwickeln. Letztere werden bei den Säugetieren als Calcitonin-produzierende Zellen (C-Zellen) in die Schilddrüse eingelagert.[11]
Bei allen Landwirbeltieren bildet die Schilddrüse wieder kompakte Organe. Sie sind bei den Amphibien als unpaare Schilddrüsen seitlich am Kehlkopf ausgebildet, wobei die Nebenschilddrüsen bei neotänen Amphibien, die während ihres gesamten Lebens Kiemen besitzen, fehlen.[11] Bei den Amphibien sind die Schilddrüsenhormone an der ontogenetischen Entwicklung beteiligt und kontrollieren die Metamorphose von der Larve bis zum adulten Tier.[12]
Bei Reptilien ist die Schilddrüse unpaarig und liegt an der Aufspaltung der großen Halsgefäße. Bei Vögeln liegen beide Schilddrüsen als kleine Knötchen an der Luftröhre vor dem Brusteingang, etwa in Höhe des Schlüsselbeins und damit viel weiter hinten (kaudal) als bei den anderen Wirbeltieren.
Wie beim Menschen besteht die Schilddrüse der meisten Säugetiere aus zwei Seitenlappen, die über eine schmale Engstelle (Isthmus) miteinander verbunden sind. Dieser Isthmus kann aus Drüsengewebe (Isthmus glandularis, z. B. bei Raubtieren) oder nur aus Bindegewebe (Isthmus fibrosus, z. B. bei Pferden, Schafen und Ziegen) bestehen, bei einigen Arten auch ganz fehlen. Ein Rest des Ductus thyreoglossus tritt beim Menschen oft in Form eines Lobus pyramidalis auf. Seltener können mediane Halszysten oder -fisteln als Rest dieses Ganges bei Menschen persistieren. Die Schildform ist nur für den Menschen, Affen und Schweine typisch.
Ontogenetische Entwicklung
[Bearbeiten | Quelltext bearbeiten]
Als ontogenetische Entwicklung wird in der Biologie die Entstehung und Entwicklung eines einzelnen Individuums bezeichnet. In ihr werden alle Vorgänge beschrieben, die von der befruchteten Eizelle zum erwachsenen Individuum führen. Die Anlage der Schilddrüse lässt sich beim menschlichen Embryo erstmals um den 24. Entwicklungstag herum nachweisen. Sie entwickelt sich im Mundboden als eine Aussprossung des Verdauungsapparats („Kopfdarm“). Wie ein Schlauch, der von einer einschichtigen Zelllage gebildet wird, wächst die Aussprossung, die als Ductus thyreoglossus („Schilddrüsen-Zungen-Gang“) bezeichnet wird, nach unten. Im unteren Anteil des Ganges entstehen zwei weitere Aussackungen, aus denen später die beiden Schilddrüsenlappen hervorgehen. Der Gang selbst verschließt sich normalerweise, so dass die definitive Schilddrüse keine Verbindung zum Mundboden mehr hat. In der Regel bleibt lediglich eine dreieckige Vertiefung am Zungengrund zurück, die als Foramen caecum bezeichnet wird. Ihre endgültige Position vor der Luftröhre nimmt die Schilddrüse in der 7. Embryonalwoche ein.[8][13]
Bei etwa 30 % der Menschen bleibt ein Rest des Ductus thyreoglossus als dritter, unpaarer Schilddrüsenlappen auch nach der Embryonalentwicklung als Lobus pyramidalis bestehen. Seltener können aus kleineren übriggebliebenen Teilen des Ganges Zysten entstehen (beispielsweise die Bochdalek-Zyste). Erhalten solche Zysten Anschluss an die äußere Körperoberfläche oder den Mundboden, spricht man von Fisteln. Versprengte und hormonell aktive Inseln von Schilddrüsengewebe können ebenfalls entlang des Entwicklungsweges der Schilddrüse erhalten bleiben.[8][13]
In die Schilddrüsenanlage wandern zudem bei den Säugetieren noch Zellen aus der fünften Schlundtasche ein, aus denen sich die C-Zellen (siehe unten) entwickeln. Vorläuferzellen der C-Zellen stammen aus der Neuralleiste. Die C-Zellen bilden bei den übrigen Wirbeltierklassen noch ein eigenes Organ, den ultimobranchialen Körper. Bei vielen Säugetierarten ist auch das innere Epithelkörperchen (Glandula parathyroidea interna, eine der sogenannten Nebenschilddrüsen) in die Schilddrüse eingeschlossen, beim Menschen liegt es als Glandula parathyroidea inferior am unteren Pol der Schilddrüse.
Histologie
[Bearbeiten | Quelltext bearbeiten]
Follikel mit Kolloid (1), Follikelepithelzellen (2), C-Zelle (Pfeil)
Auffälligstes Strukturmerkmal des Schilddrüsengewebes sind mikroskopisch kleine Bläschen, die als Schilddrüsenfollikel bezeichnet werden (v. lat. folliculus „Bläschen“). Gebildet werden die Follikel von den Zellen, die die Schilddrüsenhormone T3 und T4 herstellen (Follikelepithelzellen oder auch Thyreozyten genannt). Die Zellen sind dabei einschichtig angeordnet (Epithel) und umschließen den Innenraum (das Lumen) der Follikel. Im Querschnitt bieten die Follikel eine meist rundlich bis ovale Form. Auch innerhalb einer individuellen Drüse kann der Follikeldurchmesser stark variieren (zwischen 50 und 200 µm). Innerhalb des Follikellumens befindet sich eine Vorstufe der Schilddrüsenhormone, das Protein Thyreoglobulin. Es bildet hier eine trüb glasige, gelatinös bis zähe Masse, die als Kolloid bezeichnet wird. Schätzungen gehen davon aus, dass die innerhalb des Kolloids enthaltenen Hormone ausreichen, um den Organismus des gesunden Menschen für etwa drei Monate zu versorgen. Die Form der Follikel und die Menge des Kolloids sind von Alter und Funktionszustand des Gewebes abhängig. Eine aktivierte Schilddrüse zeichnet sich durch hohe Epithelzellen und kleinere Follikel aus, während viel Kolloid und flaches Epithel ein inaktives Stadium der Zellen anzeigen. Dieser inaktive Zustand wird auch als Ruhe- oder Stapelform der Drüse bezeichnet.[8][14]
Die Schilddrüse wird von einer Bindegewebskapsel (Capsula fibrosa) umgeben, von der Bindegewebsscheiden (Septen) ausgehen und das Organ in einzelne Läppchen unterteilen. Jedes Läppchen besteht aus mehreren Follikeln. Zwischen den Epithelzellen der Follikel und ihrer Basalmembran liegen bei Säugetieren die parafollikulären C-Zellen. Diese reichen nicht bis an das Lumen der Follikel. Um die Follikel sind retikuläre Fasern und ein dichtes Kapillarnetz (Blut- und Lymphkapillaren) ausgebildet.[8]
Die Größe der Follikel im histologischen Präparat hängt nicht nur vom Funktionszustand, sondern auch von der Schnittebene durch den Follikel ab. Die Anfärbung des Kolloids ist stark von dessen Wassergehalt abhängig. Durch Schrumpfung im Zuge der histologischen Aufarbeitung scheint das Kolloid den Follikel nicht vollständig auszufüllen, dies ist aber ein Artefakt. Die C-Zellen sind nur immunhistochemisch exakt auszumachen.
Hormone
[Bearbeiten | Quelltext bearbeiten]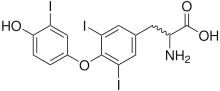

Die von der Schilddrüse gebildeten Hormone Triiodthyronin (T3) und Thyroxin (Tetraiodthyronin, T4) sind von großer Bedeutung für eine regelgerechte Entwicklung des neugeborenen Organismus. Auch beim Erwachsenen beeinflussen die Schilddrüsenhormone den Stoffwechsel und Funktionszustand fast aller Organe. Das ebenfalls in der Schilddrüse gebildete Calcitonin spielt eine untergeordnete Rolle im Calciumstoffwechsel des Organismus.
Außerhalb der Säugetiere erfüllen die Schilddrüsenhormone T3 und T4 eine Reihe weiterer wichtiger Funktionen. So induzieren sie beispielsweise bei Fröschen die Metamorphose von der Kaulquappe zum Frosch und bei Vögeln die Mauser.
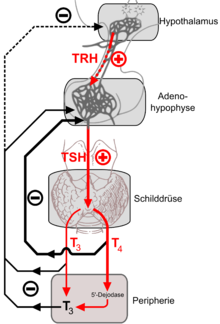
Die Schilddrüsenhormone sind Bestandteil des sogenannten thyreotropen Regelkreises. Die Funktion der Schilddrüse wird hierbei durch den Hypothalamus und die Hirnanhangsdrüse (Hypophysenvorderlappen) reguliert. In der Hirnanhangsdrüse wird das Hormon TSH (Thyreoidea stimulierendes Hormon) gebildet und in die Blutbahn abgegeben. An den Schilddrüsenzellen angelangt, fördert es deren Wachstum und die Ausschüttung von T3 und T4. T3 und T4 selbst hemmen wiederum die Ausschüttung von TSH. Dieser als negative Rückkopplung bezeichnete Mechanismus führt dazu, dass im gesunden Organismus die Stoffwechselparameter konstant gehalten werden.
Wirkungen der Schilddrüsenhormone
[Bearbeiten | Quelltext bearbeiten]Schilddrüsenhormone wirken auf das Herz und den Kreislauf. Sie können zu einer Erhöhung der Herzfrequenz und des Blutdrucks sowie zu einer Erweiterung von Gefäßen führen. Sie wirken auf den Zucker-, Fett- und Bindegewebsstoffwechsel, indem sie deren Umsatz steigern. Sie steigern die Aktivität von Schweiß- und Talgdrüsen der Haut und die Aktivität der Darmmotorik. Im Nervensystem führen sie zu einer verstärkten Erregbarkeit der Zellen. Insgesamt wird durch die Wirkung der Schilddrüsenhormone der Energieverbrauch und der Grundumsatz des Organismus erhöht. Folge hiervon ist ein Anstieg der Körpertemperatur.
Schilddrüsenhormone regulieren das Wachstum des Neugeborenen und die Entwicklung von Zellen insbesondere des zentralen Nervensystems (Gehirn und Rückenmark). Auf das Wachstum üben Schilddrüsenhormone ihre Wirkung über andere Hormone wie das Wachstumshormon Somatotropin und IGF-1 aus. Im Nervensystem fördern Schilddrüsenhormone die Umscheidung (Myelinisierung) von Nervenzellen. Besteht ein Mangel an Schilddrüsenhormonen in den ersten Lebensmonaten, lassen sich Veränderungen im Aufbau und in der Funktion der Gliazellen des Nervensystems nachweisen. Weiterhin beeinflussen Schilddrüsenhormone die Entwicklung (Differenzierung) von Nervenzellen und vielen anderen Zellen des Organismus, indem sie auf molekularer Ebene die Expression von Genen steuern. Wird ein Schilddrüsenhormonmangel des Neugeborenen nicht erkannt und behandelt, entwickeln sich schwere neurologische Störungen (Bewegungsstörungen und Störungen der kognitiven Entwicklung).[15]
T3 und T4 vermitteln ihre Wirkungen über Rezeptoren in den Zielzellen. T3 ist hierbei um ein Vielfaches wirksamer als T4. Die Schilddrüsenzellen produzieren vorwiegend T4, welches in den Zielzellen zu T3 umgewandelt (deiodiert) wird. Die Rezeptoren für die Schilddrüsenhormone sind hauptsächlich in den Zellkernen und den Mitochondrien der Zellen lokalisiert. Es handelt sich um Proteine, die an die DNA der von ihnen regulierten Gene gebunden sind und damit die Genexpression hemmen. Durch Bindung der Schilddrüsenhormone werden die Rezeptoren aktiviert, so dass die Genexpression einer ganzen Reihe von Proteinen erleichtert oder erst ermöglicht wird.
Die parafollikulären C-Zellen bilden das Calcitonin. Es senkt den Calciumspiegel im Blut und dient so als Antagonist des Parathormons (PTH) als Regler der extrazellulären Calciumkonzentration.
Bildung der Schilddrüsenhormone
[Bearbeiten | Quelltext bearbeiten]
Die von der Schilddrüse gebildeten Hormone Triiodthyronin (T3) und Thyroxin/Tetraiodthyronin (T4) sind Iodverbindungen. Sie werden von den Follikelepithelzellen gebildet, welche dabei auf eine ausreichende Zufuhr von Iod über die Nahrung angewiesen sind. Die Follikelepithelzellen bilden zunächst das Protein Thyreoglobulin und geben es in die Follikelhöhle ab. Mit den Blutgefäßen erreicht Iod in Form seines Ions Iodid die Follikelepithelzellen (Thyreozyten). Mithilfe eines spezialisierten Proteins – des sogenannten Natrium-Iodid-Cotransporters (NIS) – nehmen die Zellen basolateral das Iodid auf. Das Iodid gelangt aus dem Blut durch einen Ionenkanal (Pendrin) apikal in das Follikellumen (Iodination).
Für die nächsten Schritte der Hormonsynthese sind die Enzyme Thyrooxidase (eine NADPH/H+-Oxidase zur Synthese des Wasserstoffperoxids; ein integrales Membranprotein) und Thyreoperoxidase notwendig. Dieses befindet sich in der an die Follikelhöhle angrenzenden Membran der Schilddrüsenzelle. Dieses Wasserstoffperoxid oxidiert dann Iodid von der Oxidationszahl −1 zu elementarem Iod mit der Oxidationszahl ±0 (Iodisation, Jodisation). Im nächsten Schritt werden die Iod-Atome an die Tyrosinanteile des Thyreoglobulins gebunden (Iodierung, Koppelung). Tyrosin ist eine Aminosäure und Bestandteil des Thyreoglobulins. Das iodierte Thyreoglobulin wird erneut von der Follikelepithelzelle aufgenommen (Speicherung) und durch Enzyme zersetzt. Dabei werden auch die iodierten Tyrosinverbindungen (jetzt Thyroxin und Triiodthyronin genannt) freigesetzt. Sie können die Membran der Zelle frei passieren und gelangen über das Blutgefäßsystem zu ihren Zielzellen (Hormoninkretion), in denen sie ihre biologischen Wirkungen entfalten.
Untersuchungsmethoden
[Bearbeiten | Quelltext bearbeiten]
Die Schilddrüse kann beim Menschen durch Abtasten (Palpation) des Halses untersucht werden. Bei Hunden gilt eine tastbare Schilddrüse bereits als vergrößert. Eine ausgeprägte Struma ist beim Menschen sichtbar. Eine orientierende Untersuchung der Schilddrüse sollte im Prinzip von jedem Arzt vorgenommen werden können, da Schilddrüsenerkrankungen beim Menschen sehr häufig sind und Berührungspunkte mit fast allen Teilgebieten der Medizin bestehen. Besondere Erfahrung auf diesem Gebiet haben in der Regel Endokrinologen und Nuklearmediziner.
In der bildgebenden Diagnostik werden hauptsächlich der Ultraschall und zur weiteren Abklärung bei Knoten und Funktionsstörungen die Szintigrafie eingesetzt, für spezielle Fragestellungen auch die Computertomografie und Kernspintomografie.
Eine Feinnadelpunktion der Schilddrüse dient zur Gewinnung von Proben für die Zytologie, eine Biopsie für Proben zur histologischen Untersuchung.
Im Labor können der freie T3- und T4-Spiegel sowie der TSH- und Thyreoglobulin-Spiegel bestimmt werden. Auch eine Bestimmung von Schilddrüsenautoantikörpern (TRAK, Tg-AK, TPO-AK) kann vorgenommen werden.
Krankheiten
[Bearbeiten | Quelltext bearbeiten]Sowohl die Ursachen als auch die Erscheinungsfolgen von Erkrankungen der Schilddrüse, die auch als Thyreopathien bezeichnet werden, sind vielfältig. Es lassen sich nach Häufigkeit tumorartige Krankheiten (Struma (Kropf), Schilddrüsenautonomie), Entzündungen, gut- und bösartige Neubildungen (benigne und maligne Neoplasien) und Störungen der Organentwicklung unterscheiden. Alle Schilddrüsenkrankheiten können zu Störungen des Hormonstoffwechsels führen. Diese Funktionsstörungen werden – abhängig von der Wirkung der Schilddrüsenhormone auf den Organismus – als Schilddrüsenüberfunktion (Hyperthyreose) oder Schilddrüsenunterfunktion (Hypothyreose) bezeichnet.
Struma
[Bearbeiten | Quelltext bearbeiten]


Als Struma (Kropf) wird jede Vergrößerung der Schilddrüse über ihr normales Volumen hinaus bezeichnet. Solche Vergrößerungen können objektiv mithilfe einer sonographischen Untersuchung der Schilddrüse festgestellt werden. Grundsätzlich kann jede der Schilddrüsenkrankheiten mit einer Volumenvergrößerung einhergehen. Die weitaus häufigste Ursache für eine Struma ist mit etwa 90 % der ernährungsbedingte Jodmangel (auch als blande Struma bezeichnet). Das Symptom der Struma war bereits in der Antike bekannt.[16]
Jodmangelstruma
Da bei der Jodmangelstruma meist noch ausreichend Schilddrüsenhormone synthetisiert werden, kommt es nicht zu einer Funktionsstörung der Schilddrüse im Sinne einer Unter- oder Überfunktion. Daher wird die Jodmangelstruma auch als euthyreote Struma bezeichnet. Die Jodmangelstruma betrifft vorwiegend Frauen (Verhältnis betroffener Frauen zu Männern: 7:1). In Gebieten, in denen die Inzidenz der Struma 10 % übersteigt, wird sie auch als endemische Struma bezeichnet. Bezüglich des Krankheitsmechanismus ist bekannt, dass es aufgrund des Jodmangels zu einer vermehrten Ausschüttung von sogenannten Wachstumsfaktoren durch die Thyreozyten kommt. Diese Proteine führen zu einer erhöhten Teilungsrate der Thyreozyten, wodurch die Schilddrüse insgesamt an Volumen zunimmt. Betrifft diese Hyperplasie zu Beginn des Prozesses noch die gesamte Schilddrüse gleichmäßig (diffuse Struma), kann es später teilweise zu einem knotigen Umbau einzelner Bereiche der Schilddrüse kommen (Knotenstruma).[17][18] Die wichtigste Maßnahme zur Prävention einer Jodmangelstruma besteht in der generellen Verwendung von iodiertem Speisesalz. Da in Jodmangelgebieten wie Österreich, Schweiz und Deutschland die Verwendung von iodiertem Speisesalz im Haushalt allein nicht ausreichend ist, müssen auch industriell hergestellte Fertignahrungsmittel iodiertes Speisesalz enthalten, um eine ausreichende Versorgung mit Iod über die Ernährung zu gewährleisten. Während in der Schweiz, in Österreich und in den USA die Iodprophylaxe der Bevölkerung gesetzlich geregelt ist, besteht in Deutschland nur eine Zulässigkeit der freiwilligen Iodprophylaxe.[17][19]
Schilddrüsenautonomie
[Bearbeiten | Quelltext bearbeiten]Eine Schilddrüsenautonomie liegt vor, wenn die Thyreozyten in ihrem Wachstum und ihrer Funktion nicht mehr abhängig von der Regulation durch die Hypophyse sind. Durch vermehrtes Wachstum kommt es zur Ausbildung einzelner oder mehrerer Knoten (unifokale oder multifokale Autonomie), selten auch zu einer disseminierten Autonomie, bei der ein diffuses Wachstum vorliegt. Die autonomen Knoten können vermehrt Schilddrüsenhormon produzieren, wodurch es häufig zu einer Überfunktion der Schilddrüse kommt. Die Schilddrüsenautonomie tritt in Jodmangelregionen häufiger auf als in Ländern mit ausreichender Iodversorgung. Ihre Häufigkeit nimmt mit dem Lebensalter zu: Sie ist vor allem bei Personen über dem 40. Lebensjahr anzutreffen.[17]
Entzündungen
[Bearbeiten | Quelltext bearbeiten]Entzündungen der Schilddrüse werden als Thyreoiditis bezeichnet. Innerhalb kurzer Zeit entstehende (akute), eitrige Entzündungen sind selten. Sie werden durch Bakterien oder Pilze verursacht, die die Schilddrüse über die Blutgefäße (hämatogen) erreichen. Begünstigend kann eine Schwächung des Immunsystems durch eine Chemotherapie bei Krebserkrankungen oder bei einer Infektion mit HIV sein.
Die chronisch verlaufende Hashimoto-Thyreoiditis ist häufig: Sie betrifft etwa 3 % der Bevölkerung und mehr Frauen als Männer (etwa in einem Verhältnis von 10:1). Hier kommt es zu einer durch das Immunsystem vermittelten Zerstörung des Schilddrüsengewebes. Weltweit ist sie in Nichtjodmangelgebieten die häufigste Ursache für eine Hypothyreose des Erwachsenen.
Der Morbus Basedow ist eine Autoimmunkrankheit der Schilddrüse, die mit der Bildung von stimulierenden Antikörpern gegen Thyreozyten einhergeht. Die Folge ist neben einer Überfunktion mit den entsprechenden Symptomen häufig auch eine Vergrößerung der Schilddrüse. Die Krankheit betrifft etwa 1–2 % der Bevölkerung, wobei Frauen fünfmal häufiger als Männer betroffen sind. Der Immunprozess, der dem Morbus Basedow zu Grunde liegt, kann auch in anderen Organen zu Symptomen führen (extrathyreoidale Manifestation des Morbus Basedow). Bei etwa 60 % der Patienten tritt eine sogenannte endokrine Orbitopathie auf, die durch eine Volumenzunahme des hinter dem Auge befindlichen Bindegewebes charakterisiert ist. Hierdurch können die Augäpfel vorgedrängt werden (Exophthalmus). Seltener (bei weniger als 3 % der Patienten) ist eine Manifestation in der Haut vor dem Schienbein (prätibiales Myxödem), bei der es zu einer nichteindrückbaren Schwellung der Haut kommt.[17]
Bei der seltenen subakuten (innerhalb einiger Tage bis Wochen entstehenden) Thyreoiditis (Thyreoiditis de Quervain) kommt es meist im Anschluss an eine virale Infektion zu einer ebenfalls immunvermittelten Zerstörung von Schilddrüsengewebe. Häufig besteht eine schmerzhafte Schwellung der Schilddrüse. Meist klingt die Entzündung nach einigen Wochen bis Monaten spontan ab.
Sehr selten ist die Riedel-Thyreoiditis (auch „eisenharte Struma“ genannt), die mit einem ausgeprägten narbigen Umbau der Schilddrüse einhergeht. Die Entzündung greift dabei vom umliegenden Gewebe auf das Schilddrüsenorgan über.
Die Entzündungen der Schilddrüse, die auf autoimmune Prozesse zurückzuführen sind, werden unter dem Begriff der Autoimmunthyreopathie zusammengefasst.
Schilddrüsenzysten
[Bearbeiten | Quelltext bearbeiten]Zysten sind flüssigkeitsgefüllte Hohlräume, die häufig asymptomatisch sind und Zufallsbefunde darstellen. Entwicklungsbedingt (s. oben) können Zysten aus Schilddrüsengewebe als mediane Halszysten auftreten.
Schilddrüsenzysten können im Rahmen der in Deutschland häufigen Jodmangelstruma, aber auch bei gut- und bösartigen Tumoren oder Systemerkrankungen sowie nach Verletzungen vorkommen. Die Therapie richtet sich nach der Ursache der Zyste und den Beschwerden, die sie verursacht. Sie reicht von klinischer Beobachtung[20] über medikamentöse Behandlung oder Verödung mit Alkohol[21] bis zur chirurgischen Entfernung bei großen Zysten mit Beschwerden oder dem Verdacht auf eine Krebserkrankung.
In der Regel können Zysten sehr gut im Ultraschall dargestellt und beurteilt werden. Auch eine diagnostische Feinnadelpunktion[22] kann ultraschallgesteuert erfolgen.
Schilddrüsenkrebs
[Bearbeiten | Quelltext bearbeiten]Die meisten bösartigen Schilddrüsentumore sind Adenokarzinome. Die bösartigen Neubildungen der Schilddrüse (maligne Neoplasien) gehen meist von den Thyreozyten oder von den Calcitonin produzierenden C-Zellen aus. Sehr selten ist ein vom Bindegewebe ausgehender Schilddrüsenkrebs (Sarkom). Als einzige gesicherte Ursache für die Schilddrüsenkrebse gilt eine Strahlenexposition. Gemäß pathologischen Kriterien wird der Schilddrüsenkrebs in folgende Untergruppen eingeteilt:
Follikuläres Karzinom
Bei diesem Karzinom ähnelt der Gewebeaufbau weitgehend der Struktur einer ausgereiften oder sich entwickelnden Schilddrüse. Die Krebszellen gehen von den Thyreozyten aus und bilden vorwiegend über die Blutbahn Absiedlungen (hämatogene Metastasierung) in Lunge, Skelett und Gehirn. Auf das follikuläre Karzinom entfallen 20–50 % aller Schilddrüsenkarzinome. Es betrifft häufig Frauen im 4. und 5. Lebensjahrzehnt.[18]
Papilläres Karzinom
Diese Karzinome gehen ebenfalls von den Thyreozyten aus und bilden fingerförmig verästelte (papilläre) Strukturen. Sie sind mit 50–80 % aller Schilddrüsenkarzinome die häufigsten bösartigen Neubildungen der Schilddrüse. Sie metastasieren vorwiegend über die Lymphgefäße (lymphogene Metastasierung) in die Lymphknoten des Halses. Diese können dadurch an Größe zunehmen und getastet werden. Die papillären Karzinome betreffen häufig Frauen im 3.–4. Lebensjahrzehnt. Als begünstigende Faktoren für ihre Entstehung gelten eine Strahlenbelastung (beispielsweise im Rahmen einer therapeutischen Bestrahlung der Kopf-Hals-Region oder der Reaktorkatastrophe von Tschernobyl), eine Hashimoto-Thyreoiditis sowie verschiedene genetische Syndrome (FAP-Syndrom und Cowden-Syndrom).[18]
Anaplastisches Karzinom
Dieses Karzinom zeigt in seiner Feinstruktur keine Ähnlichkeiten mehr mit dem ursprünglichen Schilddrüsengewebe und wird deshalb auch als undifferenziertes Karzinom bezeichnet. Es wächst sehr aggressiv in das umliegende Gewebe ein und metastasiert sowohl lymphogen als auch hämatogen. Etwa 5–10 % der Schilddrüsenkarzinome entfallen auf diesen Typ. Selten entsteht es vor dem 60. Lebensjahr; eine Geschlechtspräferenz zeigt es nicht.[18]
Medulläres Karzinom
Das medulläre Karzinom geht von den Calcitonin produzierenden Zellen der Schilddrüse aus. Es handelt sich um ein neuroendokrines Karzinom, das neben dem Calcitonin auch weitere Hormone (wie Somatostatin, Serotonin und vasoaktives intestinales Peptid) produzieren kann. Es ist für etwa 5 % aller Schilddrüsenkarzinome verantwortlich. Die Krankheit kann sporadisch bei einzelnen Individuen oder im Rahmen genetischer Syndrome (MEN-Syndrom) auftreten. Dieses Karzinom metastasiert sowohl lymphogen als auch hämatogen und tritt insgesamt bei Frauen und Männern mit gleicher Häufigkeit auf.[18]
Störungen der Organanlage
[Bearbeiten | Quelltext bearbeiten]
Das vollständige Fehlen der Schilddrüse (Aplasie der Schilddrüse oder Athyreose) ist bei Neugeborenen sehr selten. Die Ursache ist meist genetisch bedingt, wobei ein autosomal-rezessiver Erbgang vorliegt.[23] Eine embryonale Entwicklungsstörung, bei der die Wanderung der Schilddrüsenanlage vom Mundboden zu ihrer definitiven Position vor der Luftröhre ausbleibt oder nicht vollständig erfolgt, wird als Dystopie bezeichnet. Hier kann die Schilddrüse im Zungengrund zu einer Zungengrundstruma heranwachsen. Aplasien und Dystopien sind die häufigsten Ursachen einer Schilddrüsenunterfunktion des Neugeborenen (angeborene Hypothyreose).
Funktionsstörungen
[Bearbeiten | Quelltext bearbeiten]Als Über- und Unterfunktion der Schilddrüse wird eine gesteigerte oder verminderte Wirkung der Schilddrüsenhormone auf den Stoffwechsel und die Organe des Körpers bezeichnet. Da Rezeptoren für Schilddrüsenhormone überall im Organismus vorhanden sind, kann es infolge von Funktionsstörungen der Schilddrüse zu Symptomen in fast allen Organsystemen kommen. Häufig sind dabei Störungen, die das Herz-Kreislauf-System, das Nervensystem und die Psyche, den Magen-Darm-Trakt sowie den allgemeinen Stoffwechsel, die Haut, das Muskel- und Skelettsystem sowie die Sexualfunktionen betreffen. Beispielsweise kann eine Überfunktion eine Beschleunigung des Herzschlags (Tachykardie), einen unwillkürlichen Gewichtsverlust, Nervosität und Zittern verursachen. Symptome einer Unterfunktion können ein verlangsamter Herzschlag (Bradykardie), eine Gewichtszunahme, Verstopfung und ein Verlust der Libido sein. Eine Unterfunktion kann eine Depression auslösen. Bei Schwangeren kann beim Kind Kretinismus verursacht werden.
Die häufigsten Ursachen einer Hyperthyreose (Überfunktion) sind der Morbus Basedow, die Schilddrüsenautonomie sowie eine erhöhte Zufuhr von Schilddrüsenhormonen von außen in Form von Hormonpräparaten.[17]
Die häufigsten Ursachen einer Hypothyreose (Unterfunktion) sind die Hashimoto-Thyreoiditis sowie Maßnahmen (Operation, Radiojodtherapie, Medikamente), die im Rahmen der Therapie einer Schilddrüsenerkrankung durchgeführt wurden.[17]
Es wird zwischen einer subklinischen (latenten) und manifesten Hyper- und Hypothyreose unterschieden. Bei einer manifesten Funktionsstörung ist die Konzentration der freien Schilddrüsenhormone (fT3 und fT4) über den Normalbereich hinaus erhöht oder erniedrigt. Hingegen ist bei einer subklinischen Funktionsstörung die Konzentration der freien Hormone noch im Normbereich, während die Konzentration des die Schilddrüse stimulierenden Hormons TSH über den Normalbereich hinaus erniedrigt beziehungsweise erhöht ist.[17]
Eine Hyperthyreose ist die häufigste hormonelle Störung bei über zehn Jahre alten Hauskatzen (Feline Hyperthyreose). Fast immer ist eine Schilddrüsenautonomie die Ursache.
Medizingeschichtliche Aspekte
[Bearbeiten | Quelltext bearbeiten]Der Schweizer Arzt Paracelsus beschreibt um 1500 den Zusammenhang zwischen Struma und Kretinismus. Er unternimmt erste Therapieversuche mit dem „ungarischen Kropfsalz“, einem aus Halit bestehenden Steinsalz.[24]
Thomas Wharton gibt der Schilddrüse 1656 den lateinischen Namen Glandula thyreoidea.
Das Verständnis für die Funktion der Schilddrüse entwickelte sich erst langsam. Der Mediziner Felix Platter unterschied jedoch bereits Anfang des 17. Jahrhunderts die zystische von der parenchymatösen Struma und beschrieb auch genau die Symptome von Schilddrüsenüber- und unterfunktion.[25] Bis in die zweite Hälfte des 19. Jahrhunderts wurde sie als „Nebendrüse der Respirationsorgane“ betrachtet, deren Funktion unklar war.[26]
Der Dubliner Arzt Robert Graves beschrieb 1835 in seiner Arbeit Palpitation of the heart with enlargement of the thyroid gland als erster die Symptomkonstellation der später im englischsprachigen Raum nach ihm benannten Krankheit (Graves’ disease): Palpitationen, Struma und Exophthalmus. Als Ursache dieser Symptomatik nahm Graves eine Herzerkrankung an. Unabhängig hiervon beschrieb Carl Adolf von Basedow 1840 in Merseburg in seiner Publikation „Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle“ ebenso die Symptomtrias von Struma, Exophthalmus, und Tachykardie (auch als Merseburger Trias bezeichnet). Zur Therapie empfahl er die Einnahme von iodidhaltigem Mineralwasser. Im deutschsprachigen Raum setzte sich die Bezeichnung Basedowsche Krankheit durch. Die Bestimmung der Basedowschen Krankheit als einer Krankheit der Schilddrüse erfolgte allerdings erst 1886 durch den Leipziger Neurologen Paul Julius Möbius.[27][28]
Für Forschungsarbeiten zur Schilddrüse erhielt der Berner Chirurg und Ordinarius Theodor Kocher, der 1876 die erste Strumektomie im heutigen Sinne durchgeführt hatte, 1909 den Nobelpreis. Im Gegensatz zu Kocher, der die vollständige Entfernung der Schilddrüse bevorzugte, empfahl 1885 Johann von Mikulicz-Radecki die Belassung von etwas Schilddrüsengewebe sowie der hinteren Schilddrüsenkapsel.[29][30]
George R. Murray führte 1891 die erste erfolgreiche Therapie des Myxödems mit Schilddrüsenextrakten durch.[27] 1896 isolierte Eugen Baumann eine unlösliche, nicht aus Proteinen bestehende Substanz, in der sich fast das gesamte in der Schilddrüse vorhandene Iod wiederfand – das sogenannte Iodothyrin (oder auch Thyreoiodin) – und charakterisierte es als den wirksamen Bestandteil der Schilddrüse.[31] 1899 fand Adolph Oswald das Thyreoglobulin.[32]
Robert Hutchison stellte 1898 in seiner Arbeit über die Physiologie der Schilddrüse das Wissen seiner Zeit dar. Man wusste den Iodgehalt des Kolloids der Follikel abzuschätzen und stellte ausschließlich die iodhaltigen Bestandteile als aktiv dar. Damalige Versuche hatten gezeigt, dass die intravenöse Gabe des Kolloides keinerlei Wirkung auf Blutdruck oder Herztätigkeit ausübte. Man hatte jedoch nach Injektion von Schilddrüsenextrakten Blutdruckabfälle festgestellt. Tierversuche ergaben, dass das Blut nach Injektion des Kolloides in den Gefäßen nicht verklumpte, dass ein Warmhalten nach operativer Schilddrüsenentfernung keine Verzögerung des Auftretens oder Änderung des Verlaufes akuter Symptome erbrachte, obwohl man keine Giftstoffe in Galle oder ZNS ausmachen konnte, jedoch die orale Gabe von Schilddrüsengewebe die Mortalitätsrate senkte. Darüber hinaus stellte man bei den Versuchen fest, dass weder die operative Entfernung von Hoden bzw. Eierstöcken, noch die orale Gabe von Nebenschilddrüse einen kurativen Einfluss auf das Myxödem hatten.[33] Iodothyrin diente Ende des 19. und Anfang des 20. Jahrhunderts zu Versuchszwecken.[34] Aus der gegensätzlichen Wirkung unterschiedlicher Schilddrüsenextrakte auf den Kreislauf entwickelte sich um die Jahrhundertwende ein damals als polemisch bezeichneter Disput.[35] 1909 konnte John H. King feststellen, dass Iodothyrin einen eigenständigen, dem Extrakt der gesamten Schilddrüse überlegenen, verzögernden Effekt auf den Kohlenhydratstoffwechsel hat.[36] 1911 beschrieb Harry E. Alderson die gegensätzlichen Auswirkungen von Hypo- und Hyperthyreose auf die Haut, sowie Möglichkeiten der Behandlung. Als wirksam im Sinne einer Schilddrüsenstimulation beschrieb er Extrakte der ganzen Schilddrüse, Iod und iodhaltige Substanzen, Arsen, Salicylate, Phosphor, Alkohol, Pilocarpin, Tee, Kaffee, Fleisch, sexuelle Betätigung, Gebärmutterleiden, Schwangerschaft und große emotionale Aufregungen. Als wirksam im Sinne einer Minderung der Schilddrüsenfunktion beschrieb er Opioide, Bromide, Hypnotika im Allgemeinen, Glycerophosphate aus der Linde, Calcium, Milch, getreidereiche Ernährung und sexuelle Enthaltung.[37] Lewellys F. Barker bezeichnete Iodothyrin 1913 als das Hormon der Schilddrüse und rechnete es zu den sympathikotrophen Substanzen endokrinen Ursprungs. Als Wirkungen beschrieb er eine Beschleunigung der Herzfrequenz, eine Erweiterung der Lidspalte, den Exophthalmus sowie ein vermehrtes Ansprechen der Pupille auf Adrenalin.[38]
Die Entdeckung des Schilddrüsenhormones Thyroxin wird Edward Calvin Kendall zugeschrieben. Er hatte aus Iodothyrin einen aktiven Anteil herauskristallisiert und ihn Thyroxin genannt.[39] Zur Diagnose einer Schilddrüsenerkrankung im Blut wurden in dieser Zeit indirekte Parameter wie Blutgerinnung und Differentialblutbild verwendet.[40] 1922 beschrieb Henry Stanley Plummer einen mittels der Lugolschen Lösung erreichten Rückgang von Hyperthyreosezeichen bei Patienten mit Morbus Basedow, das sogenannte „Plummern“.[41] Diese Jodvorbereitung ermöglichte ein wesentlich risikoärmeres Resezieren eines Überfunktionskropfes als es erstmals 1884 durch Ludwig Rehn durchgeführt worden war.[42] Emil Abderhalden und Ernst Wertheimer zeigten 1929, dass Muskelgewebe eine Thyroxinlösung in weit größerem Ausmaß aufnahm als Lebergewebe, konnten jedoch nicht feststellen, „was aus dem von den Geweben aufgenommenen Thyroxin wird.“[43] Noch 1930 wurde über die Entstehung des Thyroxins im Organismus vermutet, dass es sich aus zwei Molekülen Diiodtyrosin zusammensetzen könnte.[44] 1933 beschrieben I. Abelin und A. Florin, dass Schilddrüsenhormone den Grundumsatz stark erhöhen, einen Glykogen- und Fettschwund veranlassen sowie Herz- und Atemfrequenz beschleunigen.[45] Die künstliche Herstellung des Thyroxins wurde erstmals 1927 von Charles Robert Harington in London durchgeführt.[27]
1912 beschrieb Hakaru Hashimoto als erster die Struma lymphomatosa und gilt seitdem als Entdecker der Hashimoto-Thyreoiditis.
1965 meldete Beverley E. P. Murphy sein Patent zur direkten Messung von Thyroxin in Körperflüssigkeiten an, das am 3. Dezember 1968 von der Patentbehörde angenommen wurde. Bis zu diesem Zeitpunkt waren nur indirekte Schilddrüsenfunktionstestungen, wie etwa die Messung des absoluten Iodgehaltes oder des proteingebundenen Iodes im Blut, durchgeführt worden.[46]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Alfred Benninghoff, Detlev Drenckhahn (Hrsg.): Anatomie. Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie. 16. Auflage. Band 2, Urban & Fischer bei Elsevier, München 2004, ISBN 3-437-42350-9, S. 197–203.
- Hugo Čzerný, Uwe Gille: Endokrine Drüsen, Glandulae endocrinae. In: F.-V. Salomon, H. Geyer, U. Gille: Anatomie für die Tiermedizin. Enke-Verlag, Stuttgart 2004, ISBN 3-8304-1007-7, S. 622–632.
- Christian Hessler: Schilddrüse. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 200–203.
- Rudolf Hörmann: Schilddrüsenkrankheiten. Leitfaden für Klinik und Praxis. 4. Auflage. Abw Wissenschaftsverlag, Berlin 2005, ISBN 3-936072-27-2.
- Lewis E. Braverman, David S. Copper, Peter A. Copp (Hrsg.): Werner & Ingbar’s The Thyroid: A Fundamental and Clinical Text. 11. Auflage. Wolters Kluwer Health, Philadelphia 2020, ISBN 978-1975112967.
- Wieland Meng, mit Beiträgen von Chr. Reiners: Schilddrüsenerkrankungen. 4. Auflage. Urban & Fischer, München/Jena 2002, ISBN 978-3-437-22950-3.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Literatur von und über Schilddrüse im Katalog der Deutschen Nationalbibliothek
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ W. His: Die anatomische Nomenclatur. Nomina Anatomica. Der von der Anatomischen Gesellschaft auf ihrer IX. Versammlung in Basel angenommenen Namen. Verlag Veit & Comp, Leipzig 1895.
- ↑ F. Kopsch: Die Nomina anatomica des Jahres 1895 (B.N.A.) nach der Buchstabenreihe geordnet und gegenübergestellt den Nomina anatomica des Jahres 1935 (I.N.A.). 3. Auflage. Georg Thieme Verlag, Leipzig 1941.
- ↑ H. Stieve: Nomina Anatomica. Zusammengestellt von der im Jahre 1923 gewählten Nomenklatur-Kommission, unter Berücksichtigung der Vorschläge der Mitglieder der Anatomischen Gesellschaft, der Anatomical Society of Great Britain and Ireland, sowie der American Association of Anatomists, überprüft und durch Beschluß der Anatomischen Gesellschaft auf der Tagung in Jena 1935 endgültig angenommen. 4. Auflage. Verlag Gustav Fischer, Jena 1949.
- ↑ International Anatomical Nomenclature Committee: Nomina Anatomica. Spottiswoode, Ballantyne and Co., London/ Colchester 1955.
- ↑ Federative Committee on Anatomical Terminology (FCAT): Terminologia Anatomica. Thieme, Stuttgart 1998.
- ↑ Löffler / Petridas: Biochemie und Pathobiochemie. 9. Auflage. Springer-Verlag, Berlin 2014, ISBN 978-3-642-17972-3, S. 512.
- ↑ Titus von Lanz, Werner Wachsmuth: Praktische Anatomie. 1. Auflage. Band 1, Springer, Berlin 1998, ISBN 3-540-01937-5.
- ↑ a b c d e f A. Benninghoff, D. Drenckhahn (Hrsg.): Anatomie. 16. Auflage. Band 2, Urban & Fischer bei Elsevier, München 2004, ISBN 3-437-42350-9.
- ↑ a b J. Siewert, M. Rothmund, V. Schumpelick (Hrsg.): Praxis der Viszeralchirurgie. Endokrine Chirurgie. 2. Auflage. Springer, Heidelberg 2007, ISBN 978-3-540-22717-5.
- ↑ nach Alfred Goldschmid: Chordata, Chordatiere. In: W. Westheide, R. Rieger (Hrsg.): Spezielle Zoologie. Teil 1: Einzeller und Wirbellose Tiere. Gustav Fischer, Stuttgart/ Jena 1997, 2004, ISBN 3-8274-1482-2, S. 835ff.
- ↑ a b c W. Westheide, R. Rieger (Hrsg.): Spezielle Zoologie. Teil 2: Wirbel- und Schädeltiere. Gustav Fischer, Stuttgart/ Jena 1997, 2004, ISBN 3-8274-1482-2, S. 130ff.
- ↑ a b A. Romer, T. Parsons: Vergleichende Anatomie der Wirbeltiere. 5. Auflage. Paul Parey Verlag, Hamburg/ Berlin 1991, ISBN 3-490-11218-0, S. 534 ff.
- ↑ a b T. Sadler: Medizinische Embryologie. 10. Auflage. Thieme, Stuttgart 2003, ISBN 3-13-446610-4.
- ↑ R. Lüllmann-Rauch: Histologie. 1. Auflage. Thieme, Stuttgart 2003, ISBN 3-13-129241-5.
- ↑ M. J. Lentze, J. Schaub, F. J. Schulte, J. Spranger (Hrsg.): Pädiatrie. 3. Auflage. Springer, Berlin 2007, ISBN 978-3-540-71895-6, S. 532.
- ↑ Evert Cornelis van Leersum: Contribution to the history of the simple enlargement of the thyroid gland. In: Janus. 29, 1925, S. 282–289.
- ↑ a b c d e f g R. Hörmann: Schilddrüsenkrankheiten. Leitfaden für Klinik und Praxis. 4. Auflage. Abw Wissenschaftsverlag, Berlin 2005, ISBN 3-936072-27-2.
- ↑ a b c d e U.-N. Riede, M. Werner, H.-E. Schäfer (Hrsg.): Allgemeine und spezielle Pathologie. Thieme, Stuttgart 2004, ISBN 3-13-683305-8.
- ↑ Anke Ehlers: Nutzen und Risiken der Jodprophylaxe in Deutschland.
- ↑ D. W. Kim: Long-term ultrasound follow-up of thyroid colloid cysts. In: International journal of endocrinology. Band 2014, 2014, S. 350971, doi:10.1155/2014/350971. PMID 24864139, PMC 4016894 (freier Volltext).
- ↑ J. L. Reverter, N. Alonso, M. Avila, A. Lucas, D. Mauricio, M. Puig-Domingo: Evaluation of efficacy, safety, pain perception and health-related quality of life of percutaneous ethanol injection as first-line treatment in symptomatic thyroid cysts. In: BMC endocrine disorders. Band 15, November 2015, S. 73, doi:10.1186/s12902-015-0069-3. PMID 26610707, PMC 4661972 (freier Volltext).
- ↑ Feinnadelpunktion
- ↑ J. Stäger, E. R. Froesch: Congenital familial thyroid aplasia. In: Acta Endocrinol (Copenh). 96(2), Februar 1981, S. 188–191. PMID 7468102.
- ↑ Nicole Wobker: Medizingeschichte Schilddrüse – Schilddrüsenguide – Der unabhängige Internetwegweiser zu Erkrankungen der Schilddrüse. 13. Mai 2015, abgerufen am 11. Juli 2023 (deutsch).
- ↑ Christian Hessler: Schilddrüse. 1973, S. 200.
- ↑ J. Hyrtl: Lehrbuch der Anatomie das Menschen. Braumüller Hofbuchhändler. Wien 1863, S. 666.
- ↑ a b c G. Bettendorf (Hrsg.): Zur Geschichte der Endokrinologie und Reproduktionsmedizin. Springer Verlag, Berlin 1995, S. 27.
- ↑ W. Gerabek, B. Haage, G. Keil, W. Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2004, ISBN 3-11-015714-4.
- ↑ Christoph Weißer: Viszeralchirurgie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1448 f., hier: S. 1448.
- ↑ Vgl. auch Christian Hessler: Schilddrüse. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Mit einem Geleitwort von Rudolf Nissen. Dustri-Verlag Dr. Karl Feistle, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 200–203.
- ↑ E. Baumann: Über das Thyrojodin. In: Münchn Med Wschr. 43 (1896/2), S. 309.
- ↑ A. Oswald In: Zeitschr. f. physiol. Chem. 27, 1899, S. 14.
- ↑ R. Hutchison: Further Observations on the Chemistry and Action of the Thyroid Gland. In: J Physiol. 23(3), 26. Juli 1898, S. 178–189.
- ↑ O. von Fürth, K. Schwarz: Über die Einwirkung des Iodothyrins auf den Zirkulationsapparat. In: Archiv für die gesamte Physiologie des Menschen und der Tiere. Volume 124, Numbers 3–5 / August 1908, Verlag Springer Berlin/ Heidelberg, ISSN 0031-6768.
- ↑ A. G. Barbbra: Influence of Iodine, Sodium Iodide, and Iodothyrin on the Circulation. In: Pflüger’s Archiv. 79, 1900, S. 312–318.
- ↑ J. H. King: The influence of the thyroid on carbohydrate metabolism. In: J Exp Med. 11(5), 2. September 1909, S. 665–672.
- ↑ H. E. Alderson: The Skin as Influenced by the Thyroid Gland. In: Cal State J Med. 9(6), Juni 1911, S. 240–243.
- ↑ L. F. Barker: The clinical significance of the autonomic nerves supplying the viscera, and their relations to the glands of internal secretion. In: Can Med Assoc J. 3(8), August 1913, S. 643–657.
- ↑ R. B. Welbourn: The History of Endocrine Surgery. Greenwood Publishing Group, 1990, ISBN 0-275-92586-2, S. 36.
- ↑ An epitome of current medical literature. In: Br Med J. 1(2790), 20. Juni 1914, S. E97–E100.
- ↑ H. S. Plummer, W. M. Boothby: Collected Papers. In: Mayo Clinic. 15, 1923, S. 565.
- ↑ Christoph Weißer: Viszeralchirurgie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1448 f., hier: S. 1448.
- ↑ E. Abderhalden, E. Wertheimer: Studien über das Verhalten von Thyroxin im tierischen Organismus. In: Pflügers Archiv European Journal of Physiology. Springer, Berlin/ Heidelberg, ISSN 0031-6768, 221, 1, 1929, S. 82–92.
- ↑ A. T. Cameron: Some notes on our present knowledge and ignorance of thyroid function. In: Can Med Assoc J. 22(2), Februar 1930, S. 240–246.
- ↑ I. Abelin, A. Florin: Nichtschilddrüsenstoffe mit Schilddrüsenwirkung. In: Naunyn-Schmiedeberg's Archives of Pharmacology. Verlag Springer Berlin/ Heidelberg, ISSN 0028-1298, 171, 1, 1933, S. 443–456.
- ↑ Patent US3414383A: Determination of thyroxine. Angemeldet am 9. August 1965, veröffentlicht am 3. Dezember 1968, Anmelder: Canadian Patents Dev, Erfinder: Beverley E. P. Murphy.