Vulva

Vulva (Mehrzahl: Vulven, lateinisch vulvae; auch Pudendum femininum veraltet „weibliche Scham“) bezeichnet die Gesamtheit der äußeren primären Geschlechtsorgane weiblicher Säugetiere und besteht aus dem Venushügel, den Vulvalippen[1] und der Klitoris. Im Unterschied zur Tieranatomie wird bei der Frau auch der Scheidenvorhof zur Vulva gezählt. Von diesem führt die Scheide (Vagina) ins Innere zur Gebärmutter (Uterus) und die kurze Harnröhre (Urethra feminina) zur Harnblase (Vesica urinaria). Ab der Geschlechtsreife werden große Bereiche der Vulva durch die Schambehaarung bedeckt (Pubes, Crinis vulvae), die sich mit Beginn der Pubertät als Teil der Körperbehaarung und somit als sekundäres Geschlechtsmerkmal herausbildet.
Außerhalb der medizinischen Fachsprache wird die Vulva auch fälschlicherweise als „Scheide“ oder „Vagina“,[2] zuweilen auch als „äußere Scheide“[3] bezeichnet. Ein medizinisch ebenfalls eingeführtes,[4] in literarischer oder gehobener Alltagssprache gebrauchtes Fremdwort ist Cunnus (Mehrzahl Cunni), das in der klassischen lateinischen Literatur jedoch vorwiegend als obszöner Ausdruck oder mit erotischen Konnotationen gebraucht wurde.[5]
Auch die weiblichen Geschlechtsorgane anderer Tiergruppen außer der Säugetiere, unter anderem der Nematoden, können in biologischer Analogie als Vulva bezeichnet werden, unterscheiden sich jedoch vollständig von der Vulva der Säugetiere.
Anatomie bei der Frau
Makroskopische Anatomie
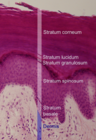
Äußere Erscheinungsform und Anatomie der Vulva
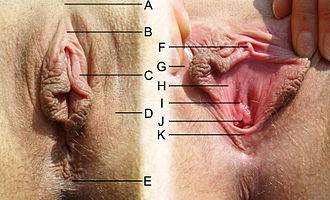 |
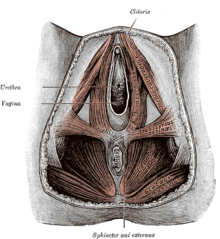
A) Commissura labiorum anterior der großen Schamlippen; B) Klitorisvorhaut, Praeputium clitoridis; durch das Zurückziehen der Klitorisvorhaut, Praeputium clitoridis, zeigt sich das Kitzlerbändchen, Frenula clitoridis, welches sich in die kleinen Labien, Labia minora fortsetzt; C) Kleine Schamlippen, Labia minora; D) Große Schamlippen, Labia majora; E) Commissura labiorum posterior der großen Schamlippen sowie die Dammnaht (Raphe perinei) und der Anus; F) Klitoriseichel, Glans clitoridis und Klitorisschaft, Corpus clitoridis; G) Innere Fläche der großen Schamlippen, Labia majora (siehe auch Fordyce-Drüse); H) Scheidenvorhof, Vestibulum vaginae; I) Mündung der weiblichen Harnröhre, Urethra feminina, der Meatus urethrae externus mit der Carina urethralis vaginae; J) Scheideneingang, Introitus vaginae; K) Fourchette, Commissura labiorum posterior |


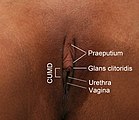
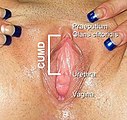
Die Vulva umfasst die äußeren, primären Geschlechtsorgane der Frau. Das sind die einfassenden Anteile wie Venushügel, die großen äußeren Schamlippen, die kleinen inneren Schamlippen, die Klitoris und der Scheidenvorhof mit den Ausgängen der Vagina, der Harnröhre und der Vestibulardrüsen.[6][7] Die Vagina öffnet sich mit der Scheidenöffnung, Ostium vaginae oder Introitus vaginae, mehr oder weniger ausgeprägt ring- bis kranzförmig in den Scheidenvorhof, Vestibulum vaginae, der Vulva. Die großen Schamlippen, Labia majora pudendi, verlaufen vom Venushügel, Mons pubis, bis zum Damm, wobei sie gewissermaßen in die Raphe perinei auslaufen. Sie verdecken Klitoris, Harnröhrenöffnung und Scheideneingang größtenteils und schützen diese somit. Die großen Schamlippen, Labia majora, enthalten in unterschiedlichem Ausmaß subkutanes Fettgewebe und sind von einer pigmentierten Felderhaut bedeckt. Die mit Haaren, Talg- und Schweißdrüsen durchsetzte Haut an der Außenfläche der großen Schamlippen ist pigmentiert. Zur Innenfläche hin verschwinden allmählich die beschriebenen Hautanhangsgebilde. So wird die Haut rötlicher, weicher und gleicht dadurch mehr einer Schleimhaut. Innen enthalten die Labia majora viel Fett- und Bindegewebe, glatte Muskulatur, Nerven und Gefäße. Beide großen Schamlippen bilden die Schamspalte, Rima pudendi, ihre obere Vereinigungsstelle wird als Commissura labiorum anterior, die hintere als Commissura labiorum posterior bezeichnet.[8] Aufgrund der unterschiedlichen Dicke der subkutanen Fettgewebspolster stehen, neben anderen Faktoren, die inneren, kleinen Schamlippen bei einer stehenden Frau in unterschiedlichem Ausmaße hervor.
In der Bildungsphase der Organe beim Embryo (Organogenese) entsteht die Vulva aus dem Genitalhöcker und den seitlich davon liegenden Geschlechtswülsten.
Der Venushügel, Mons pubis oder Mons veneris, und die großen Schamlippen, Labia majora pudendi, stellen die äußere Begrenzung der Vulva dar. Bis zur Pubertät (genauer: Pubarche) sind sie unbehaart, bei erwachsenen Frauen sind sie mit Schamhaar bewachsen. Die großen Schamlippen enthalten Talg-, Schweiß- und Duftdrüsen und bilden die Schamspalte, Rima pudendi. Von den äußeren Schamlippen bedeckt ist der Vorhofschwellkörper (Bulbus vestibuli), der homolog zum Harnröhrenschwellkörper des Mannes ist.[9]
Zwischen den äußeren großen Schamlippen liegen die beiden kleinen Schamlippen, Labia minora pudendi, auch Nymphae genannt. Die inneren kleinen Schamlippen sind bei einigen Frauen in stehender Körperhaltung vollständig durch die äußeren Schamlippen verdeckt, ragen jedoch oft auch sichtbar aus diesen heraus. Zwischen den großen und kleinen Schamlippen formt sich eine fettgewebslose Schicht, die reichlich mit elastischem lockeren Bindegewebe und Talgdrüsen ausgestattet ist.[10] Eine Behaarung fehlt gänzlich. Nach innen zum Vestibulum vaginae befindet sich ein mehrschichtiges, unverhorntes und nach außen schwach verhorntes Plattenepithel. In dem Bindegewebe mit seinem hohen Anteil an elastischen Fasern verzweigen sich reichlich starke Venennetze, die bei geschlechtlicher Erregung anschwellen. An der vorderen Umschlagsfalte der inneren Schamlippen, Commissura labiorum anterior, in der Tieranatomie auch als Commissura labiorum ventralis bezeichnet, liegt die Klitoris, der „Kitzler“. Die Klitoris ist ein von Schwellkörpergewebe gebildetes erektiles Organ, welches mit Nervenenden, genauer Mechanorezeptoren der Haut, durchsetzt und besonders in der Lage ist, auf Berührung zu reagieren. Die Klitoris und der Penis nehmen embryonal-entwicklungsgeschichtlich ihren gemeinsamen Ausgangspunkt aus dem Genitalhöcker. Die Klitoris hat einen äußerlich sichtbaren Anteil, die Klitoriseichel (Glans clitoridis), die von der Klitorisvorhaut (Praeputium clitoridis) überzogen ist, sowie zwei im Inneren liegende Schwellkörperschenkel.[11]
Vom unteren Ende der Vulva aus, der Fourchette, Commissura labiorum posterior, zieht sich sichtbar die Verwachsungsnaht oder Raphe perinei in anteroposteriorer Richtung in der Medianebene zum Anus zu.
Das variable Erscheinungsbild der Vulvae

Jede Vulva ist in ihrem Erscheinungsbild individuell und damit einzigartig. So unterscheiden sich die Größe der Klitoris, der Schamlippen, die Farbe und Oberflächenstruktur, die Entfernung von der Klitoris zur Harnröhrenmündung und die Distanz von der hinteren Umschlagfalte der inneren Schamlippen, Commissura labiorum posterior, bis zum Anus in weiten Grenzen.[12] Diese Variationen erklären auch die Unterschiede zu häufig nachbearbeiteten Abbildungen von äußeren Geschlechtsteilen, die einem idealisierten Schönheitsideal entsprechen.[13]
Der augenfälligste anatomische Unterschied zwischen verschiedenen Frauen liegt in der Ausprägung von Klitorisvorhaut und inneren Schamlippen und dem Grad der Sichtbarkeit bei aufrechter Körperhaltung. Nur bei wenigen Frauen sind diese Strukturen vollständig von den äußeren Schamlippen umschlossen; meist ragen sie mehr oder weniger stark hervor.[14]
Begründet durch die stark zunehmende Nachfrage für ästhetische Intimchirurgie[15] und die damit einhergehende Verunsicherung vieler Frauen[16] wurden mehrere wissenschaftliche Studien durchgeführt, um die Normvariation der Vulva zu bestimmen. Zwischen August 2015 und April 2017 vermaßen Ärzte der gynäkologischen Ambulanz am Luzerner Kantonsspital die äußeren genitalen Strukturen von 657 ambulanten weiblichen Patientinnen (15–84 Jahre).[17] Die Ergebnisse der groß angelegten Studie wurden 2018 veröffentlicht.[18] Die Ärzte und Wissenschaftler stellten eine große Variationsbreite fest, insbesondere bei den inneren Schamlippen, der Klitoris und der Klitorisvorhaut. Obwohl sich statistische Kennwerte etablieren ließen, zogen sie den Schluss, ein „normales“ Aussehen, eine typische Vulva gebe es nicht, zu groß sei die physiologische Spannbreite innerhalb einer gesunden weiblichen Population. Eine weitere, ebenfalls 2018 veröffentlichte Studie an der University of Colorado School of Medicine untersuchte die gleiche Frage speziell bei Jugendlichen (Mädchen 10–19 Jahre) und kam zum gleichen Ergebnis.[19]
| gemessene Eigenschaft | Spannweite (in mm) | Mittelwert (Standardabweichung) |
|---|---|---|
| sichtbare Länge der Klitoris | 5–35 | 19,1 (8,7) |
| Breite der Glans clitoridis (Eichel) | 3–10 | 5,5 (1,7) |
| Abstand zwischen Klitoris und Harnröhrenöffnung (CUMD) | 16–45 | 28,5 (7,1) |
| Länge der äußeren Schamlippen
(von vorn nach hinten) |
70–120 | 90,3 (10,3) |
| Länge der inneren Schamlippen
(von vorn nach hinten) |
20–100 | 60,6 (17,2) |
| Breite der inneren Schamlippen
(vom Ansatz bis zum freien Ende) |
7–50 | 21,8 (9,4) |
| Länge des Damms | 15–55 | 31,3 (8,5) |
| Farbe der Vulva im Vergleich zur umgebenden Haut | Anzahl der Frauen |
|---|---|
| gleich | 9 |
| dunkler | 41 |
| Faltung der inneren Schamlippen | |
| glatt | 14 |
| mäßig | 34 |
| ausgeprägt | 2 |
Der Scheideneingang und seine Gebilde
Die inneren, kleinen Schamlippen umfassen den Scheidenvorhof, Vestibulum vaginae, in den die Harnröhre, Urethra femina, mündet. Im unteren Drittel der kleinen Schamlippen sind die beiden großen Vorhofdrüsen oder auch Bartholin-Drüsen, Glandulae vestibulares majores, und mehrere kleine Vorhofdrüsen (Glandulae vestibulares minores) eingebettet. Sie sorgen für die Befeuchtung des Scheidenvorhofes.[7] Es ist die unmittelbare Umgebung der Mündungsöffnung, Meatus urethrae externus, der Harnröhre, in die auch die Paraurethraldrüsen (auch Skene-Drüsen genannt) einmünden: Diese sondern im Rahmen der sogenannten weiblichen Ejakulation ein dünnflüssiges Sekret ab. Ebenfalls im Vestibulum vaginae befinden sich die Öffnungen der Bartholin-Drüse, Glandula vestibularis major, der großen Scheidenvorhofdrüse, die als paarige akzessorische Geschlechtsdrüse auftritt. Auch sie sondert, aber zu einem anderen Zeitpunkt, bei der sexuellen Erregung ein Sekret ab.[21][22]


Darunter folgt der Eingang zur Vagina, Introitus vaginae, in der Tieranatomie Ostium vaginae. Er ist funktionell ein vaginaler Sphinkter. Bei Kontraktion der umgebenden Skelettmuskulatur, (Musculus ischiourethralis, Musculus ischiocavernosus, Musculus bulbospongiosus) und auch durch Schwellung (Tumeszenz) kommt es zu einer Einengung der ringförmigen anatomischen Struktur. Einrisse und Mikroverletzungen können zur Dyspareunie führen. An der scheidennahen Übergangszone zwischen den kleinen Schamlippen, Labia minor pudendi, hin zum Scheideneingang, Introitus vaginae, finden sich in unterschiedlicher Ausprägung die Carunculae hymenales. Denn der Scheideneingang ist bei manchen Frauen von einer Hautfalte umschlossen, die als Hymen bezeichnet wird.[24] Nach stärkerer Dehnung, üblicherweise nach einer Geburt, kann das Hymen zu den Carunculae hymenales vernarben.[25][26][27][28] Die Vulva wird über Äste der Arteria pudenda interna mit Blut versorgt, die Nerven der Vulva stammen aus Ästen des Nervus pudendus (Nervi labiales, Nervus dorsalis clitoridis).[29] Der Scheideneingang und die sich anschließende Vulva stellen das Ende des Geburtskanales dar.
Nervenversorgung der Vulva und des Scheideneingangs
Die somatische Innervation über das willkürliche Nervensystem ermöglicht eine weitgehend willentliche Betätigung durch diese Nerven. Der wichtigste Nerv hierfür ist der Nervus pudendus, deutsch auch „Schamnerv“, er entspringt dem Plexus sacralis aus den Rückenmarkssegmenten S1–S4 (1.–4. Kreuzsegment) und versorgt mit allgemein-somatosensiblen und somatomotorischen Fasern größtenteils die weiblichen Geschlechtsorgane. Der Nerv verläuft in der Beckenhöhle kaudoventral, also nach unten-bauchwärts, in Richtung Beckenboden (Beckenausgang), zusammen mit der Arteria und Vena pudenda interna über das Foramen infrapiriforme in den Canalis pudendalis („Alcock-Kanal“). Der Nervus pudendus hat mehrere Äste:
- Nervi rectales inferiores (caudales), sie innervieren die Umgebung des Anus und den Musculus sphincter ani externus (äußerer Afterschließmuskel).
- Nervi perineales, auch „Dammnerven“ genannt, versorgen sensibel den Damm (Perineum) und motorisch die Muskeln (Musculus ischiourethralis, Musculus ischiocavernosus, Musculus bulbospongiosus). Der Musculus bulbospongiosus ist ein Schließmuskel, der die Vulva und den Scheidenvorhof, Introitus vaginae, umschließt. Er wird daher auch in Musculus constricor vulvae und Musculus constricor vestibuli unterteilt. Der Musculus ischiocavernosus hemmt durch seine Kompressions- oder Kontraktionsarbeit den venösen Blutabfluss aus dem Corpus cavernosum clitoridis durch die Vena profunda clitoridis und verbessert dadurch die Kongestion im gesamten Klitorisorgan. Zudem versorgen sie den quergestreiften Muskel um die Harnröhre, Musculus urethralis. Die Nervi perineales versorgen darüber hinaus über die Nervi labiales die kleinen Schamlippen, Labia minora pudendi.[30][31]
- Nervus dorsalis clitoridis, als „Kitzlerrückennerv“ bezeichnet, ist der direkte Endast des Nervus pudendus und der wichtigste sensible Nerv der Klitoriseichel, Glans clitoridis.
Ein weiterer wichtiger Nerv ist der Nervus ilioinguinalis, der dem Lendenteil, Plexus lumbalis des Lenden-Kreuz-Geflechts (Plexus lumbosacralis) auf der Höhe der Segmente Th12 bis L1 entspringt. Auch er führt allgemein-somatosensible und somatomotorische Fasern und innerviert Teile der Bauchmuskulatur sowie die Haut der großen Schamlippen, Labia majora pudendi. Seine zwei Äste sind:
- Rami musculares, sie versorgen die unteren Abschnitte der Bauchmuskulatur, den Musculus transversus abdominis und den Musculus obliquus internus abdominis.
- Nervi labiales anteriores, sie versorgen die großen Schamlippen, Labia majora pudendi. Seine sensiblen Äste versorgen ebenfalls die Haut am Unterbauch.
Zusammenfassend kann man die Allgemein-Somatosensibilität wie folgt beschreiben: Der Schamhügel, Mons pubis, und der obere, in Richtung zur Klitorisvorhaut liegende Teil der großen Schamlippen, Labia majora pudendi, werden über den Nervus ilioinguinalis versorgt. Er entstammt dem Rückenmarkssegment auf der Höhe L1. Hingegen wird der untere, in Richtung zum Damm, und der hintere Anteil der großen Schamlippen, Labia majora pudendi, die Klitoris und die kleinen Schamlippen, Labia minora pudendi, von den Nervi labiales posteriores aus dem Nervus pudendus innerviert. Sie entspringen den Rückenmarkssegmenten auf der Höhe S2–S3.
Die Innervation durch das vegetative Nervensystem erfolgt vor allem durch den Plexus uterovaginalis, ein autonomes Nervengeflecht (Plexus) im kleinen Becken der Frau, das u. a. Gebärmutter und Vagina innerviert.[32] Hier befinden sich auch die sogenannten Frankenhäuser-Ganglien. Räumlich-anatomisch grenzt er dicht an den Plexus hypogastricus inferior. Der Plexus hypogastricus inferior enthält aber nicht nur sympathische, sondern auch parasympathische Fasern und steht mit dem Plexus aorticus abdominalis und dem Plexus hypogastricus superior in Verbindung. Aus letzterem gelangen die sympathischen Fasern beidseits über den Nervus hypogastricus zum Plexus hypogastricus inferior. Die Umschaltung auf das zweite Neuron der sympathischen Fasern erfolgt nicht nur im Plexus hypogastricus inferior, sondern auch teilweise im Ganglion mesentericum inferius. Die parasympathischen Nervenfasern entstammen den zweiten bis vierten Sakralnerven und gelangen über die Nervi splanchnici pelvici zum Plexus hypogastricus inferior.
Das vegetative Nervensystem regelt zur Aufrechterhaltung des inneren Gleichgewichts (Homöostase) lebenswichtige Funktionen (Vitalfunktionen) wie Herzschlag, Atmung, Verdauung und Stoffwechsel und somit auch die Funktionen von Organen und Organsystemen, auch von Sexualorganen, den endokrinen Drüsen (Hormone), den exokrinen Drüsen (etwa Schweißdrüsen), dem Blutgefäßsystem (Blutfülle oder Kongestion, Blutdruck) und Ähnlichem.[33][34] Sexuelle Stimulation wird über den Nervus pudendus, genauer den Nervus dorsalis clitoridis und die Nervi labiales zu den parasympathischen Kernarealen im sakralen Rückenmark geführt. Von hier werden reflektorisch über die parasympathischen Nervenfasern, die Nervi splanchnici pelvici, Impulse zu den klitoralen Schwellkörpern und den Introitus vaginae geführt, die durch eine Zunahme der Blutfülle erigieren oder sich zumindest vergrößern.[35] Gleichzeitig aktivieren die parasympathischen Nervenfasern die muköse Schleimsekretion in den akzessorischen Geschlechtsdrüsen. Aber auch die Vergrößerung im hinteren Scheidengewölbe, Fornix vaginae, und die Aufrichtung der Gebärmutter, Uterus, gehört zu den reflektorischen Antworten der sexuellen Stimulation.
Ausgangspunkte dieser sexuellen Erregung sind die am Introitus vaginae, der nach innen, medial liegenden Flächen der kleinen Schamlippen, der Carina urethralis vaginae und Klitoris gelegenen korpuskulären Rezeptoren,[36] so der Ruffini-Körperchen, Merkel-Körperchen und der Vater-Pacini-Körperchen und freie Nervenendigungen (Mechanorezeptoren der Haut). Solche Strukturen fehlen im Inneren der Vagina oder sind nur sehr gering vorhanden.[37]
Mikroskopische Anatomie
Feingeweblich bestehen die obersten Schichten der meisten Vulvaanteile aus mehrschichtigem nichtverhornten Plattenepithel, welches in höherem Lebensalter jedoch zur Verhornung und Atrophie neigt. Die Innenseiten der inneren Schamlippen weisen ein unverhornendes, die Außenseiten ein schwach verhornendes Plattenepithel auf. Ein mehrschichtiges, meist verhorntes Plattenepithel findet sich als Bedeckung der Innenseiten, ein verhorntes an den Außenseiten der äußeren Schamlippen. In der Lamina propria des Scheidenvorhofs sind Talgdrüsen eingelagert, die einen Schutzfilm gegen die Einwirkung des Urins bilden. Solche Talgdrüsen finden sich auch in den inneren und äußeren Schamlippen. Letztere weisen zusätzlich Haarwurzelzellen, Schweißdrüsen und glatte Muskelzellen auf. Besonders viele sensible Nervenfasern und -endigungen, so etwa das Meissner-Körperchen, findet man in den Schamlippen und der Klitoris.[38][39]
-
Aufbau der weiblichen Haut (Vulva) mit ihren Hautanhangsgebilden; die Anhangsgebilde sind unterschiedlich über die jeweiligen anatomischen Strukturen verteilt
-
Ein Meissner-Körperchen (Spitze des schwarzen Zeigers) im Lichtmikroskop. Seine Lokalisation im Stratum papillare des Coriums ist gut zu erkennen.
Das Vestibulum vaginae wird nach innen hin, also nach medial, vom äußeren Anteil des Hymenalrings begrenzt. Nach unten, also Richtung Anus, und seitlich, lateral, von der sogenannten Hart-Linie[40] oder Hartschen Linie. Sie ist makroskopisch nicht sichtbar. Sie stellt den lateralen Rand des Vestibulum vaginae dar und beschreibt (histologisch) den Übergang vom nicht-verhornten Plattenepithel zum gering-verhornten Epithel.[41] Sie ist die Grenze zwischen „Innen“- und „Außenwelt“ (Endoderm und Ektoderm).[42]
Vergleichende Anatomie
Als Vulva werden in der Regel ausschließlich die äußeren Geschlechtsorgane der höheren Säugetiere benannt, obwohl die Bezeichnung in der wissenschaftlichen Literatur auch für funktionell vergleichbare (analoge) Strukturen bei anderen Tiergruppen wie etwa Fadenwürmern (Nematoda) verwendet wird.[43]
Bei den Säugetieren, mit Ausnahme der Kloakentiere, ist der Ausgang der Harn- und Geschlechtsöffnung vom Darmausgang durch den Damm (Perineum) getrennt. Kloakentiere besitzen keine Vulva und keine Vagina, die beiden Gebärmütter (Uteri) und die Harnröhre münden gemeinsam mit dem Darm in eine Kloake. Kloaken werden während der Embryonalentwicklung bei allen Säugetieren einschließlich des Menschen angelegt. Bei den Beutel- und Plazentatieren wird sie später durch eine Gewebsschicht, das Septum urogenitale, in einen vorderen Bereich mit den Geschlechtsorganen und der Harnblase und einen hinteren Bereich mit dem Darmausgang getrennt.[44]
-
Anus, Damm und (leicht gespreizte) Vulva einer Hauskatze
-
Anus, Damm und Vulva eines Pferdes (Haflinger-Stute)
-
Orang-Utan (Pongo pygmaeus)
-
Vulva einer asiatischen Elefantenkuh (Elephas maximus)
Der prinzipielle Aufbau der Vulva unterscheidet sich innerhalb der Säugetiere nur wenig. Eine maßgebliche Besonderheit der menschlichen Vulva besteht im Vorhandensein der äußeren, großen Schamlippen, Labia majora: Die meisten Säugetiere besitzen nur ein Paar Schamlippen, das vergleichend-anatomisch den kleinen Schamlippen, Labia minora der Frau, als Homologie, entspricht.[29] Auch wölbt sich das Schambein bei Tieren nicht als Venushügel vor.[45] Der Scheidenvorhof ist bei den meisten Tieren deutlich länger als der von den Schamlippen eingegrenzte Raum, so dass der Scheidenvorhof in den Nomina Anatomica Veterinaria nicht zur Vulva gerechnet wird. Das Hymen, das bei vielen Säugetieren nur eine zarte Ringfalte darstellt, gehört demzufolge ebenfalls nicht zur Vulva. Die Kitzlervorhaut ist bei zahlreichen Säugetieren fest mit der Eichel verwachsen, so dass keine Kitzlergrube ausgebildet ist.[29] Die Vulva kann bei den meisten Säugetieren durch den quergestreiften Musculus constrictor vulvae verengt werden.[46]
Eine Besonderheit des (vergleichbar wie beim Menschen) individuell recht variabel ausgebildeten Genitalbereiches ist bei weiblichen Unpaarhufern wie Equiden (Pferden, Eseln und Zebras) und Tapiren[47] das sogenannte Blitzen oder Blinken (engl. „winking“) der Vulva, ein rhythmisches Öffnen und Schließen der Schamlippen mit Sichtbarwerden der Klitoris während der Paarungsbereitschaft und zumeist nach dem Urinabsatz (siehe auch Pheromone).[48]
Zum Vergleich verfügen Wirbeltiere wie Vögel, Reptilien (Sauropsida) oder auch die basalen Säugetiere (Protheria),[49] so die Kloakentiere, über eine Kloake und deren entsprechende äußere Ausformung. Ein Organ wie eine Vulva besteht nicht. Während bei den höheren Säugetieren die Kloake nur embryonal angelegt wird und sich im weiteren Verlauf der ontogenetischen Entwicklung in getrennte Körperöffnungen für den Darm sowie für den Urogenitaltrakt differenziert, dauert diese embryonale Entwicklungsphase bei den zu Anfang genannten Wirbeltiergruppen bis zur Entwicklung eines beständigen Organsystems fort.[50]
-
Kloake eines weiblichen Vogels.
-
Kloake eines männlichen Vogels zum Vergleich.
-
Sichtbare Kloake des Rotschwanzbussards.
-
Persistierende Kloake beim Menschen (weibliche Genitalien).
Gelegentlich aber treten Atavismen etwa in Form einer fortbestehenden Kloake beim Menschen auf.[51]
Ontogenetische Entwicklung
Die Entwicklung der äußeren Genitalien bei der Frau startet mit einer sexuell indifferenten Phase. Dann ab der 12. Schwangerschaftswoche (SSW) endet die Differenzierung für die beiden Geschlechter. In der indifferenten Phase werden zunächst folgende anatomische Strukturen angelegt:
- Genitalhöcker, sie liegen ventral von der Kloakenmembran
- Genital- oder Urethralfalten, sie sind beidseits der Kloakenmembran (Kloake)
- Genitalwülste oder Labioskrotalwülste, sie entfalten sich lateral der Genitalfalten
Zwischen den Genitalfalten wird zunächst die Urogenitalmembran ausgebildet, die das Ostium urogenitale erst einmal verschließt. Nachdem das Septum urorectale mit der Kloakenmembran verwachsen ist, reißt die Membran ein und gibt das Ostium frei. Der Genitalhöcker wächst bei beiden Geschlechtern zunächst in die Länge und wird zu einem zylindrischen, im Wesentlichen aus heranreifendem Schwellkörpergewebe gebildeten Organ.
Dieses zylindrische Gebilde wächst beim weiblichen Geschlecht nicht weiter und bleibt als Klitoris bestehen, beim Mann differenziert es sich zum späteren Penis. Der Genitalhöcker, Tuberculum genitale, ist die ursprüngliche und gemeinsame Anlage von Klitoris und Penis. Er entsteht durch eine Wucherung des Mesenchyms kranioventral (kopf-bauchseitig) der Kloakenmembran. Unter Androgeneinfluss verlängert sich der Phallus bei männlichen Individuen und die Urogenitalrinne schließt sich zur Pars spongiosa der Harnröhre und bildet den Harnröhrenschwellkörper. Bei der späteren Frau bleibt der „Protophallus“ kurz und differenziert sich zur Klitoris. Die Urogenitalfalten bleiben bei den weiblichen Individuen getrennt und bilden die inneren, kleinen Schamlippen. An der Unterseite dieses „Protophallus“ entsteht die Urogenitalrinne, Sulcus urogenitalis, die von den beiden Urogenitalfalten, Plicae urogenitales, begrenzt wird. Seitlich des Genitalhöckers entstehen die erwähnten Geschlechtswülste – die gemeinsame Anlage der äußeren, großen Schamlippen, Labia majora, aber auch des Hodensacks, Scrotum. Die Genitalfalten verschmelzen nun im hinteren Abschnitt zum Frenulum labiorum pudendi, aus ihnen gehen später die kleinen Schamlippen, Labia minora, hervor.
Die Gewebe der Genitalwülste vereinigen sich somit vorne und hinten, wo sie die Commissura labiorum anterior und posterior und damit auch den späteren Schamhügel, Mons pubis, entstehen lassen. Auch die großen Schamlippen, Labia majora, haben hier ihren Ursprung.
Pränatal


Während der ersten acht Wochen der Embryonalentwicklung weisen männliche und weibliche Embryonen die gleichen rudimentären Geschlechtsorgane auf. Dieser Zeitraum wird daher auch als indifferentes Stadium bezeichnet. In der sechsten Woche entwickeln sich der Genitalhöcker sowie die Anlagen des Harntrakts. Nach der achten Woche setzt die Hormonproduktion des Embryos ein und die Geschlechtsorgane beginnen, sich in verschiedene Richtungen zu entwickeln. Dennoch sind die Unterschiede bis zur zwölften Woche nahezu nicht sichtbar. Wenn Testosteron gebildet wird und die Rezeptoren (Steroidrezeptor) im Gewebe intakt sind, entwickelt sich unter dessen Einfluss ein männliches äußeres Genitale. Fehlt das Testosteron, kommt es zur Ausbildung eines weiblichen Genitales. Im Laufe des dritten Monats entwickelt sich aus dem Genitalhöcker die Klitoris. Die Urogenitalfalten bilden sich zu den inneren Schamlippen, der Labioskrotalwulst zu den äußeren Schamlippen aus.[27][52]
Neo- und postnatal
Direkt nach der Geburt sind die äußeren sichtbaren Strukturen der Genitalien oftmals geschwollen und weisen eine überproportionale Größe auf. Dies ist auf eine mitunter hohe Exposition von mütterlichen Hormonen zurückzuführen. Die Schwellung geht in der Regel wenige Tage nach der Geburt wieder zurück und die Vulva nimmt die normale Größe ein. Nachfolgend wird sich die Vulva während der gesamten Kindheit bis zum Beginn der Pubertät strukturell kaum verändern, außer dass sie proportional zum gesamten Körper mitwächst.[53]
Entwicklung in der Pubertät
In der Pubertät unterliegt die Vulva einer deutlichen Veränderung, da auch das äußere Genitale auf Geschlechtshormone reagiert. Die Hautfarbe (Pigmentierung) verändert sich, und die Strukturen der Vulva werden größer und ausgeprägter. Diese Entwicklung betrifft die Klitoris und die inneren und äußeren Schamlippen, ganz besonders jedoch die hormonempfindliche Haut der Vagina und deren Vorhof. Im Bereich der Vulva, das heißt auf dem Venushügel und den äußeren Schamlippen, beginnt mit der Pubertät das Wachstum der Schamhaare.
Die Gestalt der Vulva ist individuell verschieden. So kann die Klitoris teilweise sichtbar oder ganz verdeckt sein oder es können die inneren Schamlippen größer sein als die äußeren. Diese Unterschiedlichkeit ist keine krankhafte Erscheinung, sondern normal.[54]
Veränderungen nach den Wechseljahren
Nach der Menopause kann es zu unterschiedlich ausgeprägten dystrophen Veränderungen der Vulva kommen, insbesondere einem Schwund des Fettgewebes mit einer Verringerung der Hautdicke.[55][56] Es kommt zu einer Rückbildung der Schamlippen,[57] einer Verkleinerung der Klitoris, zu einer Verengung des Vaginaleingangs und zu trockenerer Haut der Vulva.[58] Diese Veränderungen werden durch den Rückgang der körpereigenen Östrogenproduktion verursacht, obwohl das Vulvagewebe deutlich geringer auf Östrogene anspricht als das anderer Organe.[58]
Physiologie

Physiologische Veränderungen der Vulva in ihrer Gesamtheit treten vor allem vor und während des Geschlechtsverkehrs sowie während der Geburt des Nachwuchses auf. Aufgrund ihrer Ausstattung mit Talg-, apokrinen Schweiß- und Duftdrüsen kommt es vor allem in den Bereichen zwischen den Schamlippen, der Klitoris und des Scheidenvorhofs zu ständiger Bildung von Talg und Schweiß, die für eine Befeuchtung der Schleimhäute der Genitalien sorgen. Talgreste können sich mit Verunreinigungen in den Schleimhautfalten der Vulva absetzen und das sogenannte Smegma bilden. Das Smegma der Vulva ist ein Talgdrüsensekretgemisch, welches aus den Tyson-Drüsen stammt, einer Form freier (ektopischer) Talgdrüsen, die nicht an Haarfollikel oder einen Haarbalg münden, und die sich in den Hautfalten zwischen äußeren und inneren Schamlippen sowie um die Klitorisvorhaut (Praeputium clitoridis) herum befinden. Gerade durch diese Hautfalten, die eng aufeinander liegen, werden Wärmeabgabe, Verdunstung von Flüssigkeit und Abtransport des abgeschlifferten Epithels behindert, so dass ein feuchtwarmes, vorwiegend anaerobes Milieu mit einem neutralen bis leicht alkalischen pH-Wert entstehen kann. Hier ist auch der Ort, an dem vermutlich eine Vielzahl von Pheromonen freigesetzt wird.[59] Zu den am intensivsten studierten Pheromonkandidaten der Primaten zählen die Kopuline. Dieses sind Gemische flüchtiger, kurzkettiger Fettsäuren (aliphatische Monocarbonsäuren),[60] die im weiblichen Vaginalsekret zyklusabhängig auftreten.[61] Kopuline wurden zuerst von Richard Michael und Kollegen[62][63] Ende der 1960er beziehungsweise Anfang der 1970er Jahre bei Rhesusaffen beschrieben.[64]
Veränderung der Vulva während des Sexualzyklus

Bei vielen Säugetieren treten auch während des Sexualzyklus Veränderungen der Vulva auf, deren Ausmaß artspezifisch und individuell variiert. Die Brunftphase tritt dabei entweder jährlich einmal (monöstrisch) oder mehrmals (polyöstrisch) auf. Die Konzentration des Hormons Östrogen ist dann im Vergleich zum Progesteron im Blut in dieser Phase am höchsten. Zu Beginn der Brunst (Östrus) kommt es bei den allermeisten Säugetieren, neben anderen physiologischen Veränderungen wie der Mehrproduktion von Zervixschleim u. a. m., zu einer Anschwellung und Rötung der Vulva durch eine verstärkte Durchblutung,[29] wie dies beispielsweise bei der Regelschwellung verschiedener Primaten zu beobachten ist.
Bei der Frau fördern Östrogene die Entwicklung und das Wachstum der kleinen Schamlippen, Labia minora pudendi, ferner eine Erhöhung der Vaskularisation und allgemein der Tumeszenz der Vulva mit einer Proliferation des sie bedeckenden Epithels. Darüber hinaus stimulieren die Östrogene die akzessorischen Geschlechtsdrüsen, so etwa die Bartholinschen Drüse, Glandula vestibularis major, aber hemmen die Talgdrüsen.[65] Im Gegensatz dazu stehen die großen Labien, die Klitoris und der Mons pubis mehr unter dem zusätzlichen Einfluss von Androgenen. So fördern die Östrogene die Verhornung der Keratinozyten in der Vulvaepidermis, Androgene und Progesteron hingegen hemmen sie.
Abstand zwischen Vagina und Eichel der Klitoris
Gemessen wird der Abstand der Frenula clitoridis an der Klitoriseichel von der im Scheidenvorhof befindlichen Harnröhrenöffnung, die sogenannte CUMD (clitoral-urinary meatus distance).
Marie Bonaparte führte in den 1920er Jahren bei Frauen Befragungen durch, ob sie beim Koitus einen Orgasmus bekommen. Als Ursachen für mangelnde sexuelle Erregung waren zwar Abneigung oder psychische Hemmungen bekannt. Unter den Probandinnen gab es jedoch Frauen, die bei einem Mann, den sie liebten und begehrten, „bei gewissen zärtlichen Berührungen höchste Lust empfinden“, jedoch beim Koitus nicht genügend erregt wurden. Bonaparte untersuchte bei 200 Frauen den Abstand zwischen der Klitoriseichel und der Vagina. Bei 69 % der Frauen betrug die CUMD 1,25 bis 2,25 cm, die meisten davon erlebten den Sexualakt lustvoll und befriedigend. 10 % der Frauen hatten 2,5 cm Abstand. Bei 21 % wurden 2,75 bis 3,5 cm gemessen. Alle Frauen mit großem Abstand gaben an, dass sie durch penile Penetration keinen befriedigenden Genuss erleben, obgleich manche angaben, auf „präzises Streicheln des Mannes“ sehr sensibel zu reagieren. Bonaparte deutete das so, dass es einen anatomischen Kausalzusammenhang zwischen einer großen CUMD und der „vaginalen Frigidität“ gäbe, weshalb es nur für Frauen, bei denen die Klitoriseichel nah am Scheideneingang liege, (so dass sie kontinuierlich vom Penis berührt wird), möglich sei, beim Koitus „die höchste sexuelle Lust“ zu erleben.[66][67]
-
Glans clitoridis mit kleinem Abstand zur Öffnung
-
Kontakt zum Penis bei sehr kleinem CUMD
-
Glans clitoridis mit mittlerem Abstand
-
Fehlender Kontakt der Klitoriseichel zum Penis
-
Einteilung der 200 Frauen in CUMD-Kategorien
-
Auswahl untersuchter und befragter Frauen
Eine Studie von Carney Landis und Kollegen 1940 beinhaltet entsprechende Aussagen: „Auf der physischen Seite hängt die Orgasmusfähigkeit mit dem Abstand zwischen Klitoris und Meatus zusammen.“ (Landis et al. 1940).[68][69]
2011 überprüften Kim Wallen[70] und Elisabeth Lloyd Bonapartes Forschungen und bestätigten eine inverse Korrelation zwischen CUMD und Orgasmus durch penetrativen Geschlechtsverkehr.[71] Bei den seit den 70er Jahren von Betty Dodson gelehrten Methoden soll die sexuelle Erregung der Frau beim Intimverkehr sichergestellt werden, indem die Frau selbständig kontinuierlich ihre Vulva und Klitoris mit ihren Händen oder mit einem Vibrator stimuliert.[72] Laut Kim Wallen sagt die CUMD nichts über ein glückliches Sexualleben aus, vielmehr gäbe ein großer Abstand den Paaren Gelegenheit, „beim Sex etwas erfinderischer zu sein“.[73]
Veränderung der Vulva im sexuellen Reaktionszyklus und beim Geschlechtsakt
Mit dem Einsetzen sexueller Erregung kommt es zu zahlreichen physiologischen Veränderungen der Vulva, die zusammengenommen den weiblichen Genitaltrakt auf den Geschlechtsverkehr vorbereiten. Die Reaktionen werden in verschiedene, zeitlich aufeinander folgende Phasen eingeteilt: die Erregungsphase, Plateauphase, Orgasmusphase und Rückbildungsphase.

Die Erregungsphase kann sich über mehrere Stunden hinziehen und wird durch mechanische Stimulation oder sexuell erregende Stimuli (auch psychische wie zum Beispiel sexuelle Vorstellungen oder Träume) ausgelöst. Die Phase zeichnet sich durch eine verstärkte Durchblutung der Strukturen der Vulva aus. Diese wird durch eine Vasokonstriktion der ableitenden, venösen Blutgefäße hervorgerufen, sie führt zu einem Anschwellen der Klitoris und der Vorhofschwellkörper (Erektion), die Haut färbt sich dunkler.
Es kommt zum Einsetzen der Lubrikation, das heißt einer zunehmenden Absonderung von Sekret aus den akzessorischen Geschlechtsdrüsen, die sich in der Plateauphase verstärkt. Die Lubrikation dient der Befeuchtung von Vagina und Schamlippen und erleichtert die Penetration sowie das Gleiten des Penis in die Vagina. Die mechanische Reizung der Vaginalhaut durch den eingeführten Penis verstärkt die Erektion der Vulva und führt zur Schwellung der unteren Scheidenwand.
Die Orgasmusphase ist von Muskelkontraktionen der Beckenbodenmuskulatur begleitet. Unmittelbar vor dem Orgasmus zieht sich die Eichel der Klitoris unter die Klitorisvorhaut zurück. Die Klitoris ist direkt nach dem Orgasmus oft sehr empfindlich, zusätzliche Stimulation mitunter unangenehm.
In der dem Orgasmus folgenden Rückbildungsphase kommt es wieder zu einem durch Vasodilatation bedingten Abfluss des Blutes aus der Region. Die Strukturen schwellen wieder ab, die Feuchtigkeit geht zurück und der Normalzustand stellt sich wieder ein.[74][75]
Veränderungen der Vulva in der Schwangerschaft

Vor allem im letzten Drittel der Schwangerschaft kommt es bei vielen Frauen zu einer vermehrten Pigmentierung der Linea alba (dann, je nach Ausprägung der Verfärbung, als Linea nigra (schwarze Linie), oder auch Linea fusca (braune Linie) bezeichnet), der Brustwarzenhöfe (Areolae) und der Vulva. Diese wird vermutlich durch eine vermehrte Sekretion des melanozyten-stimulierenden Hormons hervorgerufen.[76] Diese zählen zu den wahrscheinlichen Schwangerschaftszeichen. Außerdem kann es durch eine Stauung der Venen im Becken zu Schwellungen und zur Bildung von Krampfadern im Bereich der Vulva kommen (Varicosis vulvae gravidarum oder Varicosis vulva in graviditate).[77][54]
Veränderung der Vulva während der Geburt
Während der Geburt kommt es durch die Wehen und die damit verbundene Öffnung des Muttermundes und des Geburtskanals (Eröffnungsphase der Geburt) vor allem zu einer Aufweichung der Vaginalmuskulatur, die die Dehnung beim späteren Geburtsvorgang (Austreibungsphase der Geburt) ermöglicht. Diese Dehnung betrifft zudem die Vorhofschwellkörper sowie das Gewebe der Schamlippen und des Damms, der unter der Belastung reißen kann (Dammriss) und bei der Geburt unter Umständen eingeschnitten wird (Dammschnitt).
Physiologisches Mikrobiom der Vulva
Jede menschliche Körperoberfläche sowie jede nach außen verbundene Körperinnenfläche besitzt ihr individuelles Bakteriom. Das ist der Anteil der bakteriellen genetischen Information am Mikrobiom.

Das natürliche Mikrobiom bezeichnet – hier am System Vagina-Vulva – im weiteren Sinne die Gesamtheit aller den Menschen besiedelnden Mikroorganismen. Im engeren Sinn wird hierdurch die Gesamtheit aller mikrobiellen Gene oder Genome-(DNA) im menschlichen Organismus bezeichnet und vom Begriff der Mikrobiota unterschieden, die alle Mikroorganismen bezeichnen.[78] Die Haut der Vulva ist dünner als an anderen Körperregionen,[79] so weist die Epidermis etwa nur eine schmale Verhornungszone auf. Während die großen Schamlippen, Labia majora, mit Haaren oder Haarfollikeln durchsetzt sind, die von Talg- und apokrinen Drüsen begleitet werden, finden sich auf den Labia minora nur Talgdrüsen, aber keine Haare oder Haarfollikel. Diese anatomischen Charakteristika nehmen Einfluss auf die Zusammensetzung des entsprechenden Mikrobioms.[80]
Auch die Vulva im Anschluss an die Vagina ist wie die übrigen Körperregionen von einer Bakterienflora oder einem Mikrobiom besiedelt, die in ihrer Zusammensetzung interindividuell nur wenig schwanken, aber vom weiblichen Hormonzyklus abhängen. Sie stellen die physiologische oder Normalflora dar. Ein „gesundes“ oder physiologisches Mikrobiom entscheidet häufig über Gesundheit oder Krankheit der Vulva.[81]
Die Vagina mündet mit der Scheidenöffnung, Ostium vaginae oder Introitus vaginae, in den Scheidenvorhof, Vestibulum vaginae, der die „Verbindungszone“ zwischen Vagina und Vulva darstellt. Hier treten Änderungen des pH-Wertes auf. Das Vaginalepithel baut sich unter dem Einfluss von Östrogenen zyklisch auf, was zur intrazellularen Speicherung von Glykogen im Epithel führt, das als Nahrung der vorherrschenden Lactobacillusflora (Döderlein-Bakterien) dient, den dominierenden Keimen in der Vagina.[82] Zur Normalflora der Vagina gehören die fakultativen Organismen wie Lactobacillen, Corynebakterien, Propionibakterien, Streptokokken Gruppe B, E. coli, Staphylococcus epidermidis und Gardnerella vaginalis, Veillonella, sowie Anaerobiern wie Peptococcus, Peptostreptococcus und Bacteroides. Aber auch vereinzelte Hefen, etwa der Candidagruppe lassen sich finden.[83] Kommt es zu einer Störung dieses komplexen Gleichgewichts, sind potentiell pathogene Organismen in der Lage, sich im Übermaß zu vermehren und können dann zu Krankheitssymptomen der Vagina, Vaginitis (Bakterielle Vaginose) oder Vulvovaginitis führen. Die vaginale Normalflora hat Einfluss auf die Bakterienbesiedlung an der Vulva (Hautflora).
Das Smegma der Vulva ist ein Talgdrüsensekretgemisch mit abgeschliffertem Epithel, das sich in den oberflächenreichen Hautfalten zwischen äußeren und inneren Schamlippen und um die Klitorisvorhaut, Praeputium clitoridis, herum befindet. In diesen interlabialen Nischen entsteht ein feuchtwarmes, vorwiegend anaerobes Milieu mit einem neutralen bis leicht alkalischen pH-Wert. Von der Größe (Oberfläche) der eng aufeinanderliegenden Hautfalten hängt letztlich der Grad der Wärmeabgabe und Verdunstung von Transsudaten und Schweiß ab. Diese physikalischen Faktoren beeinflussen das Mikrobiom der Vulvaoberfläche.
Das Smegma setzt sich aus Zelldetritus des abgestorbenen und abgeschlifferten Oberflächenepithels, Fettsäuren, Steroidderivaten (etwa Cholesterinestern), Proteinen und Mikroorganismen zusammen. Wie überall im und am menschlichen Organismus gibt es eine spezifische und typische mikrobielle Standortflora, etwa Hefen der Gattung Malassezia oder das zu den Mykobakterien zählende Mycobacterium smegmatis, auch „Smegmabakterium“ genannt (siehe auch Mikrobiom des Menschen).
Medizinische Aspekte
Fehlbildungen
Vulvafehlbildungen gehören zu den Genitaldysplasien. Sie zeigen sich überwiegend im Bereich des Scheidenvorhofs. Hier finden sich insbesondere Formen des Hymens, die den Scheideneingang großflächig oder, bei der Hymenalatresie, vollständig verschließen. Im Bereich der Harnröhrenmündung kommen Anomalien wie Stenosen, Hypo- und Epispadien vor. Eine Klitorishypertrophie kann ebenfalls als Fehlbildung vorliegen oder Zeichen einer hormonellen Störung im Rahmen anderer Erkrankungen sein.[84][85] Verklebungen der großen Schamlippen, sogenannte Labiensynechien, werden durch die hormonelle Ruhe im Kindesalter oder durch Entzündungen verursacht. Sie stellen daher eher eine entzündliche Erkrankung dar.[85][86][87][88][89]
Erkrankungen
An der Vulva können eine Reihe unterschiedlicher Erkrankungen auftreten, die zum Teil auch das innere Genitale einbeziehen können.[90][91]
Entzündungen, Infektionen und Infestationen
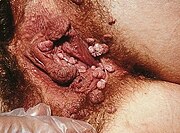
Die in ihrem Aufbau unterschiedlichen Hautregionen mit verhornter und haartragender Haut im Bereich der äußeren Schamlippen und des Venushügels, der feineren Haut der kleinen Schamlippen sowie der feuchten Schleimhaut im Scheidenvorhof, Vestibulum vaginae oder Introitus vaginae, führen gemeinsam mit der Analregion aufgrund ihres Mikroklimas und der hohen Feuchtigkeit zu häufigeren Erkrankungen als andere Körperregionen.[92] Akute und chronische Entzündungen gehören zu den häufigsten Erkrankungen der Vulva. Betreffen diese Entzündungen nur das äußere Genitale, werden sie als Vulvitis bezeichnet; häufiger ist eine gemeinsame Entzündung der Vulva und der Vagina (Vaginitis), die Vulvovaginitis genannt wird. Eine Vulvitis kann durch äußere Einflüsse wie Gifte, unverträgliche Unterwäsche oder enge Hosen, allergische Reaktionen, vermehrter Ausfluss (Fluor genitalis) oder Stoffwechselstörungen ausgelöst werden.[93]
Eine weitere Ursache für Entzündungen sind Infektionen mit Viren, Bakterien oder Pilzen. Dabei spielen unter den Viren vor allem die Humanen Papillomviren (HPV), die Herpes-simplex-Viren (HSV-1 und -2) und das Molluscum-contagiosum-Virus eine Rolle.[92] Die häufigsten bakteriellen Infektionen werden hervorgerufen durch Streptococcus pyogenes, Staphylococcus aureus (Folliculitis, Pseudofolliculitis), Corynebacterium minutissimum (Erythrasma), Gonokokken und Chlamydia trachomatis. Unter den Pilzen sind vor allem Candida albicans (Kandidose) und Trichophyton rubrum (Tinea der Vulva) von Bedeutung.[92] Einige dieser Infektionen können zudem Ursache schwerwiegenderer Erkrankungen sein. So stellen Gonokokken die Erreger der Gonorrhoe dar, während Humane Papillomviren der Hauptauslöser für Warzen, Feigwarzen, Erythroplasie sowie dem Zervixkarzinom, einer Krebserkrankung des Gebärmutterhalses sind. Eine Infektion mit Treponema pallidum führt zur Syphilis (Lues), deren Primäraffekt bei vaginalem Geschlechtsverkehr an den Schamlippen oder in der Vagina zu finden ist.
Auch ein Parasitenbefall, beispielsweise mit Filzläusen (Phthirus pubis) oder Krätzemilben (Sarcoptes scabiei), ist bekannt.[94][95]
In den tropischen und subtropischen Regionen der Erde treten Formen der Elephantiasis, genauer einer Elephantiasis der Vulva, auf.[96][97][98][99] Es handelt sich dabei um Infestationen mit dem Fadenwurm, Wuchereria bancrofti (Cobbold, 1877) der parasitisch in den Lymphgefäßen des Menschen lebt.
Ein Verschluss des Ausführungsganges der Bartholinschen Drüse führt durch Ansammlung von Sekret zu einer Pseudozyste. Bei einer bakteriellen Infektion kommt es in Folge oft zu einer Bartholinitis.
Bei Tieren können sich eine Reihe von Deckseuchen wie der Bläschenausschlag der Pferde, die Beschälseuche der Pferde, die Infektiöse Pustulöse Vulvovaginitis der Rinder (IPV), die Trichomonadenseuche der Rinder, das Sticker-Sarkom der Hunde und die Kaninchensyphilis an der Vulva manifestieren. Taylorella equigenitalis, der Erreger der Ansteckenden Gebärmutterentzündung des Pferdes, kann jahrelang in den Kitzlereinbuchtungen persistieren.
-
Feigwarzen der Vulva.
-
Vaginaler Ausfluss bei Gonorrhoe.
-
Filzlaus-Befall der Schambehaarung.
Chronische Erkrankungen
Durch unterschiedliche Einflüsse kann es zu den verschiedenen Formen der Vulvadystrophie kommen, Veränderungen im Übergangsepithel mit Verhornungen oder Hautschrumpfungen mit weitgehend ungeklärter Ursache. Die meisten Formen der Vulvadystrophie, beispielsweise die Kraurose, auch Lichen sclerosus genannt, treten nach Beginn der Wechseljahre (Klimakterium) auf.[100][101]
Einige Vulvadysplasien gehen mit atypischen Zellen einher und stellen Präkanzerosen dar, die zu bösartigen (malignen) Vulvatumoren führen können. Diese Krebsvorstufen werden auch als Vulväre intraepitheliale Neoplasie (VIN) bezeichnet. Sie entstehen meist im Alter zwischen 60 und 80 Jahren und sind in den großen Schamlippen lokalisiert. Ein „Vulvakrebs“ kann Metastasen bilden. Dabei sind über 90 % der Tumoren Plattenepithelkarzinome (Vulvakarzinome); bei den restlichen 10 % handelt es sich um Basalzellkarzinome, Adenokarzinome, Melanome oder Karzinome der Bartholinschen Drüsen. Aber auch Sarkome sind zu finden. Die Therapie erfolgt operativ durch die Entfernung von Vulvabereichen (Vulvektomie). Häufiger sind es jedoch Lipome und Fibrome, die sich als gutartige (benigne) Tumoren in unterschiedlichen Bereichen der Vulva bilden.
Eine Erkrankung bislang ungeklärter Ursache stellt die Vulvodynie aus, die durch lang andauernde Schmerzzustände in den großen Schamlippen und anderen Teilen der Vulva gekennzeichnet ist. Sie ähnelt der Vaginodynie (Schmerzen der Vagina) und wird gemeinsam mit dieser als chronisches genitales Schmerzsyndrom eingeordnet.[102] Als Auslöser werden hormonelle Veränderungen, beispielsweise während der Wechseljahre, und auch psychische Ursachen diskutiert.[102]
Durch eine chronische Venenschwäche der Beckenvenen, insbesondere der Vena ovarica können sich Krampfadern, analog zur männlichen Varikozele, entwickeln.[103][104]
-
Fortgeschrittene Neurofibromatose der Vulva.
-
Lichen sclerosus der Vulva.
-
Histologie eines atrophen Lichen sclerosus.
-
Histologie eines hypertrophen Lichen sclerosus.
Medizinisch indizierte operative Veränderungen
Die vollständige oder teilweise operative Entfernung der großen und der kleinen Schamlippen und weiterer Teile der Vulva und des darunter liegenden Gewebes wird als Vulvektomie bezeichnet. Sie kann bei Vulvakarzinomen notwendig werden, selten bei fortgeschrittener Vulvadystrophie älterer Frauen. Bei einer radikalen Entfernung zur Behandlung eines Krebsleidens können auch die Lymphknoten der Leistengegend (inguinale Lymphknoten) und des Beckens (pelvine Lymphknoten) entfernt werden.[105] Eine partielle Vulvektomie kann zudem bei einer vulvären intraepithelialen Neoplasie vorgenommen werden.[106]
Die operative Entfernung des Kitzlers wird als Klitoridektomie bezeichnet, wobei eine medizinische Indikation durch spezifische Krebserkrankungen selten ist.
Sprachliche Aspekte
Etymologie
Das Wort Vulva geht auf lateinisch volva, vulva („Gebärmutter“, botanisch auch „Schale“ von Obst[107]) zurück, das seinerseits in seiner Etymologie unsicher ist.[108] Es wird entweder zusammen mit lat. volvere „rollen“, „wälzen“, „drehen“ auf eine indogermanische Wurzel *vélu-, vel „umringen“, „umhüllen“, „drehen“, „wenden“ zurückgeführt. Dafür wird ein indogermanisches Wort *vlvo „Hülle“, „Eihaut“, „Gebärmutter“ angesetzt, das auch Sanskrit úlva-m, -s (auch ulba-m, -s) „Eihaut“, „Gebärmutter“ ergab.[109] Oder man nimmt, ausgehend von der allerdings erst spät im Edictum Diocletiani belegten Wortform lat. volba, eine gemeinsame Wurzel mit der Wortsippe griechisch δελφύς „Gebärmutter“, ἀδελφός „Bruder“ und δέλφαξ „Ferkel“ an.[108]
Im klassischen Latein bezeichnete volva im Gegensatz zur heutigen medizinischen Bedeutung zunächst die Gebärmutter, in kulinarischen Zusammenhängen speziell die Gebärmutter des Schweines, die als besondere Delikatesse galt.[110] Schon Plinius der Ältere unterschied aber zwischen uterus als der Bezeichnung für die menschliche Gebärmutter und volva als der für die Gebärmutter von Tieren.[111] Indem uterus zunehmend vulva als Bezeichnung für die Gebärmutter verdrängte, verschob oder verengte sich die Bedeutung von vulva im Sinne von cunnus auf den äußeren Genitalbereich, mit os vulvae („Mund der Vulva“) seit Cornelius Celsus[112] als Bezeichnung für die äußere Öffnung.
Die spätantike Etymologie setzte bei dieser veränderten Bedeutung an; so leitete Isidorus im 6. Jahrhundert n. Chr. vulva von valvae, „Flügeltüren“ her, da sie den Samen wie durch eine Tür einlasse und durch sie der Fötus heraustrete.[113]
Andere Bezeichnungen
Einerseits gibt es eine große Zahl von Ausdrücken für „Vulva“,[114] andererseits wird das Geschlechtsteil der Frau manchmal schamhaft mit „unten rum“ beschrieben. Diese weitverbreitete Tendenz der Umschreibung wird von verschiedenen Seiten kritisiert und gilt als ein Grund dafür, dass die Begriffe „Vagina“ oder „Scheide“ (für das innenliegende Geschlechtsorgan) bisweilen fälschlicherweise verwendet werden, um die Vulva zu bezeichnen.[115] Die Sozialpädagogin Souzan AlSabah schlägt daher den Begriff „Vulvina“ vor, um die Gesamtheit von Vulva und Vagina zu bezeichnen. Damit soll eine positive Selbstbezeichnung für das weibliche Genital ermöglicht werden.[116] Historisch überliefert sind die Begriffe „heimliche Stätte“, „Weybsglied“ oder „Bauchthor“, die angeblich verwendet wurden.[117] Sprachlich direkten Ausdruck findet die Schamhaftigkeit in den Bezeichnungen „die Scham“ (für Vulva) oder „Schamlippen“ (statt Lust- oder Venuslippen).[118]
Kosenamen
Umgangssprachlich wird oft der Ausdruck „Muschi“ verwendet. Auch in anderen Sprachen wird der Kosename für Katzen gleichzeitig für dieses weibliche Geschlechtsorgan verwendet: englisch pussy, französisch chatte, während sich das lateinische cunnus wahrscheinlich von cuniculus „Kaninchen“ ableitet, ähnlich dem spanischen Wort conejo für Kaninchen, das dem Vulgarismus coño für Vulva ähnelt.[119] Im lateinischen Wort vulva steckt die indoeuropäische Wurzel vélu-, vel („umrunden, wickeln, drehen“).
Abwertende Begriffe
Hart bis abwertend benutzt wird „Fotze“. Eine große Anzahl weiterer abwertender, oft einer mechanischen Denkweise und Sprache entstammende Bezeichnungen hat der Schweizer Paartherapeut und Sachbuchautor Klaus Heer gesammelt, beispielsweise „Dose, Büchse, Bohrloch, Klemme, Bumskerbe“.[114] Einige dieser negativ konnotierten Begriffe, wurden erst mit der Zeit deformiert, wie zum Beispiel das englische Wort "cunt", was ursprünglich soviel wie "heiliger Ort" bedeutete.[120]
Kulturelle Aspekte
Die Vulva im kulturellen Kontext

Symbolisierte Vulvae aus unterschiedlichen Epochen und Kulturkreisen.
- Oben links: Schamdreieck im sumerischen Keilschriftzeichen munus (bedeutet „Frau“);
- Oben rechts: Hindu-Symbol für Yoni.
- Unten links: Spitzes Oval in vielen Zusammenhängen als Darstellung oder Symbol der Vulva aufgetreten.
- Mitte: Oval im Oval (als Variation von 3).
- Unten Mitte: ägyptische Hieroglyphe für „Frau“ und „Vulva“ verwendet.
- Unten rechts: tschechisches und slowakisches „Píča“-Symbol ().
Allgemein und kulturübergreifend wird die Vulva mit den biologischen Funktionen der Sexualität und der Geburt in Verbindung gebracht. Die gesellschaftlichen Einstellungen gegenüber der Vulva unterscheiden sich jedoch zum Teil erheblich in verschiedenen Kulturkreisen und historischen Epochen.
Die Vulva in der Geschichte des Abendlandes
7. Jahrhundert vor Christus
Einige Mythen, wie zum Beispiel die Mythen, in denen ein Anasyrma vorkommt, überliefern die positive Haltung gegenüber der Vulva.
Antike
Um 300 n. Chr. begann die christlich-dogmatische Verleugnung des weiblichen Genitals.[120]
Mittelalter
Die Sheelas und weitere Statuen von Frauen mit gespreizten Beinen, welche bis ins späte Mittelalter an heiligen Stätten und vor Stadttoren angebracht wurden, zeugen von der damaligen positiven Betrachtung der Vulva.[120]
Neuzeit
Die positive Einstellung änderte sich mit Beginn der Neuzeit. Wissenschaftler der Zeit begannen, die Vulva, Klitoris und Vagina als abgeänderten Penis zu interpretieren.[120] Die Klitoris war allgemein nicht bekannt und wurde auch als Teufelsmal verstanden.[120]
Um das 17. Jahrhundert herum, wurden die Genitalien auf die Begriff "Scheide" oder "Vagina" reduziert, wodurch die Vulva sprachlich verschleiert wurde.[120]
Viktorianisches Zeitalter
Um das 19. Jahrhundert herum waren eine allgemein stark ausgeprägte Prüderie und Körperfeindlichkeit präsent und gingen mit einer negativen, feindseligen Position gegenüber der Vulva einher.
Moderne
Diese Entwicklung kehrte sich im 20. Jahrhundert wieder um, anfangs mit der Lebensreformbewegung und verstärkt mit der sexuellen Revolution der 1960er Jahre. Im Zuge einer zunehmenden Liberalisierung der Gesellschaft, der weiblichen Emanzipation und einer entspannteren Haltung gegenüber der Sexualität fand eine Enttabuisierung der Vulva statt.[121]
Öffentlicher Umgang und Tabuisierungen
Es existieren in verschiedenen Kulturen Tabus in Bezug auf die Vulva, die beispielsweise die öffentliche Sichtbarkeit, die Darstellung in der Kunst oder auch das Gespräch über die Vulva einschränken. Die Haltungen variieren zwischen vollständiger Tabuisierung durch Assoziation mit Sünde oder Ekel auf der einen Seite, über eine sachlich-entspannte Einstellung als „ganz normaler Körperteil“ bis hin zu Verehrung und Vergötterung als Symbol der Fruchtbarkeit und Ursprungsort des Lebens.[121]
Gesellschaftliche Normen und Schönheitsideale
Neben sittlich-moralisch begründeten Tabus bezüglich der öffentlichen Darstellung existieren große Unterschiede bezüglich ästhetischer Vorstellungen: Welche anatomischen Ausprägungen und kosmetischen Veränderungen als schön empfunden werden, ist stark kulturell beeinflusst.
Die Haltung gegenüber der Schambehaarung unterscheidet sich stark. So werden Schamhaare in einigen Weltregionen als schön empfunden, während in anderen Kulturen Schamhaare als unhygienisch und abstoßend bewertet werden. Im westlichen Kulturkreis etablierte sich die Schamhaarentfernung seit den 1990er Jahren und wurde seither zu einem teils etablierten Teil der Körperpflege.[122][123]
Verschiedene anatomische Strukturen wie innere und äußere Schamlippen, Klitorisvorhaut und Venushügel sind Schönheitsidealen unterworfen. Bezüglich der Ausgeprägtheit der inneren Schamlippen existieren weltweit unterschiedliche Ideale:
„Als schön wird von den meisten Frauen in Europa empfunden, wenn die äußeren Schamlippen die inneren kleinen Schamlippen gerade bedecken. In Japan dagegen gilt ein schmetterlingsflügelhaftes Aussehen der Schamlippen als Ideal, in manchen afrikanischen Ländern ein besonders langes Hervorhängen der inneren Schamlippen.“
In zahlreichen Kulturkreisen werden die Schamlippen durch Dehnung beziehungsweise durch operatives Entfernen von Gewebe dem jeweiligen Schönheitsideal angepasst. In den letzten Jahrzehnten kam es auch in Europa zu einer stetig wachsenden Nachfrage nach kosmetischen Operationen im Intimbereich.[125]
Im westlich-europäischen Kulturkreis ist die Vulva seit dem ausgehenden 20. Jahrhundert zunehmend Gegenstand ästhetischer Maßstäbe: während diese Körperregion vormals als privat und verborgen galt, ist sie heute zunehmend auch einem öffentlichen Blick unterworfen und „soll schön aussehen“.[126][127]
Untersuchungen zu Einstellungen und Motiven
In einer Studie in Deutschland von 2018 antworteten 202 Frauen und 114 Männer (Durchschnittsalter 29 Jahre) zu ihren Vorlieben bezüglich des Aussehens der Vulva. Männer wie Frauen bevorzugten überwiegend und gleichermaßen eine komplette Intimrasur. Es zeigte sich kein Zusammenhang der Einschätzungen mit der sexuellen Vorerfahrung bei Männern oder mit Persönlichkeitseigenschaften (der Aufgeschlossenheits-Dimension des Fünf-Faktoren-Modells) bei Männern oder Frauen.[128]
Im Jahr 2015 wurde in Brasilien eine Umfrage unter 52.787 Frauen und 17.133 Männern (Durchschnittsalter 31,9 Jahre) zum Thema Schamhaarentfernung bei Frauen durchgeführt. 64,3 % der Frauen und 62,2 % der Männer bevorzugten eine komplette Entfernung der weiblichen Schamhaare, wobei der Trend unter jüngeren Frauen und Männern stärker ausgeprägt war.[129]
In einer australischen Studie von 2019 wurden 270 Frauen im Alter von 17–25 Jahren unter anderem zu ihrem gegenwärtigen Status der Schambehaarung befragt. 52,3 % berichteten eine komplette Entfernung und nur 18,3 % eine natürliche Behaarung. Ein Teilergebnis war, dass eine feministische Orientierung der Probandinnen mit einer geringeren Rate der Schamhaarentfernung korrelierte.[130]
In einer Studie von 2019 in Flandern (Belgien) antworteten 2.687 Männer und 1.735 Frauen (15 bis 60+ Jahre) zu Fragen im Zusammenhang mit Schamhaarentfernung. 80,3 % der Frauen und 39,1 % der Männer sagten, gegenwärtig seien ihre Schamhaare ganz oder teilweise entfernt. 3,1 % der Frauen und 21,1 % der Männer sagten, noch nie ihre Schamhaare entfernt zu haben. Sowohl Männer als auch Frauen sagten, ihre Gründe für die Haarentfernung lägen in ihren sexuellen Erfahrungen und in den Vorlieben ihrer Partner.[131]
Traditionelle Vulvaverstümmelung
Die Klitoridektomie wird heute vor allem im Zusammenhang mit der Verstümmelung weiblicher Genitalien vorgenommen.[132] In manchen Kulturkreisen, vorwiegend im afrikanischen Raum, wird die Verstümmelung weiblicher Genitalien als kulturelle Praxis angewendet. Sie wird aus sozialen und kulturellen Gründen durchgeführt. Das Ausmaß des Eingriffs variiert von einer Entfernung der Klitorisvorhaut bis hin zur vollständigen Entfernung der äußeren Genitalien und Vernähung der Vagina.[133]
Wegen der weitreichenden Folgen für Leib und Leben der betreffenden Mädchen und Frauen steht diese Praxis seit Längerem weltweit in der Kritik von Menschen- und Frauenrechtsorganisationen. Zahlreiche Organisationen, darunter die Vereinten Nationen, UNICEF, UNIFEM, die Weltgesundheitsorganisation (WHO) sowie Amnesty International wenden sich gegen die Verstümmelung und stufen sie als Verletzung des Menschenrechtes auf körperliche Unversehrtheit ein. Zur Betonung dieser Aspekte hat sich international die Bezeichnung Female Genital Mutilation (weibliche Genitalverstümmelung) etabliert.[134]
Ästhetisch-kosmetische Veränderungen der Vulva
Modifikationen der Vulva können aus verschiedenen kulturellen und ästhetischen Gründen erfolgen. Dabei geht es in der Regel um die Angleichung an ein persönliches oder kulturell geprägtes Schönheitsideal oder eine Körpernorm. Sie reichen von der Entfernung der Schambehaarung bis zu Eingriffen, bei denen Teile der Vulva durch invasive Eingriffe entfernt werden.
Schamhaarentfernung
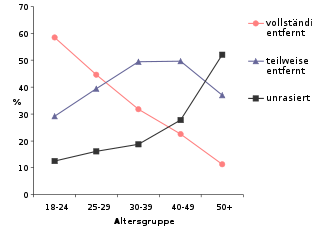
Die im westlichen Kulturkreis am weitesten verbreitete Modifikation ist die teilweise oder vollständige Schamhaarentfernung. In anderen Kulturen beziehungsweise für frühere Epochen der abendländischen Kultur ist die Praxis dokumentiert. Der Islam erwartet die Entfernung der Schambehaarung.[136][137] Um die Jahrtausendwende 1999/2000 fand die Praxis auch im Westen weitere gesellschaftliche Verbreitung.[138] Nach einer Umfrage aus dem Jahr 2009 war in Deutschland bei der Altersgruppe von 18 bis 25 Jahren die Rasur des Genitalbereichs recht verbreitet (69,7 % der Frauen).[139] Die Intimrasur ist nicht unproblematisch. Frauen, die sich rasieren, ohne dabei der natürlichen Wuchsrichtung zu folgen, sind anfälliger für Haarwurzelentzündungen.[140][141]
Kosmetische Genitalchirurgie

Einige Frauen lassen als operative Maßnahme eine Schamlippenverkleinerung (Labioplastik) vornehmen, wobei die inneren Schamlippen, mitunter auch die Klitorisvorhaut (Klitorisvorhautreduktion), gekürzt oder entfernt, die äußeren Schamlippen vergrößert, der Vaginaleingang verengt, ein Hymen rekonstruiert oder die Position der Klitoris verändert werden.[142] Dies geschieht vorwiegend aus subjektiv ästhetischen, gelegentlich aus soziokulturellen,[143] selten auch aus medizinischen Motiven.[144][145] Daher wird der größte Teil dieser Eingriffe unter der Bezeichnung der kosmetischen Genitalchirurgie (Female Genital Cosmetic Surgery, FGCS) zusammengefasst. Chirurgische Maßnahmen im Rahmen einer Geschlechtsangleichung, die Geschlechtsanpassung bei intersexuellen Personen oder die Beschneidung weiblicher Genitalien werden nicht zu den FGCS gezählt.[142]
Unter dem Titel Intimchirurgie: Ein gefährlicher Trend. sprachen Ada Borkenhagen und ihre Mitautoren bereits im Jahr 2009 von einem „Boom kosmetischer Intimkorrekturen“. Ein Grund dafür sei „die zunehmende Darstellung voll- oder teilrasierter weiblicher Genitalien in den Medien“, die gerade Mädchen und junge Frauen „unter Druck“ brächten, „dem neuen Intimideal zu entsprechen“. Sie würden „zum Beispiel ‚zu lange‘ äußere Schamlippen als Stigma“ empfinden.[142]
Piercing

Weiterhin stellen Piercings eine Form der Körpermodifikation dar, wobei verschiedene Strukturen der Vulva mit Schmuck versehen werden können.[146][147] Ebenso wie die Intimrasur kann der Trend zu Intimpiercings als Folge einer verstärkten Etablierung von sozialen beziehungsweise ästhetischen Normen für den Schambereich gesehen werden, „eine bis dato primär zur Privatsphäre zählende Körperregion – die Schamregion – unterliegt fortan einem Gestaltungsimperativ.“[148] Während einige Piercings der Vulva positive Auswirkungen auf die Stimulierbarkeit der Frau während des Geschlechtsverkehrs haben,[149] besitzen die meisten Piercings eine rein ästhetische Funktion. Piercings können, wie an anderen Körperteilen auch, Komplikationen mit sich bringen. Häufigste Probleme von Piercings im weiblichen Genitalbereich sind Entzündungen, Ausrisse und Blutungen. Allergien, überschießende Narbenbildung (Keloide) und Fremdkörpergranulome sind ebenfalls nicht selten.[150][151]
Die Vulva in der Kunst
Insbesondere wegen des sexuellen Bezuges wie auch wegen ihrer Funktion als Teil des Geburtsweges fand und findet die Vulva regelmäßig Eingang in Kunst und Kultur. Sie gilt als Fruchtbarkeitssymbol („Große Mutter“)[152] und zugleich als Symbol des Begehrens. Neben den paläolithischen Darstellungen von Frauen (Venusfigurinen), deren Vulva betont wird, finden sich insbesondere in den Höhlen um Fontainebleau in Frankreich auch zeitlich jüngere Felsritzungen, die häufig Vulven darstellen.
In einigen Kulturen wurde die Präsentation der Vulva apotropäisch verstanden als Abwehrzauber gegenüber bösen Mächten.[152]
In unterschiedlichen Kulturen tauchen immer wieder gleiche oder ähnliche Symbole auf, die eine Vulva darstellen. Zahlreiche Darstellungen aus der Altsteinzeit zeugen auch in Europa von ähnlichen kultisch-verehrenden Einstellungen. Die kulturelle Haltung gegenüber dem weiblichen Genital unterscheidet sich jedoch in unterschiedlichen Kulturkreisen. Während in einigen die Vulva eher tabuisiert und in der Öffentlichkeit bedeckt wird, zeigten andere Kulturen einen Kult um die Vulva. So wurde diese in Festen verehrt und als heilig betrachtet.
Bei Ausgrabungen wurde zwischen dem 5. und 15. September 2008 in der Hohle Fels-Höhle auf der Schwäbischen Alb eine aus Mammutelfenbein geschnitzte Frauenstatuette aus der Aurignacien-Zeit entdeckt, die sogenannte Venus vom Hohlen Fels. Dabei wurde festgestellt, dass die Vulva zwischen den geöffneten Beinen betont ausgeführt wurde, was als „bewusste Überhöhung der sexuellen Merkmale“ gedeutet wurde.[153][154]
Im Mittelalter entstanden vor allem in Irland über den Eingängen von Klöstern und Burgen sogenannte Sheela-na-Gig, Steinskulpturen, welche die Vulva meist überdimensioniert und aufgespreizt darstellen. An Kirchenfassaden des Hochmittelalters finden sich auch Vulvenornamente, während auf Pilgerinsignien und -utensilien des Spätmittelalters Vulvae und Penisse in verschiedenen Variationen abgebildet sind, wie beispielsweise eine Umhangsnadel mit einer als Pilger ausgestatteten Vulva mit Armen, Beinen und Hut. Der Sinn solcher Utensilien ist nicht mehr bekannt, sie werden sowohl als Parodien auf herkömmliche Pilgerabzeichen wie auch als Glücksbringer interpretiert.[155]
Auch der im Hinduismus entwickelte Yoni-Kult, der gemeinsam mit dem männlichen Lingam die Zweigeschlechtlichkeit des Gottes Shiva symbolisiert, gehört zu den Vulva-Kulten. Gemeinsam mit dem Lingam stellt die Yoni das Symbol der Urzeugung dar.[156]
-
Stilisierte steinzeitliche Darstellung der Vulva in Saint-Germain-en-Laye, Steinzeit
-
Sheela-na-Gig an der Church of St Mary and St David in Kilpeck, Herefordshire
Europäische Kunstgeschichte bis in das 19. Jahrhundert


In der europäischen Kunstgeschichte, ausgehend vom antiken Griechenland und früheren Kulturen, wurde die konkrete Darstellung der Vulva sowohl in der Malerei als auch in der Bildhauerei bis in das späte 19. Jahrhundert weitgehend vermieden. Dies betraf vor allem die antiken Statuen der Griechen und Römer, Ausnahmen bildeten seltene pornografische Darstellungen von Hetären etwa in der griechischen Vasenmalerei sowie bei Wandbildern (siehe Prostitution in der Antike).
Auch die mit der Renaissance neu aufkeimende Darstellung nackter Körper in der italienischen und italienisch beeinflussten Kunst im 14. bis 17. Jahrhundert und die weitere Entwicklung in Europa bis zum Ende des 19. Jahrhunderts führten diese Praxis weiter. Alle bekannten Maler und Bildhauer dieser Zeit, die Akte darstellten, einschließlich Antonio Pisanello, Raffael, Tizian und Giambologna über Peter Paul Rubens bis hin zu Malern der französischen Salonkunst wie Jean-Auguste-Dominique Ingres und Jean-Léon Gérôme sowie des Impressionismus wie Edgar Degas oder Auguste Renoir, zeigten zwar den Venushügel, aber keine weiteren anatomischen Details.[155]
Ausnahmen bildeten die Maler des deutschen und niederländischen Sprachraums wie Jan van Eyck, Lucas Cranach der Jüngere, Hans Baldung Grien, Jan Gossaert sowie Albrecht Dürer, die in der Regel ihre Aktdarstellung in der Malerei, Grafik und Bildhauerei (insbesondere in Form von Miniaturen aus Holz und Elfenbein) mit natürlicher Schambehaarung und Schamspalte darstellten.[155] Hier war die Darstellung vor allem dem Wunsch einer realistischeren und vollständigen Darstellung zuzuschreiben und fand vor allem bei der Darstellung von biblischen Motiven wie der Darstellung von Adam und Eva oder auch bei Marienbildnissen ohne sexuellen Bezug statt. Dürer widmete sich zudem in seinen Proportionsschemata für den weiblichen Idealkörper auch dem Spalt des weybs und stellte diesen entsprechend dar.[155] Diese Form der Darstellung verschwand im 16. Jahrhundert, als auch im Norden Europas der idealisierte und geschlechtsverhüllende Zustand übernommen wurde.
Über die Gründe für die Haar- und Detaillosigkeit in der Darstellung des weiblichen Geschlechts gibt es eine Reihe von Theorien, die zuerst von Denis Diderot und später im 20. Jahrhundert entwickelt wurden; Diderot und einige weitere Autoren greifen vor allem die Ästhetik in Form und auch Farbe als Begründung auf, während andere der Theorie Sigmund Freuds folgend die Angst vor dem bedrohlichen weiblichen Geschlecht heranzogen.[155]


Im 18. Jahrhundert entstanden vor allem pornografische Darstellungen mit künstlerischem Anspruch von weniger bekannten Künstlern wie Eugene Poitevin und Jean-Jacques Lequeu, der als Architekt auch Gebäude mit detaillierten Zeichnungen weiblicher Genitalien schmückte.[155] Nur gelegentlich wurden Aktdarstellungen mit Schambehaarung im künstlerischen Kontext akzeptiert, so etwa bei Francisco de Goyas Gemälde Die nackte Maja (um 1800–1803). Seit 1995 ist das Bild L’Origine du monde (Der Ursprung der Welt, s. u.) von Gustave Courbet im Pariser Musée d’Orsay ausgestellt, eine lange Zeit nur in privatem Rahmen gezeigte Auftragsarbeit aus dem Jahr 1866.[157] Das Ölgemälde zeigt eine leicht geöffnete Vulva mit dunkler Schambehaarung. Obwohl dieses Bild eines der ältesten bekannten Werke mit detaillierter Darstellung der Vulva ist, hatte es durch seine späte Veröffentlichung keinen Einfluss auf die zeitgenössische Kunst seiner Entstehungszeit. Auch Courbet selbst stellte, ebenso wie andere Künstler seiner Zeit, in anderen Aktdarstellungen die Vulva nicht detailliert dar.[155]
Im 19. Jahrhundert kam die Malerei und Bildhauerei nach dem weiblichen Aktmodell zunehmend in Mode und in die Kunstakademien, sodass die reale Abbildung des Geschlechts für die Künstler präsenter wurde. Es wurde anfangs vor allem in Vorstudien und Skizzen dargestellt, verschwand jedoch bei der Umsetzung in die Malerei. Insbesondere die Studien von Jean-Auguste-Dominique Ingres, der für die Darstellung glatter, marmorhafter Frauenkörper berühmt wurde, zeigen das in den später gemalten Bildern nicht mehr sichtbare Achsel- und Schamhaar. Außerdem wurden Fotografien als Vorlage genutzt wie von Jean-Léon Gérôme, dessen Phryne vor den Richtern von 1861 wahrscheinlich nach einer Fotografie von Felix Nadar gemalt wurde. Zum Ende des 19. Jahrhunderts tauchten diese realistischen Elemente bei einzelnen Künstlern – etwa bei Gustave Caillebotte und dem Amerikaner Thomas Eakins – auch in den Bildern auf.
Japanische Kunst
In Japan wurden bereits in der Frühzeit vor mehr als 4000 Jahren Tonfiguren von Fruchtbarkeitsgöttinnen mit vergrößerten Genitalien hergestellt. Im Shintoismus stand der Phallus im Mittelpunkt der Schöpfungsmythologie und er war auch das Hauptmotiv der erotischen Darstellungen der Heian-Zeit vom 8. bis zum 12. Jahrhundert.[158]
Im 17. bis 19. Jahrhundert während der Edo- und der Meiji-Zeit etablierten sich als Variante der Farbholzschnitte (Ukiyo-e) die sehr freizügigen Shunga-Bilder oder wörtlich Frühlingsbilder, wobei die Bezeichnung Frühling eine Metapher für Sex ist. Es sind Gemälde, Drucke und Bilder jeder Art, die in expliziter Weise sexuelle Handlungen darstellen und dabei auch die Details der Sexualorgane zeigen. Parallel dazu kam die Bezeichnung shumbon (japanisch 春本 „Frühlingsbücher“) in Gebrauch für Bücher sexuellen Inhalts. Ein zentrales Motiv darin waren die Kurtisanen, die nicht nur in der Prostitution, sondern auch in der Dicht-, Schreib- und Teekunst gebildet waren.[158] Mit der Öffnung Japans gegenüber den Europäern und dem Import westlicher Moralvorstellungen wurden 1868 das gemeinsame Bad von Männern und Frauen in öffentlichen Bädern sowie der Handel mit Erotika verboten. Zum Ende der Meiji-Zeit wurden 1910 sowohl die Herstellung wie auch der Vertrieb der mittlerweile als obszön empfundenen Shunga unter Strafe gestellt. Bis 1986 war es in Japan verboten, auch nur den Ansatz eines Schamhaars öffentlich zu zeigen. Unzensierte Shunga-Ausstellungen gibt es erst seit 1994 wieder.[158]
-
Katsushika Hokusai: Fukujusō (Amur-Adonisröschen), 1815
-
Katsushika Hokusai: Der Traum der Fischersfrau, 1820
-
Unbekannter japanischer Künstler, 1850
-
Terazaki Kōgyō (1866–1919): Izumo no chigiri (Die Versprechen von Izumo), 1899
Kunst des 20. und 21. Jahrhunderts
Während sich am Ende des 19. und verstärkt zu Beginn des 20. Jahrhunderts Fotografie und Film durchsetzten und auch zahlreiche Aktaufnahmen kursierten, wurden diese nicht als Kunst betrachtet, sondern galten in der Regel als Pornografie. Detaillierte Darstellungen der Schamregion oder Schamhaar in der Malerei blieben dagegen verpönt, Verstöße führten zu Beginn des 20. Jahrhunderts zu Skandalen. Im März 1901 wurde die Zeitschrift Ver Sacrum der Wiener Secession von der Staatsanwaltschaft beschlagnahmt und vernichtet, weil sie einige Zeichnungen Gustav Klimts enthielt, die „den Rahmen des gesellschaftlich Sanktionierten überschritten“.[159] Seine Entwürfe für Deckenfriese in der Wiener Universität wurden wegen anatomischer Details abgelehnt und in der zeitgenössischen Literatur wurde Klimt als Skandalmaler bezeichnet. Sanktioniert wurden auch andere Künstler; noch 1917 wurde eine Ausstellung von Amedeo Modigliani, die einzige zu seinen Lebzeiten, polizeilich geschlossen, da die Akte aufgrund der dargestellten Schambehaarung als pornografisch galten.[155]
Insbesondere das Schamhaar wurde zu einem Symbol der Avantgarde der Aktmaler und rückte später ins Zentrum der Aufmerksamkeit, die Darstellung weiblicher Körper ohne Schamhaar oder Schamspalte verschwand vollständig aus der modernen Kunst des 20. Jahrhunderts. Insbesondere Pablo Picasso, Egon Schiele und George Grosz setzen die weiblichen wie auch die männlichen Genitalien prominent in den Vordergrund ihrer Aktkunst und machten sie gesellschaftsfähig. Darauf aufbauend wurden Darstellungen der Vulva ebenso wie des Penis und des Geschlechtsaktes in der erotischen Kunst von Malern wie Balthus, Marcel Duchamp und André Masson, Fotografen wie Robert Mapplethorpe, Man Ray und Helmut Newton bis Jeff Koons, Gerhard Richter, Gottfried Helnwein, Pierre Klossowski sowie dem Japaner Nobuyoshi Araki und vielen anderen[160] weitergeführt.
-
Otto Mueller: Zwei weibliche Akte am Baum, 1923
-
Philippe Zacharie: La femme qui dort, 1903
-
Egon Schiele: Frau mit schwarzen Strümpfen, 1913
-
Gustav Klimt: Frau bei der Selbstbefriedigung, 1913
Abbildungen des weiblichen Genitals finden sich in der zeitgenössischen Kunst in vielen Kunstgattungen, insbesondere in der Aktfotografie sowie der erotischen Fotografie, einhergehend mit einer Enttabuisierung der Darstellung. Diese Freizügigkeit hat auch in die Porträtfotografie Eingang gefunden, wobei die dargestellten Frauen sowohl ihr Gesicht als auch ihre Vulva präsentieren, in seriellen Ganzkörperporträts[161] oder Doppelportraits von Gesicht und Vulva.[162]
Eine herausgehobene Rolle als Symbol befreiter weiblicher Sexualität spielt die Vulva auch in feministischer Kunst,[163] wo ihre Darstellung in Verbindung mit floralen oder Schmetterlingsmotiven unter anderem bei Georgia O’Keeffe[160] und Judy Chicago stilbildend gewirkt hat. Insbesondere Judy Chicagos Dinner Party, die Konfrontation der Darstellung weiblicher Genitalien mit barocker Porträtmalerei von Zoe Leonard auf der Documenta IX, die riesenhafte Figur Hon – en katedral (Schwedisch: „Sie – eine Kathedrale“) von Niki de Saint Phalle vor dem Stockholmer Moderna Museet, die durch die Vulva betreten werden konnte, die Montagen aus Prothesen und Sexspielzeugen von Cindy Sherman und die provokanten Performances der österreichischen Künstlerin Valie Export wie die Aktionshose Genitalpanik (1969), bei der sie mit einer im Bereich der Genitalien ausgeschnittenen Hose durch die Zuschauerreihen eines Sexkinos ging,[160] sowie weitere Werke von Carolee Schneemann, Hannah Wilke, Marina Abramović, Chloe Piene und Annie Sprinkle gehören in diesen Kontext.[155][157][164]
In dem Avantgardefilm Near the Big Chakra von Anne Severson aus dem Jahr 1971[165] werden die Vulven von 38 Frauen in statischen Großaufnahmen gezeigt. Dabei wirkte offenbar nicht nur die Perspektive der Geschlechtsorgane schockierend auf die Zuschauer, sondern auch, dass einige Frauen während der Menstruation oder kurz nach dem Geschlechtsverkehr gefilmt wurden. Auch dass es sich nicht nur um junge Frauen handelte, war ungewöhnlich. Der Film wurde hauptsächlich im Kunst- und Experimentalfilmkontext gezeigt und beim Publikum oft kontrovers aufgenommen.[166]
In der webbasierten Medienkunst ist u. a. das Projekt Vaginamuseum[167] aus Wien erwähnenswert.
Megumi Igarashi stand in Tokyo im April 2015 wegen Obszönität vor Gericht, nachdem sie einen 3D-Druck eines Kajaks in Form ihrer Vulva hergestellt und die Datei an Investoren ihres Projekts verschickt hat.[168] 2016 wurde sie bezüglich ihres Entwurfs eines Kajaks freigesprochen, da, in den Worten des BBC-Reports, ihre Darstellung wegen der hellen Farbgebung nicht unmittelbar an weibliche Anatomie denken lasse. Jedoch wurde sie wegen der 3D-Daten ihrer Vulva zu einer Geldstrafe von 400.000 Yen (einige Tausend Euro) verurteilt, da diese die Form ihrer Vagina, gemeint ist wohl Vulva, rekonstruieren lassen.[169]
Beim Projekt I SHOW FLAG erstellt Mirko Hecht seit 2014 hunderte Vulvaabformungen aus Gips mithilfe von Alginat. Namensgebend sind die mit Nationalflaggen bemalten Werke.[170] Bei seiner Kunstausstellung VulvaVariety wird die Einzigartigkeit und Diversität dargestellt. Inspiriert wurde er von Jamie McCartney und seiner Great Wall of Vagina.[171][172] Jedes Panel der Skulpturen von McCartney enthält außergewöhnliche Abgüsse wie vor und nach der Geburt, eineiige Zwillinge, vor und nach einer Schamlippenverkleinerung, Transgender, nach Lichen sclerosus oder Vulvektomie.[173] Ein laufendes Projekt ist Innere Vaginen, bei dem das Versteckte sichtbar gemacht wird.[174]
Liv Strömquist beschäftigte sich 2014 in ihrem feministischen Comic Der Ursprung der Welt mit der Kulturgeschichte der Vulva.
|
| ||
|
| ||
Literatur
Medizin und Physiologie
- Günter Strauss: Vulva. In: Willibald Pschyrembel, Günter Strauss, Eckhard Petri (Hrsg.): Praktische Gynäkologie für Studium, Klinik und Praxis. 5., neubearbeitete Auflage. De Gruyter, Berlin 1991, ISBN 3-11-003735-1, S. 1–31.
- Miranda A. Farage, Howard I. Maibach: The vulva: anatomy, physiology, and pathology. CRC Press, London 2006, ISBN 0-8493-3608-2 (englisch, Volltext in der Google-Buchsuche).
- V. Küppers, Hans Georg Bender: Blickdiagnostik Vulva. Elsevier, Urban & Fischer, München u. a. 2003, ISBN 3-437-23270-3 (Volltext in der Google-Buchsuche).
- Eiko E. Petersen: Farbatlas der Vulvaerkrankungen. Diagnose und Differenzialdiagnose. Kaymogyn, Freiburg 2007, ISBN 978-3-00-043086-2.
- Abdel Fattah Youssef: Youssef’s Atlas der gynäkologischen Diagnosen. Fischer, Stuttgart/ New York 1985, ISBN 3-437-10976-6.
- Constance Marjorie Ridley, Sarah M. Neill, Fiona M. Lewis: Ridley’s The Vulva. Wiley-Blackwell, Chichester (UK)/ Hoboken (NJ) 2009, ISBN 978-1-4051-6813-7 (englisch).
- Matthew J. Zdilla: What is a vulva? In: Anatomical Science International. Band 97, Nr. 4, September 2022, S. 323–346, doi:10.1007/s12565-022-00674-7, PMID 35704265 (englisch).
Kulturgeschichte
- Hans Peter Duerr: Intimität. Suhrkamp, Frankfurt am Main 1994, ISBN 3-518-38835-5, S. 200–255.
- Hans Peter Duerr: Obszönität und Gewalt. Suhrkamp, Frankfurt am Main 1995, ISBN 3-518-38951-3, S. 82–119.
- Agnès Giard: L’imaginaire érotique au Japon. Albin Michel, Paris 2007, ISBN 978-2-226-16676-0 (französisch).
- Mithu Sanyal: Vulva. Die Enthüllung des unsichtbaren Geschlechts. Wagenbach, Berlin 2009, ISBN 978-3-8031-3629-9.
- Lih Mei Liao, Sarah M Creighton: Requests for cosmetic genitoplasty: how should healthcare providers respond? In: BMJ. Band 334, 26. Mai 2007, S. 1090–1092, doi:10.1136/bmj.39206.422269.BE (englisch).
- Cheryl B. Iglesia, Sheryl Kingsberg: The Quest for the “Perfect” Vagina. In: The Female Patient. Band 34, Februar 2009, S. 12–15 (englisch, obgynnews.com [PDF]).
Psychologie
- Claudia Haarmann: „Unten rum…“ Die Scham ist nicht vorbei. Innenwelt, Köln 2005, ISBN 3-936360-15-4.
Umgangssprache
- Klaus Heer: Wonneworte. Lustvolle Entführung aus der sexuellen Sprachlosigkeit. Überarbeitete Neuausgabe. Salis, Zürich 2007, ISBN 978-3-905801-02-6.
Weblinks
- Kerstin Rajnar: Vaginamuseum.at ab 2014 (erstes virtuelles Museum für das weibliche Geschlecht).
- Elena Müller: Gespräch mit Expertinnen: Viva la Vulva! Die Bedeutung des weiblichen Geschlechtsorgans. In: Frankfurter Rundschau. 9. März 2021, abgerufen am 10. März 2021 (mit Ulrike Schmauch, Sheila de Liz und der Künstlerin Lina Lätitia Blatt).
- Wissenschaftsdoku: Vulva und Vagina – Neue Einblicke in die weibliche Lust. ZDF 2020. In: 3sat. (43:42 Minuten; verfügbar bis 22. April 2026).
- Diskussion bei scobel: Vulva: Lust und Tabu. ZDF, Mai 2020. In: 3sat. (57:49 Minuten; verfügbar bis 22. April 2026; mit Sheila de Liz, Ann-Marlene Henning, Mithu Sanyal).
Einzelnachweise
- ↑ Michael Schünke, Erik Schulte, Udo Schumacher: PROMETHEUS - Allgemeine Anatomie. 6. Auflage, Thieme, Stuttgart / New York 2022. S. 240, 243.
- ↑ Berufsverband der Frauenärzte: Äußere Genitalien der Frau. In: frauenaerzte-im-netz.de, 26. März 2018, abgerufen am 15. Mai 2020;
Harriet Lerner: “V” is for vulva, not just vagina. In: LJ World.com. Mai 2003 (englisch);
Stephan Maus: Vulva: Das verschwiegene Sexorgan. In: Stern.de, 22. April 2009;
Florian Borchmeyer: „Das da unten“ – „Vulva“: Die Kulturgeschichte des weiblichen Geschlechts. ZDF-Sendung aspekte. 13. Februar 2009. - ↑ Scheide & Vulva: Das Zentrum der Lust! ( vom 14. Mai 2009 im Internet Archive) In: Bravo.de.
- ↑ Rauber, Kopsch: Lehrbuch und Atlas der Anatomie des Menschen. Abteilung 4: Eingeweide. 13. Auflage. Thieme, Leipzig 1929, S. ??.
- ↑ Wilfried Stroh: Sexualität und Obszönität in römischer „Lyrik“. In: Theo Stemmler, Stephan Horlacher (Hrsg.): Sexualität im Gedicht: 11. Kolloquium der Forschungsstelle für europäische Lyrik. Universität Mannheim 2000, ISBN 3-8233-4156-1, S. 11–49.
- ↑ Vulva. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 581.
- ↑ a b Arne Schäffler, Nicole Menche: Mensch – Körper – Krankheit. Biologie, Anatomie, Physiologie. Lehrbuch und Atlas für die Berufe im Gesundheitswesen. 3. überarbeitete und erweiterte Auflage. Urban & Fischer, München 1999, ISBN 3-437-55091-8, S. 396–397.
- ↑ G. H. Schuhmacher, G. Aumüller: Topographische Anatomie des Menschen. Urban & Fischer, München/Jena 2004, ISBN 3-437-41366-X.
- ↑ Gerhard Aumüller u. a.: Duale Reihe Anatomie. 2. Auflage. Thieme, Stuttgart 2010, ISBN 978-3-13-152862-9, S. 728.
- ↑ Theodor Heinrich Schiebler: Lehrbuch der gesamten Anatomie des Menschen: Cytologie, Histologie, Entwicklungsgeschichte, makroskopische und mikroskopische Anatomie. Springer-Verlag, Heidelberg/Berlin/New York 2013, ISBN 978-3-662-12240-2, S. 524.
- ↑ Gerhard Aumüller u. a.: Duale Reihe Anatomie. 2. Auflage. Thieme, Stuttgart 2010, ISBN 978-3-13-152862-9, S. 728.
- ↑ a b J. Lloyd, N. S. Crouch, C. L. Minto, L. M. Liao, S. M. Creighton: Female genital appearance: „normality“ unfolds. In: BJOG. Nr. 112, 2005, S. 643–646. PMID 15842291, doi:10.1111/j.1471-0528.2004.00517.x (freier Volltext).
- ↑ Ada Borkenhagen, Heribert Kentenich: Labienreduktion – Neuester Trend der kosmetischen Genitalkorrektur – Übersichtsarbeit. In: Geburtshilfe und Frauenheilkunde. Nr. 69, 2009, S. 19–23, doi:10.1055/s-2008-1039241.
- ↑ Es gibt fünf verschiedene Vagina-Typen, und sie alle sind wundervoll. Auf: mtv.de/news (Viva) vom 29. Oktober 2018; abgerufen am 20. Mai 2020.
- ↑ Das genormte Geschlecht – Frankfurter Allgemeine Zeitung
- ↑ L. Michala, S. Koliantzaki, A. Antsaklis: Protruding labia minora: abnormal or just uncool? In: Journal of Psychosomatic Obstetrics & Gynecology. Band 32, Nr. 3, 2011, S. 154–156. doi:10.3109/0167482X.2011.585726
- ↑ Wie sieht eigentlich eine «normale Vulva» aus?
- ↑ A. Kreklau, I. Vaz, F. Oehme, F. Strub, R. Brechbühl, C. Christmann, A. Günthert: Measurements of a ‘normal vulva’ in women aged 15–84: a cross‐sectional prospective single‐centre study. In: BJOG: An International Journal of Obstetrics & Gynaecology. 2018. doi:10.1111/1471-0528.15387
- ↑ K. E. Brodie, V. I. Alaniz, E. M. Buyers, B. T. Caldwell, E. C. Grantham, J. Sheeder, … P. S. Huguelet: A Study of Adolescent Female Genitalia: What is Normal?. Journal of Pediatric and Adolescent Gynecology. 2018. doi:10.1016/j.jpag.2018.09.007
- ↑ A. Kreklau, I. Vâz, F. Oehme, F. Strub, R. Brechbühl, C. Christmann: Measurements of a 'normal vulva' in women aged 15-84: a cross-sectional prospective single-centre study. In: BJOG. Band 125, Nr. 13, 2018, S. 1656–1661, doi:10.1111/1471-0528.15387, PMID 29940085. (freier Volltext).
- ↑ Darstellung der einzelnen akzessorischen Drüsen bei der Frau. ( vom 17. Dezember 2014 im Internet Archive) (Zeichnung) urologie3400.at
- ↑ Tara R. Franke: Eine sprudelnde Quelle der Lust: Die Drüsen des weiblichen Urogenitaltraktes. In: Deutsche Hebammen Zeitung. Elwin-Staude-Verlag, Oktober 2007 (PDF: 18 MB, 15 Seiten auf hebammenhandwerk.de ( vom 29. November 2014 im Internet Archive)).
- ↑ Carolin Küter: Die Klitoris, das unbekannte Organ. Auf: deine-korrespondentin.de vom 30. November 2016.
- ↑ Anna Knöfel Magnusson: Vaginal corona: Myths surrounding virginity: your questions answered. Brommatryck & Brolins AB, Stockholm 2009, ISBN 978-91-85188-43-7, S. ? (englisch; PDF: 544 kB, 22 Seiten auf rfsu.se ( vom 13. Mai 2014 im Internet Archive)).
- ↑ Pschyrembel, 256. Auflage. Berlin 1990: „Carunculae hymenales myrtiformes: myrtenblattförmige Reste des zerstörten Hymens; i. a. nach Geburten.“
- ↑ Roche Lexikon Medizin. 4. Auflage. Urban & Fischer, München 1999.
- ↑ a b Theodor H. Schiebler, Horst-W. Korf: Anatomie: Histologie, Entwicklungsgeschichte, makroskopische und mikroskopische Anatomie, Topographie. Springer, 2007, ISBN 978-3-7985-1770-7 (Volltext in der Google-Buchsuche).
- ↑ Hymen. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 225–226.
- ↑ a b c d Uwe Gille: Weibliche Geschlechtsorgane. In: F.-V. Salomon u. a. (Hrsg.): Anatomie für die Tiermedizin. 2., erw. Auflage. Enke, Stuttgart 2008, ISBN 978-3-8304-1075-1, S. 379–389.
- ↑ Van A. T. Ginger, Christopher J. Cold, Claire C. Yang: Structure and Innervation of the Labia Minora: More Than Minor Skin Folds. In: Female Pelvic Medicine & Reconstructive Surgery. Band 17, Nummer 4, Juli–August 2011, S. 180–183 (PDF: 1,2 MB, 4 Seiten auf iscgmedia.com ( vom 22. Dezember 2015 im Internet Archive)).
- ↑ Die nervale Innervation. (Bild) Aus: Georgine Lamvu u. a.: Vulvodynia: An Under-recognized Pain Disorder Affecting 1 in 4 Women and Adolescent Girls – Integrating Current Knowledge Into Clinical Practice. In: CME/CE. 4. Januar 2013.
- ↑ Roland Schiffter: Neurologie des vegetativen Systems. Springer, Heidelberg/Berlin/New York 2013, ISBN 978-3-642-93269-4, S. 112–118.
- ↑ Per Olov Lundberg: Die periphere Innervation der weiblichen Genitalorgane. In: Sexuologie. Band 9, Nr. 3, 2002, S. 98–106, sexuologie-info.de (PDF; 2,3 MB).
- ↑ Van Anh T. Ginger, Claire C. Yang: Functional Anatomy of the Female Sex Organs. In: J. P. Mulhall u. a. (Hrsg.): Cancer and Sexual Health. (= Springer Science, Current Clinical Urology. Band 13), S. 13–23. doi:10.1007/978-1-60761-916-1_2, beck-shop.de/fachbuch/leseprobe (PDF).
- ↑ Roland Schiffter: Neurologie des vegetativen Systems. Springer, Berlin 2013, ISBN 978-3-642-93269-4, S. 104.
- ↑ D. Müller: Zur Problematik korpuskulärer Rezeptoren im Bereich des inneren weiblichen Genitale. In: Gynaecologia. Band 159, Nr. 3, 1965, S. 143–152, doi:10.1159/000303507.
- ↑ Hans-Joachim Ahrendt, Cornelia Friedrich (Hrsg.): Sexualmedizin in der Gynäkologie. Springer, Berlin/Heidelberg/New York 2015, ISBN 978-3-642-42060-3, S. 19.
- ↑ Daniel Baumhoer, Ingo Steinbrück, Werner Götz: Histologie. Elsevier, Urban & Fischer, 2003, ISBN 3-437-42231-6 (Volltext in der Google-Buchsuche).
- ↑ Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. Thieme, 2006, ISBN 3-13-129242-3 (Volltext in der Google-Buchsuche).
- ↑ D. Berry Hart, A. H. Barbour: Hart’s line. In: Manual of Gynecology. Edinburgh 1882; „the hymen separates the external genitals from the internal genitals“ Auf: hymen-virgin-membrane.com; abgerufen am 14. März 2016.
- ↑ Manfred Dietel: Pathologie: Mamma, Weibliches Genitale, Schwangerschaft und Kindererkrankungen. Springer-Verlag, Heidelberg/New York 2012, ISBN 978-3-642-04564-6, S. 254.
- ↑ Michael K. Hohl, Gudrun Mehring: Schmerzhafte Vulva: Vulvodynie, Vestibulitis. In: Frauenheilkunde aktuell. (FHA), 21. Januar 2012, ISSN 1663-6988, S. 4–16. kantonsspitalbaden.ch ( vom 13. März 2016 im Internet Archive) (PDF).
- ↑ E. Szabó, B. Hargitai, A. Regos u. a.: TRA-1/GLI controls the expression of the Hox gene lin-39 during C. elegans vulval development. In: Developmental Biology. Band 330, Nr. 2, 2009, S. 339–348. PMID 19361495.
- ↑ Nadja Møbjerg: Organe der Osmoregulation und Exkretion. In: W. Westheide und R. Rieger: Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-0307-3, S. 151.
- ↑ Hartmut Greven: Fortpflanzung und Entwicklung. In: W. Westheide, R. Rieger: Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-0307-3, S. 151.
- ↑ Oskar Schaller, Gheorghe M. Constantinescu: Illustrated Veterinary Anatomical Nomenclature. Thieme, Stuttgart 2007, ISBN 978-3-8304-1069-0, S. 224.
- ↑ Robert Pies-Schulz-Hofen: Die Tierpflegerausbildung. Parey, Singhofen 2004, S. 474.
- ↑ C. Aurich: Reproduktionsmedizin beim Pferd: Gynäkologie – Andrologie – Geburtshilfe. Parey, Sindhofen 2008, S. 16.
- ↑ Vergleiche die Evolution der Säugetiere
- ↑ Milton Hildebrand, George Goslow: Vergleichende und funktionelle Anatomie der Wirbeltiere. Springer-Verlag, Berlin/Heidelberg/New York 2013, ISBN 978-3-642-18951-7, S. 328–335.
- ↑ Altaf Begum, Afzal Sheikh, Bilal Mirza: Reconstructive Surgery in a Patient with Persistent Cloaca. Casereport. In: APSP J Case Rep. Band 2, 2011, S. 23, PMC 3418031 (freier Volltext)
- ↑ U. Drews: Geschlechtsspezifische Entwicklung. In: Karl-Heinrich Wulf, Heinrich Schmidt-Matthiesen (Hrsg.): Klinik der Frauenheilkunde und Geburtshilfe. Band 1: Gynäkologische Endokrinologie. 2. Auflage. Urban & Schwarzenberg, München u. a. 1987, ISBN 3-541-15010-6, S. 3–24.
- ↑ Miranda A. Farage, Howard I. Maibach: The vulva: anatomy, physiology, and pathology. CRC Press, 2006, ISBN 0-8493-3608-2 (Volltext in der Google-Buchsuche).
- ↑ a b V. Küppers, H. G. Bender: Blickdiagnostik Vulva. Elsevier, Urban & Fischer, München u. a. 2003, ISBN 3-437-23270-3 (Volltext in der Google-Buchsuche).
- ↑ A. Mewitz, E. Knaute, S. Hennig, N. Berger: Wodurch wird das Sexualverhalten älterer und alter Menschen beeinflusst und welchen Einfluss hat dies auf die Pflege? GRIN, 2008, ISBN 978-3-640-13688-9 (Volltext in der Google-Buchsuche).
- ↑ Kirsten von Sydow: Die Sexualität älterer Frauen: Der Einfluß von Menopause, anderen körperlichen sowie gesellschaftlichen und partnerschaftlichen Faktoren. In: Zeitschrift für ärztliche Fortbildung & Qualitätssicherung. Nr. 94, 2000, S. 223–229.
- ↑ M. Basaran, R. Kosif, U. Bayar, B. Civelek: Characteristics of external genitalia in pre- and postmenopausal women. In: Climacteric. Nr. 11, 2008, S. 416–421. PMID 18781487.
- ↑ a b A. Wolf: Beschwerden der Wechseljahre und Altersveränderungen an Urogenitale und Mammae. In: Christian Lauritzen: Altersgynäkologie.Thieme, Stuttgart 1997, ISBN 3-13-106891-4.
- ↑ Warren S. T. Hays: Human pheromones: have they been demonstrated? In: Behavioral Ecology and Sociobiology. Band 54, Nummer 2, Juli 2003, S. 89–97, doi:10.1007/s00265-003-0613-4
- ↑ Richard P. Michael, R. W. Bonsall, M. Kutner: Volatile fatty acids, “copulins”, in human vaginal secretions. In: Psychoneuroendocrinology. 1975, Band 1, Nr. 2, S. 153–163. PMID 1234654.
- ↑ Hans-Rudolf Tinneberg, Michael Kirschbaum, F. Oehmke (Hrsg.): Gießener Gynäkologische Fortbildung 2003: 23. Fortbildungskurs für Ärzte der Frauenheilkunde und Geburtshilfe. Springer-Verlag, Berlin/Heidelberg/New York 2013, ISBN 978-3-662-07492-3, S. 151.
- ↑ R. P. Michael, E. B. Keverne: Pheromones in the communication of sexual status in primates. In: Nature. Nr. 218, 1968, S. 746–749.
- ↑ R. P. Michael, E. B. Keverne, R. W. Bonsall: Pheromones: isolation of male sex attractants from a female primate. In: Science. Nr. 172, 1971, S. 964–966. PMID 4995585.
- ↑ R. F. Curtis, J. A. Ballantine, E. B. Keverne u. a.: Identification of primate sexual pheromones and the properties of synthetic attractants. In: Nature. Nr. 232, 1971, S. 396–398.
- ↑ Gunther Göretzlehner, Christian Lauritzen, Ulf Göretzlehner: Praktische Hormontherapie in der Gynäkologie. De Gruyter, Berlin 2007, ISBN 978-3-11-019044-1, S. 16.
- ↑ A. E. Narjani: Considérations sur les causes anatomique de la frigidité chez la femme. In: Journal Médicale de Bruxelles. Einzeldruck aus Band 42, Imprimerie Médicale et Scientifique (s. a.), Brüssel, 27. April 1924, S. 1–11.
- ↑ Lisa Appignanesi, John Forrester: Die Frauen Sigmund Freuds. Deutscher Taschenbuch-Verlag (DTV), München 1996, ISBN 3-423-30550-9, S. 451–471.
- ↑ Carney Landis, Agnes T. Landis, M. Marjorie Bolles et al.: Sex in development: a study of the growth and development of the emotional and sexual aspects of personality together with physiological, anatomical, and medical information on a group of 153 normal women and 142 female psychiatric patients. P. B. Hoeber, New York, London 1940; Neuauflage: McGrath Publications, Maryland 1970.
- ↑ W. H. Staff: ‘‘The Location Of Your Clit Might Determine How Easily You Orgasm’’. In: Women’s Health, 1. Oktober 2019.
- ↑ Kim Wallen
- ↑ [Kim Wallen], Elisabeth Lloyd: Female sexual arousal: Genital anatomy and orgasm in intercourse. In: Hormones and behavior. Band 59, Nr. 5, Mai 2011, S. 780–792, doi:10.1016/j.yhbeh.2010.12.004. PMID 21195073, PMC 3894744 (freier Volltext) und Handzeichnung von Bonaparte'; Regina Nuzzo: Female orgasms and a ‘rule of thumb’ . In: Los Angeles TimesÄÄ, 11. Februar 2008; Dennis Thompson: Anatomy May Be Key to Female Orgasm. In: Healthy Day, 21. April 2016; W. H. Staff: The Location Of Your Clit Might Determine How Easily You Orgasm. In: Women’s Health, 1. Oktober 2019.
- ↑ Betty Dodson: Sex for One: The Joy of Selfloving. Crown Trade Paperbacks, New York 1996, ISBN 0-517-88607-3; Betty Dodson: Orgasms for Two – the joy of partnersex. Harmony 1. Juli 2003.
- ↑ Regina Nuzzo: Female orgasms and a ‘rule of thumb’. In: Los Angeles Times, 11. Februar 2008.
- ↑ Berufsverband der Frauenärzte: Sexuelle Lust und der weibliche Orgasmus. In: frauenaerzte-im-netz.de, 23. Juli 2018, abgerufen am 15. Mai 2020.
- ↑ J. R. Berman: Physiology of female sexual function and dysfunction. In: International Journal of Impotence Research. Nr. 17, 2005, S. 44–51 (englisch; doi:10.1038/sj.ijir.3901428).
- ↑ J. G. Kurt, B. Schmailzl, Joachim Hackelöer: Schwangerschaft und Krankheit: Wechselwirkung, Therapie, Prognose. Thieme, Stuttgart u. a. 2002, ISBN 3-89412-446-6 (Volltext in der Google-Buchsuche).
- ↑ Joachim W. Dudenhausen: Frauenheilkunde und Geburtshilfe. De Gruyter, Berlin/New York 2002, ISBN 3-11-016562-7 (Volltext in der Google-Buchsuche).
- ↑ Urs Jenal – Biozentrum Universität Basel: Der Mensch und seine Mikroorganismen: Interaktionen zwischen Krankheit und Wohlbefinden. (Wieviel Mensch ist ein Mensch?) biozentrum.unibas.ch ( vom 4. März 2016 im Internet Archive) (PDF).
- ↑ H. Hinghofer-Szalkay – Medizinische Universität Graz: Abwehrvorgänge (Immunologie). Abwehrstrategien, mikrobielle Besiedlung des Körpers. In: user.medunigraz.at, abgerufen am 19. September 2015.
- ↑ Erwin Kehrer, Rud. Th. v. Jaschke: Die Vulva und ihre Erkrankungen, Lage- und Bewegungsanomalien des weiblichen Genitalapparates. In: Walter Stoeckel (Hrsg.): Handbuch der Gynäkologie, Dritte, völlig neubearbeitete und erweiterte Auflage des Handbuches der Gynäkologie von J. Veit. Band 5/1, Springer-Verlag, Berlin/Heidelberg/New York 2013, ISBN 978-3-642-96015-4, S. 30 f.
- ↑ Andrea Buchberger: Infektionen an Vulva, Vagina und Zervix. Literarische Übersichtsarbeit und Internetkompendium. Dissertationsschrift. Universität München, München 2009. Auf UB.Uni-Muenchen.de (PDF; 1,7 MB), abgerufen am 30. November 2020.
- ↑ Jürgen Schulze, Ulrich Sonnenborn, Tobias Ölschläger: Probiotika. Mikroökologie, Mikrobiologie, Qualität, Sicherheit und gesundheitliche Effekte. Thieme, Stuttgart 2008, ISBN 978-3-8304-5460-1, S. 15–16.
- ↑ Axel Kramer, D. Gröschel, P. Heeg u. a.: Klinische Antiseptik. Springer-Verlag, Heidelberg/Berlin/New York 2013, ISBN 978-3-642-77715-8, S. 193–194.
- ↑ E. Copcu u. a.: Idiopathic isolated clitoromegaly: A report of two cases. In: Reprod Health. Nr. 1, 2004, S. 1–6. PMID 523860.
- ↑ a b Volker Pelzer, Ursula Holthusen: Vulvaveränderungen im Kindes- und Jugendalter. In: korasion. Nr. 1, 2001, (online) ( vom 1. Februar 2014 im Internet Archive).
- ↑ Saira-Christine Renteria, Bärbel Hirrle: Vulvaerkrankungen beim Mädchen im Kindesalter. In: Pädiatrie. Nr. 11, 2005, S. 13–16, (online) PDF-Dokument.
- ↑ G. Golombowski, S. Anthuber, C. Anthuber: Vulvaerkrankungen im Kindesalter. In: Gynäkologe. Nr. 31, 1998, S. 558–565, doi:10.1007/s001290050297
- ↑ Dominik O. Müller: Vollständige Synechie der grossen Labien. In: Schweiz Med Forum. Nr. 25, 2002, S. 617, medicalforum.ch (PDF; 135 kB)
- ↑ Marlene Heinz: Synechien der Vulva. Exakte Blickdiagnose – sorgfältige Therapie. In: gynäkologie + geburtshilfe. Nr. 12, 2009, S. 45–47. (Seite nicht mehr abrufbar, festgestellt im Juni 2018. Suche in Webarchiven)
- ↑ C. Goldnau, A. Köninger, R. Kimmig: Das äußere Genitale der Frau Pathologische Befunde und initiale Behandlungsschritte. In: Der Urologe. Band 49, Nr. 12, Dezember 2010, S. 1–7, Springer-Verlag, doi:10.1007/s00120-010-2407-4, uk-essen.de ( vom 25. Februar 2015 im Internet Archive) (PDF).
- ↑ Eiko E. Petersen: Frauen mit chronischen Vulvabeschwerden. Schwierige Frauen oder nur schwierige Diagnose? In: Frauenarzt. Band 53, Nr. 3, 2012, S. 246–252, ag-cpc.de ( vom 22. Dezember 2015 im Internet Archive) (PDF).
- ↑ a b c Jonathan Batchelor, Jane Sterling: Skin disorders affecting the vulva. In: Obstetrics, Gynaecology & Reproductive Medicine. Band 18, Nr. 3, März 2008, S. 53–59.
- ↑ Vulvitis. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 582.
- ↑ Enno Christophers, Markward Ständer: Haut- und Geschlechtskrankheiten. Elsevier, Urban & Fischer, 2003, ISBN 3-437-26710-8 (Volltext in der Google-Buchsuche).
- ↑ Werner Rath: Erkrankungen in der Schwangerschaft. Thieme, 2004, ISBN 3-13-136271-5 (Volltext in der Google-Buchsuche).
- ↑ Rachan Chaudhary, Sudhir Rathi, Amit Maheshwari, Shipra Nigam: Vulvar Elephantiasis of Filarial Origin: A Case Report. In: Indian Journal of Clinical Practice. Band 24, Nr. 2, Juli 2013, S. 160–162 (Volltext) ( des vom 5. August 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF)
- ↑ Arun Prasath Palanisamy, Kamalakannan Kutuwa Kanakaram, Sivasubramanian Vadivel, Srivenkateswaran Kothandapany: Vulval elephantiasis. In: Indian Dermatol Online J. Band 6, Nr. 5, September-Oktober 2015, S. 371. doi:10.4103/2229-5178.164470, PMC 4594409 (freier Volltext).
- ↑ Satish Kumar Ranjan, Mini Sinha, Nawal K. Jha, D. K. Sinha, Amrisha Sharan: Giant Vulvar Elephantiasis of Filarial Origin: A Rare Case Report. In: Journal of Dental and Medical Sciences (IOSR-JDMS). Band 14, Nr. 11, Ver. II, November 2015, S. 38–40 (Villtext (PDF; 392 kB) ).
- ↑ Tropische Dermatosen; juxtaartikuläre Knoten; Rattenbißkrankheit Handbuch der Haut- und Geschlechtskrankheiten. Deutsche Dermatologische Gesellschaft, Springer-Verlag, Berlin/Heidelberg/New York 2013, ISBN 978-3-7091-3057-5, S. 514–515.
- ↑ Vulvadystrophie. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 581.
- ↑ Vulvadystrophie. In: Pschyrembel Medizinisches Wörterbuch. 257. Auflage. De Gruyter, Berlin 1993, ISBN 3-933203-04-X, S. 1648.
- ↑ a b Vulvodynie. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 582.
- ↑ N. Hermes, F. G. Bechara, P. Altmeyer, M. Stücker: Erfolgreiche Schaumsklerosierung einer Vulvavarikose. In: Phlebologie. Nr. 33, 2004, S. 199–201, schattauer.de ( vom 21. September 2013 im Internet Archive) (PDF; 115 kB).
- ↑ B. K. Chilla, P. R. Knüsel, Ch. L. Zollikofer, Th. Huber, R. A. Kubik-Huch: Beckenvenensyndrom. In: Praxis. 2006, Band 95, Nr. 41, ISSN 1661-8165, S. 1583–1588, doi:10.1024/1661-8157.95.41.1583.
- ↑ Stichwort „Vulvektomie“ in Pschyrembel Medizinisches Wörterbuch. 257. Auflage. De Gruyter, Berlin 1993, ISBN 3-933203-04-X, S. 1648.
- ↑ Vulvektomie. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 582.
- ↑ Scribonius Largus: Compositiones, CIV
- ↑ a b Alois Walde, Johann Baptist Hofmann: Lateinisches etymologisches Wörterbuch. (= Indogermanische Bibliothek. Band 2). 4., neu bearbeitete Auflage. Winter, Heidelberg 1965, s. v. volva
- ↑ Alois Vaniček: Griechisch-lateinisches etymologisches Wörterbuch. Band II, Teubner, Leipzig 1877, S. 916–918; August Fick: Vergleichendes Wörterbuch der Indogermanischen Sprachen. 4. Auflage. Teil I, S. 132.
- ↑ Horaz, Epist. I, xv, 41: nil vulva pulchrius ampla („nichts schöner als eine große Gebärmutter“); zur Auswahl des geeigneten Schlachtviehs unter dem Gesichtspunkt des Alters und des bei einer trächtigen Sau geeigneten Schlachtzeitpunktes Plinius der Ältere, Naturalis historia 11,84,210–211; zur Zubereitung Apicius, De re coquinaria, VII,1
- ↑ Feminis eadem omnia praeterque vesicae iunctus utriculus, unde dictus uterus. quod alio nomine locos appellant, hoc in reliquis animalibus volvam. Nat. Hist. XI, lxxxiv, 209
- ↑ Aulus Cornelius Celsus: De medicinia VI, 18, u. ö.
- ↑ Vulva vocata quasi valva, id est ianua ventris, vel quod semen recipiat, vel quod ex ea foetus procedat. Etym. 11.1.137. Reinier de Graaf, der im 17. Jahrhundert erstmals die weibliche Ejakulation beschrieb, behauptete gar eine Ableitung von volo, „ich will“, da die Vulva stets „unersättlich“ nach Verkehr verlange, zitiert von Joseph Hyrtl: Onomatologia anatomica. Braumüller, Wien 1880, S. 620–623.
- ↑ a b Klaus Heer: Wonneworte. Lustvolle Entführung aus der sexuellen Sprachlosigkeit. Salis, Zürich 2007, ISBN 978-3-905801-02-6.
- ↑ Carolina Schwarz: „Sex Education“ und „Goop Lab“: Vulva – was war das nochmal? In: Die Tageszeitung: taz. 10. Februar 2020, ISSN 0931-9085 (taz.de [abgerufen am 24. Juni 2021]).
- ↑ Souzan AlSabah: VULVINA intersektional. Körper • Macht • Empowerment. stolzeaugen.books UG, Köln 2023, ISBN 978-3-949258-03-9.
- ↑ Joseph Hyrtl: Die alten deutschen Kunstworte der Anatomie. Braumüller, Wien 1884; Neudruck: Fritsch, München 1966, S. 17.
- ↑ Claudia Haarmann: „Unten rum…“ Die Scham ist nicht vorbei. Knaur Taschenbuch, Köln 2005, ISBN 978-3-426-78024-4.
- ↑ Real Academia Española: Diccionario de la lengua española de la Real Academia Española. digitale Version der 22. Auflage, Madrid 2011, Eingabestichwort coño Auf: buscon.rae.es; abgerufen am 20. September 2015.
- ↑ a b c d e f Mithu M. Sanyal: Vulva - Die Enthüllung des unsichtbaren Geschlechts. 7. Auflage. Wagenbach, 2020, ISBN 978-3-8031-2769-3, S. 9,13–19,22,30,36.
- ↑ a b Mithu M. Sanyal: Vulva. Die Enthüllung des unsichtbaren Geschlechts. Wagenbach, Berlin 2009, ISBN 978-3-8031-3629-9.
- ↑ Ashley Fetters: The New Full-Frontal: Has Pubic Hair in America Gone Extinct? In: theatlantic.com, (The Atlantic) 13. Dezember 2011; abgerufen am 12. März 2016.
- ↑ Paul-Philipp Hanske: Schamlos Eine Mode wird zur Norm: Alle rasieren sich. In: sz-magazin.sueddeutsche.de, Süddeutsche Zeitung. Heft 47/2013; abgerufen am 12. März 2016.
- ↑ T. Gohla, A. Gohritz: Ästhetisch-plastische Chirurgie der weiblichen Genitalregion. In: Journal für Ästhetische Chirurgie. Band 7, Nummer 4, 2014, S. 211–219, doi:10.1007/s12631-014-0299-7.
- ↑ A. M. McPencow, M. K. Guess: Giving female genital cosmetic surgery a facelift. In: Maturitas. Band 71, Nummer 4, 2012, S. 313–314, doi:10.1016/j.maturitas.2012.01.012.
- ↑ Siobhan Norton: Vaginas have become the new talking point, as the labiaplasty and 'vagacials’ are on the rise. Auf: independent.co.uk (The Independent) vom 21. Januar 2015; abgerufen am 12. März 2016.
- ↑ Susan Scutti: The Lure Of Vaginal Rejuvenation And Labiaplasty: Barbie, Barbie Everywhere. In: medicaldaily.com, (Medical Daily) vom 25. Januar 2015; abgerufen am 12. März 2016.
- ↑ Erich Kasten, K. Hoffmann: Female genital esthetics. Comparison of preferences of men and women. In: Journal für Ästhetische Chirurgie. 2018, S. 1–9. doi:10.1007/s12631-018-0123-x.
- ↑ M. L. P. O. Sangiorgi, L. A. D. S. Lara, M. R. Lerri, R. A. Ferriani, A. P. M. S. Romão: The Preference of Women and Men Regarding Female Genital Depilation. In: Rev Bras Ginecol Obstet. Band 39, Nr. 9, 2017, S. 488–495, doi:10.1055/s-0037-1604472, PMID 28783855.
- ↑ P. Obst, K. White, E. Matthews: A full Brazilian or all natural: understanding the influences on young women's decision to remove their pubic hair. In: BMC Womens Health. Band 19, Nr. 1, 2019, S. 164, doi:10.1186/s12905-019-0868-1, PMID 31856800, PMC 6921585 (freier Volltext).
- ↑ P. Enzlin, K. Bollen, S. Prekatsounaki, L. Hidalgo, L. Aerts, J. Deprest: "To Shave or Not to Shave": Pubic Hair Removal and Its Association with Relational and Sexual Satisfaction in Women and Men. In: J Sex Med. Band 16, Nr. 7, 2019, S. 954–962, doi:10.1016/j.jsxm.2019.04.005, PMID 31103484 (kuleuven.be).
- ↑ Klitoridektomie. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 276.
- ↑ Christoph Zerm: Weibliche Genitalverstümmelung als ein komplexes Phänomen. In: Sexuologie. (Herausgegeben von der Akademie für Sexualmedizin.) Band 16, Nr. 1–2, Elsevier / Urban & Fischer, 2009, S. 2–3, sexuologie-info.de (PDF; 1,2 MB).
- ↑ Department of Reproductive Health and Research WHO: Eliminating female genital mutilation. An interagency statement – OHCHR, UNAIDS, UNDP, UNECA, UNESCO, UNFPA, UNHCR, UNICEF, UNIFEM, WHO, 2008.
- ↑ Debra Herbenick, Vanessa Schick, Michael Reece u. a.: Pubic hair removal among women in the United States: Prevalence, methods and characteristics. In: The Journal of Sexual Medicine. Band 7, Nr. 10, Oktober 2010, S. 3322–3330, doi:10.1111/j.1743-6109.2010.01935.x
- ↑ Zentralrat der Muslime: FAQ – Antwortseite: VII. Islam und Medizin: 8. Hygienevorschriften. ( vom 31. März 2016 im Internet Archive) Auf: islam.de; abgerufen am 12. März 2016.
- ↑ Layla Beicht: Untersuchung zur Sexualhygiene bei arabischen und deutschen Patientinnen. Dissertation, Ludwig-Maximilians-Universität zu München, 2006, S. 5 und 13 DNB 983270872/34
- ↑ Schönheit unter der Gürtellinie: Die Schamhaare zu rasieren gehört zum modischen Diktat, dem sich inzwischen eine Mehrheit unterwirft. Auch Intimchirurgie ist kein Tabu. Ein nicht ungefährlicher Trend und seine Ursachen. In: Die Zeit. Ausgabe 15. Juli 2009.
- ↑ Elmar Brähler, Dirk Hofmeister: Verbreitung von Tätowierungen, Piercing und Körperhaarentfernung in Deutschland. In: Pressemitteilung. Universität Leipzig, 13. Juli 2009, S. 2 und 7; abgerufen am 11. Februar 2010. Ergebnisse einer Repräsentativerhebung in Deutschland im Mai und Juni 2009, N = 2512 (beiderlei Geschlechts).
- ↑ Risiko Rasieren? Gesund trotz Intimrasur. In: scheidenpilz.com, Letzte Aktualisierung am 11. Juli 2013, abgerufen am 18. Juni 2014.
- ↑ Intimrasur steigert Risiko von Haarwurzelentzündungen. ( vom 2. Juli 2012 im Webarchiv archive.today) Auf: net-tribune 5. Dezember 2008; zuletzt abgerufen über archive.today am 18. Juni 2014.
- ↑ a b c Ada Borkenhagen, Elmar Brähler, Heribert Kentenich: Intimchirurgie: Ein gefährlicher Trend. In: Deutsches Ärzteblatt. 2009, Band 106, Nr. 11: A-500/B-430/C-416, aerzteblatt.de (PDF; 305 kB).
- ↑ Gynäkologin Wolf über Hymen-Rekonstruktion. In: taz. Abgerufen am 1. Oktober 2013.
- ↑ Schönheitswahn unter der Gürtellinie – Die Lust am Umbau des eigenen Körpers kennt keine Grenzen – auch keine Schamgrenzen. ( vom 28. März 2009 im Internet Archive) Auf: blick.ch vom 20. Juli 2008.
- ↑ Angelika Unger: Intim-OPs: Wie schön ist meine Scham? Schönheits-OPs im Intimbereich – ein Tabu-Thema wird Trend. Was steckt dahinter? ( vom 29. Januar 2009 im Internet Archive) Auf brigitte.de; abgerufen am 21. Juni 2014.
- ↑ Kunst am Körper, Leiden für die Leidenschaft. In: Spiegel TV. vom 15. April 2008.
- ↑ G. T. van der Meer, W. C. M. Weijmar Schultz, J. M. Nijman: Intimate body piercings in women. In: Journal of Psychosomatic Obstetrics & Gynecology. Band 29, 2008, S. 235–239.
- ↑ A. Borkenhagen, E. Brähler: Die nackte Scham. In: Ada Borkenhagen, Elmar Brähler (Hrsg.): Schwerpunktthema: Intimmodifikationen – Editorial. In: Psychosozial. Band 112, 2008, S. 7–12.
- ↑ Vaughn S. Millner u. a.: First glimpse of the functional benefits of clitoral hood piercings. In: American Journal of Obstetrics and Gynecology. Band 193, 2005, S. 675–676.
- ↑ Nicola Siegmund-Schultze: Piercing – Unter die Haut: Körperschmuck mit Risiken. In: Deutsches Ärzteblatt. Nr. 105, 2008, A-1542, aerzteblatt.de
- ↑ L. B. Mayers, D. A. Judelson, B. W. Moriarty, K. W. Rundell: Prevalence of body art (body piercing and tattooing) in university undergraduates and incidence of medical complications. In: Mayo Clin Proc. 2002, Nr. 77, S. 29–34.
- ↑ a b Vulvakulte. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 581.
- ↑ Nicholas J. Conard: A female figurine from the basal Aurignacian of Hohle Fels Cave in southwestern Germany. (PDF). In: Nature. London 459, 2009, S. 248–252.
- ↑ Nicholas J. Conard, Maria Malina: Spektakuläre Funde aus dem unteren Aurignacien vom Hohle Fels bei Schelklingen, Alb-Donau-Kreis. In: Archäologische Ausgrabungen in Baden-Württemberg 2008. Theiss, Stuttgart 2009, S. 19–22.
- ↑ a b c d e f g h i Ann-Sophie Lehmann: Der schamlose Körper. In: Beat Wismer, Sandra Badelt (Hrsg.): Diana und Actaeon – Der verbotene Blick auf die Nacktheit. Katalog zur gleichnamigen Ausstellung im museum Kunstpalast, Düsseldorf. Hatje Cantz, Ostfildern 2009, ISBN 978-3-7757-2357-2, S. 192–197.
- ↑ Yoni. In: Pschyrembel Wörterbuch Sexualität. De Gruyter, Berlin 2006, ISBN 3-11-016965-7, S. 596.
- ↑ a b Sandra Badelt: Die nackte Wahrheit. Betrachtungen zum exponierten Geschlecht in der zeitgenössischen Kunst. In: Beat Wismer, Sandra Badelt (Hrsg.): Diana und Actaeon – Der verbotene Blick auf die Nacktheit. Katalog zur gleichnamigen Ausstellung im museum Kunstpalast, Düsseldorf. Hatje Cantz, Ostfildern 2009, ISBN 978-3-7757-2357-2, S. 199–201.
- ↑ a b c Claudia Delank: Frühlingsbilder (Shunga). Japanische erotische Holzschnitte. In: Beat Wismer, Sandra Badelt (Hrsg.): Diana und Actaeon – Der verbotene Blick auf die Nacktheit. Katalog zur gleichnamigen Ausstellung im museum Kunstpalast, Düsseldorf. Hatje Cantz, Ostfildern 2009, ISBN 978-3-7757-2357-2, S. 258–270.
- ↑ Tobias G. Natter: Über die Grenzen des Vorstellbaren. Das Nackte und das Öffentliche in der Wiener Kunst um 1900. In: Tobias G. Natter, Max Hollein (Hrsg.): Die nackte Wahrheit. Klimt, Schiele, Kokoschka und andere Skandale. Veröffentlichung zur gleichnamigen Ausstellung der Schirn Kunsthalle Frankfurt und des Leopold Museum Wien. Prestel Verlag, München 2005, ISBN 3-7913-3284-8, S. 17–42.
- ↑ a b c Angelika Muthesius, Burkhard Riemschneider (Hrsg.): Erotik in der Kunst des 20. Jahrhunderts. Benedikt Taschen Verlag, Köln 1993, ISBN 3-8228-0447-9.
- ↑ Ralf Vulis: 100 Naked Girls on a Chair. Edition Reuss, 2001, ISBN 3-934020-08-9.
- ↑ Frannie Adams: Pussy Portraits. Edition Reuss, 2009, ISBN 978-3-934020-69-6.
- ↑ Hans Peter Duerr: Der Mythos vom Zivilisationsprozeß. Band 2, Suhrkamp, Frankfurt am Main 1990, S. 252.
- ↑ Mithu M. Sanyal: Vulva: Die Enthüllung des unsichtbaren Geschlechts. Wagenbach, Berlin 2009, ISBN 978-3-8031-3629-9.
- ↑ Near the Big Chakra (1971). In: IMDb. Abgerufen am 23. Januar 2021 (englisch).
- ↑ Scott MacDonald: Two Interviews. Demystifying the Female Body: Anne Severson: „Near the Big Chakra“. Yvonne Rainer: „Privilege“. In: Film Quarterly. Band 45, Nr. 1. University of California Press, 1991, S. 18–32, JSTOR:1212670.
- ↑ Webpräsenz des virtuellen Vaginamuseums
- ↑ Japanerin wegen Vagina-Kunstwerks vor Gericht. Auf: orf.at vom 15. April 2015.
- ↑ Japan vagina artist cleared over kayak model but fined for data distribution. In: BBC News. 9. Mai 2016 (bbc.co.uk [abgerufen am 27. August 2017]).
- ↑ I Show Flag - The art project. Auf: ishowflag.wixsite.com; zuletzt abgerufen am 14. Februar 2021.
- ↑ Mirko Hecht: FAQs: Wie und wann bist Du dazu gekommen Vulven-Abdrücke zu machen? Abgerufen am 13. Februar 2021.
- ↑ The Great Wall of Vagina. Portfolio - Jamie McCartney - beides Auf: jamiemccartney.com; zuletzt abgerufen am 14. Februar 2021.
- ↑ Education. - The Great Wall of Vagina Auf: greatwallofvagina.co.uk; zuletzt abgerufen am 14. Februar 2021.
- ↑ Genital Art. Internal Vaginas - Jamie McCartney - beides Auf: jamiemccartney.com; zuletzt abgerufen am 14. Februar 2021.