Wikipedia:Redaktion Chemie/Archiv/2019/Januar
Hallo zusammen, hat zufällig jemand Zugriff auf Ullmanns Enzyklopädie der Technischen Chemie bzw. Ullmann's Encyclopedia of Industrial Chemistry und könnte damit die letzten Änderungen im o.g. Artikel verifizieren? Danke und Gruß - Ra'ike Disk. P:MIN 23:39, 4. Jan. 2019 (CET)
- Ich kann nachher mal in der englischen Ausgabe nachsehen, aber dass ein Abbau (über Andalusit-Sande, daraus wird künstlich Mullit hergestellt) in Transvaal stattfindet steht auch anderswo, zum Beispiel Industrial Minerals and Rocks, im Römpp oder in dem Spektrum Lexikon Geowissenschaften.--Claude J (Diskussion) 08:40, 5. Jan. 2019 (CET)
- Ja steht in der engl. Ullmann Ausgabe 2011: "Deposits. Natural mullite is mined from only one significant deposit in northern Transvaal (Otavi Mining Company). The production rate is ca. 5000 t/a".--Claude J (Diskussion) 01:15, 6. Jan. 2019 (CET)
- Ok, dann passt's ja. Vielen Dank für's Nachschauen und beste Grüße -- Ra'ike Disk. P:MIN 17:50, 7. Jan. 2019 (CET)
- Ja steht in der engl. Ullmann Ausgabe 2011: "Deposits. Natural mullite is mined from only one significant deposit in northern Transvaal (Otavi Mining Company). The production rate is ca. 5000 t/a".--Claude J (Diskussion) 01:15, 6. Jan. 2019 (CET)
- Ich kann nachher mal in der englischen Ausgabe nachsehen, aber dass ein Abbau (über Andalusit-Sande, daraus wird künstlich Mullit hergestellt) in Transvaal stattfindet steht auch anderswo, zum Beispiel Industrial Minerals and Rocks, im Römpp oder in dem Spektrum Lexikon Geowissenschaften.--Claude J (Diskussion) 08:40, 5. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Ra'ike Disk. P:MIN 17:50, 7. Jan. 2019 (CET)
Ist sie als Chemikerin relevant? Falls nicht, sollte die Kategorie entfernt werden. --Leyo 20:55, 6. Jan. 2019 (CET)
- Umkategorisiert. Relevanz als Chemikerin müsste der Artikelautor darstellen, Promotion reicht nicht.--Claude J (Diskussion) 10:03, 7. Jan. 2019 (CET)
- Hochschulpräsidentin scheint mir ausreichend relevant zu sein.... --FK1954 (Diskussion) 11:29, 7. Jan. 2019 (CET)
- Die enzykl. Relevanz der Person an sich wird nicht angezweifelt. --Leyo 12:06, 7. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Jü (Diskussion) 13:00, 7. Jan. 2019 (CET)
Die Schreibweise von Kategorie und Hauptartikel ist unterschiedlich. Soll ggf. eines davon verschoben werden? --Leyo 14:42, 9. Jan. 2019 (CET)
- Beides wird verwendet. Etymologisch ist k korrekt (weil von glykys für süß abgeleitet), im engl. Sprachgebrauch hat sich c durchgesetzt. Wie Löffler, Voet, Stryer und Lehninger (die vier Standardwerke, die es auf deutsch gibt) es schreiben, konnte ich noch nicht nachschauen. Da Homogenität der Schreibweise nur innerhalb von Artikeln ein Projektziel ist, nicht über den Artikelbestand, sehe ich keinen dringenden Handlungsbedarf. Aber ich lese es noch mal nach, Grüße, --Ghilt (Diskussion) 15:29, 9. Jan. 2019 (CET)
- Die jeweils andere Schreibweise wird übrigens bei beiden Seiten nicht erwähnt. --Leyo 15:34, 9. Jan. 2019 (CET)
- Es ist nicht einheitlich, selbst nicht immer innerhalb der Standardwerke. Stryer verwendet Glykoprotein und glykosidisch,[1] Löffler Glykoprotein und glycosidisch, Lehninger Glykoprotein und glycosidisch,[2] Horton Glycoprotein und glycosidisch,[3], Voet hab ich nicht auf deutsch und bei google books gibt es für das deutschsprachige Buch keine Vorschau. Grüße, --Ghilt (Diskussion) 16:55, 9. Jan. 2019 (CET)
- Siehe WP:RLC#Fachsprache vs. Standardsprache … Es geht mir aber hier spezifisch um den Unterschied zwischen Kategorie und Hauptartikel. --Leyo 18:00, 9. Jan. 2019 (CET)
- Ja, es gibt nur keine Einheitlichkeit/Einigung in der Fachsprache, was ich mit den Links auf Biochemie-Standardwerke aussagen wollte... --Ghilt (Diskussion) 18:53, 9. Jan. 2019 (CET)
- Ich habe meinen Vorschlag umgesetzt und jeweils auf die alternative Schreibweise hingewiesen. --Leyo 20:49, 13. Jan. 2019 (CET)
- Ja, es gibt nur keine Einheitlichkeit/Einigung in der Fachsprache, was ich mit den Links auf Biochemie-Standardwerke aussagen wollte... --Ghilt (Diskussion) 18:53, 9. Jan. 2019 (CET)
- Siehe WP:RLC#Fachsprache vs. Standardsprache … Es geht mir aber hier spezifisch um den Unterschied zwischen Kategorie und Hauptartikel. --Leyo 18:00, 9. Jan. 2019 (CET)
- Es ist nicht einheitlich, selbst nicht immer innerhalb der Standardwerke. Stryer verwendet Glykoprotein und glykosidisch,[1] Löffler Glykoprotein und glycosidisch, Lehninger Glykoprotein und glycosidisch,[2] Horton Glycoprotein und glycosidisch,[3], Voet hab ich nicht auf deutsch und bei google books gibt es für das deutschsprachige Buch keine Vorschau. Grüße, --Ghilt (Diskussion) 16:55, 9. Jan. 2019 (CET)
- Die jeweils andere Schreibweise wird übrigens bei beiden Seiten nicht erwähnt. --Leyo 15:34, 9. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 20:49, 13. Jan. 2019 (CET)
Ist das nicht ein wenig zu sehr allgemein gehalten? Ist "Dilatation" wirklich derart unspezifisch im Wortgebrauch der Chemie? Wenn ja, dann hätte ich gerne eine Quelle, dass Druckverminderung oder Temperaturerhöhung zur "Dilatation" eines Objekts führt. --Blaues-Monsterle (Diskussion) 17:56, 13. Jan. 2019 (CET)
- Artikel wurde ausgebaut, Quelle (Römpp) wurde hinzugefügt. MfG --Jü (Diskussion) 18:31, 13. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Jü (Diskussion) 18:31, 13. Jan. 2019 (CET)
Die Verbindung ist nicht in der CLP Liste. Die Infobox gibt das aber an.Rjh (Diskussion) 10:40, 15. Jan. 2019 (CET)
- Moin moin die CLP Eintragung ist hier zu finden. https://echa.europa.eu/de/information-on-chemicals/cl-inventory-database/-/discli/details/48875
- Beste Grüße--Dakipabru (Diskussion) 21:07, 15. Jan. 2019 (CET)
- Ja, aber das ist nur eine notified und keine harmonised. Damit darf das so, wie es aktuell in der Box steht nicht verwendet werden, weil das eben nicht in der CLP Liste steht, sondern nur von irgendwelchen Hersteller zusammengesammelte Einträge sind. Und die Echa gibt noch nicht mal an, von welchen Herstellern das stammt. Irgendwie kann man es so eintragen, dass es eben nicht als CLP angezeigt wird. Ich glaube dazu muss der Eintrag bei CLH raus und dafür die Vorlage "CL Inventory" bei "Quelle GHS-Kz" rein. So genau weiß ich das nicht. Zusätzlich frage ich mich, wo die P-Sätze her sind, denn die gibt es bei der Echa nicht.Rjh (Diskussion) 11:35, 15. Jan. 2019 (CET)
- Ich glaube so geht das ... (ich hab es mal geändert). Fragt sich noch, wo die P-Sätze her sind. Rjh (Diskussion) 11:40, 15. Jan. 2019 (CET)
- Ja, aber das ist nur eine notified und keine harmonised. Damit darf das so, wie es aktuell in der Box steht nicht verwendet werden, weil das eben nicht in der CLP Liste steht, sondern nur von irgendwelchen Hersteller zusammengesammelte Einträge sind. Und die Echa gibt noch nicht mal an, von welchen Herstellern das stammt. Irgendwie kann man es so eintragen, dass es eben nicht als CLP angezeigt wird. Ich glaube dazu muss der Eintrag bei CLH raus und dafür die Vorlage "CL Inventory" bei "Quelle GHS-Kz" rein. So genau weiß ich das nicht. Zusätzlich frage ich mich, wo die P-Sätze her sind, denn die gibt es bei der Echa nicht.Rjh (Diskussion) 11:35, 15. Jan. 2019 (CET)
Das sieht doch sehr gut aus. Ich lerne auch noch viel dazu wie das alles richtig ist. Vielen Dank für die Mithilfe!--Dakipabru (Diskussion) 21:07, 15. Jan. 2019 (CET)
- Ich ja auch. :) Mach mal hinter deine Texte hier in der Diskussion noch ein ~~~~. Dann sieht man auch, wer da was schreibt.Rjh (Diskussion) 15:34, 15. Jan. 2019 (CET)
- Naja, die P-Sätze sind noch unbequellt. Und die üblichen Verdächtigen Sigma, Alfa, Merck, TCI geben alle einstimmig "keine" also "nicht gefährlich" an.Rjh (Diskussion) 15:37, 15. Jan. 2019 (CET)
- Ich hab mal die P-Sätze noch mit dem am besten passenden korrigiert.Rjh (Diskussion) 20:35, 15. Jan. 2019 (CET)
- Naja, die P-Sätze sind noch unbequellt. Und die üblichen Verdächtigen Sigma, Alfa, Merck, TCI geben alle einstimmig "keine" also "nicht gefährlich" an.Rjh (Diskussion) 15:37, 15. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Rjh (Diskussion) 20:35, 15. Jan. 2019 (CET)
Hi Zusammen - eigentlich müsste doch Dioxine auf Dioxin weiterleiten - oder? --Calle Cool (Diskussion) 12:02, 10. Jan. 2019 (CET)
- Ich würde es so belassen. --Leyo 13:44, 10. Jan. 2019 (CET)
- +1 zumal in der Begrifferklärung auch auf die systematische Nomenklatur der zugrunde liegenden Substanzen verwiesen wird. --Elrond (Diskussion) 18:07, 10. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 12:15, 22. Jan. 2019 (CET)
Tetr(a)oxid, Pent(a)oxid etc.
Das a am Ende eines multiplikativen Präfixes wird vor Oxid ja gerne weggelassen, zum Beispiel Tetroxid statt Tetraoxid, Pentoxid statt Pentaoxid etc. (Römpp: 52 Ergebnisse für *tetroxid*, 9 Ergebnisse für *tetraoxid*). Im technischen Bericht PAC-REP-14-07-18 der IUPAC steht jedoch: „There is no elision of vowels (e.g., tetraaqua, pentaoxide), except in the special case of monoxide.“ In Nomenklatur der Anorganischen Chemie (herausgegeben im Auftrag der GDCh) heißt es: „Die abschließenden Vokale der multiplikativen Präfixe werden nicht weggelassen, es sei denn, es liegen zwingende sprachliche Gründe vor. Monoxid ist eine derartige Ausnahme.“ Hingegen finden sich als Beispiele in der Tat Distickstofftetraoxid, Trieisen-tetraoxid, Triuran-octaoxid.
Was haltet ihr also davon, Distickstofftetroxid und andere Artikel zu verschieben? Vielleicht habt ihr auch eine Meinung zu Zincat vs. Zinkat. -- IvanP (Diskussion) 18:46, 19. Jan. 2019 (CET)
Das Lemma Dithiatetraazaadamantantetroxid finde ich amüsant (zweimal die Vokalfolge /aa/; auch ein nettes Wort: Salpingo-Oophoritis). Gängiger ist sowieso Tetramethylendisulfotetramin. Müsste es gar …tetraamin heißen? -- IvanP (Diskussion) 19:31, 19. Jan. 2019 (CET)
Wie auch immer, aber Lemmata wie Phosphorpentoxid und Distickstofftetroxid sollten zumindest als Weiterleitung bestehen bleiben, denn mir sind kaum Chemiker bekannt, die (im Jargon) Phosphorpentaoxid etc. sagen und Lieferanten dieser Chemikalien sehen das genauso. --Elrond (Diskussion) 13:31, 20. Jan. 2019 (CET)
- Eine ähnliche Diskussion hatten wir hier schon einmal. Die Regel bei WP ist aber auch, dass der gebräuchlichere Begriff als Lemma gewählt werden sollte. Das haben wir in der Redaktion in der Vergangenheit so gelöst, dass entweder der umgangssprachliche Begriff Hauptlemma war mit Weiterleitung vom - nach aktueller IUPAC Nomenklatur - korrekten Begriff und Nennung des IUPAC Namen in der Infobox, oder Verschiebung auf den richtigen Namen mit bestehender Weiterleitung. Gruß --Bert (Diskussion) 17:45, 20. Jan. 2019 (CET)
- Weiterleitungen sind sowieso selbstverständlich. Ansonsten richten wir uns üblicherweise nach der Schreibweise in der (deutschsprachigen) Chemie-Literatur. Da verwenden Römpp und Gestis "Phosphorpentoxid", im HoWi (102. Auflage) wird Phosphorpentaoxid verwendet. Es gibt also beides in der Literatur, beides ist richtig, daher sehe ich keinen Bedarf, an unseren Schreibweisen was zu ändern. --Orci Disk 11:22, 22. Jan. 2019 (CET)
- Eine ähnliche Diskussion hatten wir hier schon einmal. Die Regel bei WP ist aber auch, dass der gebräuchlichere Begriff als Lemma gewählt werden sollte. Das haben wir in der Redaktion in der Vergangenheit so gelöst, dass entweder der umgangssprachliche Begriff Hauptlemma war mit Weiterleitung vom - nach aktueller IUPAC Nomenklatur - korrekten Begriff und Nennung des IUPAC Namen in der Infobox, oder Verschiebung auf den richtigen Namen mit bestehender Weiterleitung. Gruß --Bert (Diskussion) 17:45, 20. Jan. 2019 (CET)
- Stimme Orci zu 100 % zu. MfG --Jü (Diskussion) 12:11, 22. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Jü (Diskussion) 12:11, 22. Jan. 2019 (CET)
Hi Zusammen, meint Ihr es würde sich ein eigener Artikel über Alkylphenol Ethoxylate Lohnen, oder würde ein Weiterleitung auf Alkylphenole ausreichen? Ich weiß das Alkylphenol Ethoxylate teilweise in der Textilindustrie eingesetzt werden und dise sch ja dann zu Alkylphenole spalten können, welchen dann wie Hormone auf den Mensch wirken können... Gruß --Calle Cool (Diskussion) 14:20, 15. Jan. 2019 (CET)
- siehe oben! (Octylphenolethoxylate, Nonylphenolethoxylate), ansonsten: Woran willst du messen, ob es sich lohnt? Schreib´, und sieh dir dann die Abrufstatistik an. Grüße--Dodecaeder (Diskussion) 15:25, 15. Jan. 2019 (CET)
- Also eine solche Weiterleitung wäre falsch, da es sich um Ether handelt und nicht um Phenole, es müsste schon ein eigener Artikel sein. Das korrekte Lemma wäre Alkylphenolethoxylate (mit Leerzeichen dazwischen ist es englisch). Oder man belässt es bei Artikeln zu genaueren Gruppen wie Nonylphenolethoxylate, das müsste jemand beurteilen, der sich genauer damit auskennt. --Orci Disk 15:54, 15. Jan. 2019 (CET)
- Meiner Meinung nach wäre ein Artikel Octylphenolethoxylate wichtiger (siehe oben). Aber auch Alkylphenolethoxylate (Abkürzung: APEO) sind bestimmt relevant genug für einen Artikel (siehe beispielsweise PMC 3552055 (freier Volltext), doi:10.1016/j.scitotenv.2018.04.079, REWE, Lidl, Eurofins). --Leyo 23:12, 15. Jan. 2019 (CET)
@Calle Cool: Kommt von dir noch etwas oder kann dieser Abschnitt archiviert werden? --Leyo 12:14, 22. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Danke für die Einschätzung. Ich schau mal ob ich evtl. ein Artikel zusammengeschustert bekomme.Calle Cool (Diskussion) 10:54, 23. Jan. 2019 (CET)
Die Strukturformel enthält Natrium, die Summenformel nicht. Welches sollte angepasst werden? Die CAS-Nr. ist übrigens auch eine andere als im engl. Artikel. Allenfalls passt 100.121.931 dann und kann eingefügt werden. --Leyo 11:25, 9. Jan. 2019 (CET)
- Die Strukturformel zeigt das Natriumsalz. Die Echa Seite ist auch für das Natriumsalz, deshalb ist da auch die CAS Nummer anders. Rjh (Diskussion) 12:38, 9. Jan. 2019 (CET)
- Ja, aber wollen wir die Inkonsistenz zwischen Struktur- und Summenformel (und molarer Masse) so belassen? --Leyo 23:08, 9. Jan. 2019 (CET)
- Ich hab unter das Bild "Natriumsalz" geschrieben. Damit müsste das klar sein. Für mich wäre das ok. Ansonsten müsste jemand das riesige Bild neu zeichnen.Rjh (Diskussion) 08:20, 10. Jan. 2019 (CET)
- Strukturformel als freie Säure ist nun eingebunden. --NadirSH (Diskussion) 23:45, 24. Jan. 2019 (CET)
- Ich hab unter das Bild "Natriumsalz" geschrieben. Damit müsste das klar sein. Für mich wäre das ok. Ansonsten müsste jemand das riesige Bild neu zeichnen.Rjh (Diskussion) 08:20, 10. Jan. 2019 (CET)
- Ja, aber wollen wir die Inkonsistenz zwischen Struktur- und Summenformel (und molarer Masse) so belassen? --Leyo 23:08, 9. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: NadirSH (Diskussion) 23:45, 24. Jan. 2019 (CET)
Leerzeichen und Bindestriche in Nomenklatur
In der Nomenklatur (Chemie) steht nicht explizit, dass es in Chemikaliennamen per Definition keine Leerzeichen gibt. Gibt es irgendwelche exotischen Ausnahmen oder darf ich das im Abschnitt Klammerungen einfach so ergänzen? Frage zwei ist: Ich habe nirgends in der Nomenklatur gefunden, wann und wo man Bindestriche setzen soll. Bei der Oxidationszahl nach der Klammer z.B. Eisen(III)-oxid. Bei But-1-en vor und nach der Zahl. Ist zwar logisch, aber steht nirgends. Für mich ein wenig chaotisch wird es bei β-D-Galactopyranosyl-(1→4)-α-D-glucopyranose und 2,4-Dimethyl-heptan. Beim ersteren der Bundestrich vor der Klammer und bei letzterem vor dem heptan??? Was sind da die genauen Regeln und wo steht das? Rjh (Diskussion) 21:11, 27. Jan. 2019 (CET)
- Titel Nomenklatur der Anorganischen Chemie
Herausgeber Wolfgang Liebscher, GDCh Verlag John Wiley & Sons, 2009 ISBN 3527625453, 9783527625451 Länge 373 Seiten (gibt´s bei google books) vielleicht hilft das weiter. Grüße --Dodecaeder (Diskussion) 22:03, 27. Jan. 2019 (CET)
- Gute Idee, aber der Text verwirrt mich teilweise nur weiter. :) Beispiel: "An vielen Stellen, wo im Englischen Leerräume zwischen den Wortem eines Begriffs verwendet werden, stehen im Deutschen Bindestriche." "An vielen" ??? Was soll das denn heißen? Und in der organischen Version wird es noch schlimmer: "Die Verwendung von Bindestrichen ist zuweilen etwas problematisch und willkürlich; wenn es der Klarheit dient, sollte man hier etwas großzügig sein." Naja, ich werde mal versuchen das einzuarbeiten. Rjh (Diskussion) 22:29, 27. Jan. 2019 (CET)
- @Rjh: Unser Nomenklaturartikel ist leider recht chaotisch und wirklich sehr verbesserungswürdig. Ich hatte mit der Auslagerung der Nomenklatur (Anorganische Chemie) schon mal angefangen, aber dabei ist es leider dann auch geblieben. In der Nomenclature of Organic Chemistry - IUPAC Recommendations and Preferred Names 2013 ist die Verwendung von Leerzeichen und Bindestrichen klar geregelt (Beispiele habe ich eingedeutscht):
- Regel P-16.2.4: Hyphens
- P-16.2.4.1: Hyphens are used in substitutive names (a) to separate locants from words or word fragments: (Beispiel: 2-Chloro-2-methylpropan) (b) after parentheses, if the closing parenthesis is followed by a locant (Beispiel: 1-(Chlormethyl)-4-nitrobenzol) (c) to separate adjacent locants from a subsequent opening enclosing mark (Beispiel: 1-(3,4-Dihydrochinolin-1(2H)-yl)ethan-1-on)) (d) to separate italic letters from Roman letters (Beispiel: Di-ter-butyl).
- P16.2.4.2 - P-16.2.4.5 ....
- Regel P-16.2.6: Spaces are a very important type of punctuation for many kinds of names in the English language. If a space is required in a name it must be used. On the other hand the use of spaces where they are not required, for example, in substitutive names that must be written continuously from one end to the other using hyphens to connect the different parts, may be misleading.
- Leerzeichen also nur, wenn es die Sprachregeln erfordern, ansonsten immer Bindestriche. Bei den Beispielen oben halte ich das Zweite für falsch, müsste 2,4-Dimethylheptan heißen, beim ersteren würde ich mal vermuten, dass der Bindestrich vor der Klammer auch zuviel ist. Da müsste ich mich aber erst noch deutlich weiter einlesen. Falls du noch weitere Informationen brauchst gerne per Email. Gruß --Bert (Diskussion) 23:15, 27. Jan. 2019 (CET)
- Das mit den "Sprachregeln es erfordern" finde ich kritisch, weil mir gerade jemand einen Artikel verschieben wollte, der meinte im Deutschen würde vor Klammern immer ein Leerzeichen stehen. Es kann durchaus sein, dass die deutschen Sprachregeln normalerweise ein Leerzeichen vor einer Klammer vorsehen, aber innerhalb von Chemikaliennamen eben nicht. Da würden wir uns von der deutschen Sprachregel lösen. Oder man verweist halt auf Deppenleerzeichen. :) Rjh (Diskussion) 11:47, 28. Jan. 2019 (CET)
- Das mit den "Sprachregeln es erfordern" ist auch nur meine "Übersetzung" gewesen. In allen Veröffentlichungen zur IUPAC Nomenklatur (Deutsch oder Englisch) findet man unzählige Beispiele chemischer Namen die zeigen, dass vor und nach Klammern keine Leerzeichen kommen, höchstens Bindestriche (s. oben). Das kannst Du also im Nomenklaturartikel ruhig entsprechend nachtragen. Gruß --Bert (Diskussion) 18:18, 28. Jan. 2019 (CET)
- Passt das jetzt in beiden Nomenklaturartikeln ? Rjh (Diskussion) 20:35, 28. Jan. 2019 (CET)
- Das mit den "Sprachregeln es erfordern" ist auch nur meine "Übersetzung" gewesen. In allen Veröffentlichungen zur IUPAC Nomenklatur (Deutsch oder Englisch) findet man unzählige Beispiele chemischer Namen die zeigen, dass vor und nach Klammern keine Leerzeichen kommen, höchstens Bindestriche (s. oben). Das kannst Du also im Nomenklaturartikel ruhig entsprechend nachtragen. Gruß --Bert (Diskussion) 18:18, 28. Jan. 2019 (CET)
- Das mit den "Sprachregeln es erfordern" finde ich kritisch, weil mir gerade jemand einen Artikel verschieben wollte, der meinte im Deutschen würde vor Klammern immer ein Leerzeichen stehen. Es kann durchaus sein, dass die deutschen Sprachregeln normalerweise ein Leerzeichen vor einer Klammer vorsehen, aber innerhalb von Chemikaliennamen eben nicht. Da würden wir uns von der deutschen Sprachregel lösen. Oder man verweist halt auf Deppenleerzeichen. :) Rjh (Diskussion) 11:47, 28. Jan. 2019 (CET)
- Leerzeichen also nur, wenn es die Sprachregeln erfordern, ansonsten immer Bindestriche. Bei den Beispielen oben halte ich das Zweite für falsch, müsste 2,4-Dimethylheptan heißen, beim ersteren würde ich mal vermuten, dass der Bindestrich vor der Klammer auch zuviel ist. Da müsste ich mich aber erst noch deutlich weiter einlesen. Falls du noch weitere Informationen brauchst gerne per Email. Gruß --Bert (Diskussion) 23:15, 27. Jan. 2019 (CET)
- Also ich kenne im Deutschen keinen einzigen Namen, der ein Leerzeichen erfordert. Bindestriche werden aber nach meinem Eindruck häufig al gusto mit der Gießkanne verteilt. Ich bin sicher, dass sich auch in den Boxen unter "Andere Namen" vieles finden würde, was nicht korrekt ist.--Mabschaaf 19:59, 28. Jan. 2019 (CET)
- In der Anorganik waren drei Beispiele angegeben mit Leerzeichen. Aber das war für mich schon nicht mehr innerhalb des Namens. Ich hab es mit eingefügt.Rjh (Diskussion) 20:36, 28. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Rjh (Diskussion) 07:57, 30. Jan. 2019 (CET)
1,4-Bis(2-ethylhexylphthalat)
Hi zusammen, ich bin gerade etwas verwirrt. Ist 1,4-Bis(2-ethylhexylphthalat) nun Diisooctylphthalat (CAS:27554-26-3) oder Bis(2-ethylhexyl)terephthalat (CAS: 6422-86-2) --Calle Cool (Diskussion) 16:12, 30. Jan. 2019 (CET)
- was mich erstaunt ist die Kombination 1,4- und Phthalat (und nicht Terephthalat) siehe Benzoldicarbonsäuren. Daher wäre nach meinem Dafürhalten Bis(2-ethylhexyl)terephthalat eher richtig, wenn man die 1,4- maßgeblich nimmt. Aber bei iso wäre ich auch nicht verwundert, wenn es da noch andere Varianten gäbe, iso ist nicht ohne Grund nur noch als Trivialname zulässig. --Elrond (Diskussion) 16:27, 30. Jan. 2019 (CET)
- +1: terephthal ist immer die Para-Postion, ebenso ist 1,4 immer para, das iso bezieht sich auf den octylrest, also 1,4-Bis(2-ethylhexylphtalat) ist äquivalent zu 1,4-Bis-(diisooctyl)phthalat oder zu Diisooctylterephthalat und zu Bis(2-ethylhexyl)terephthalat --Dodecaeder (Diskussion) 16:46, 30. Jan. 2019 (CET)
- -isooctyl- beeinhaltet -2-ethylhexyl-, letzteres ist aber genau definiert (abgesehen von der Stereochemie), wohingegen das -iso- typischerweise eine Mischung verschiedener Regioisomere (und Stereoisomere) beschreibt. Diese beiden Bezeichnungen sind also nicht äquivalent.--Mabschaaf 18:20, 30. Jan. 2019 (CET)
- +1: terephthal ist immer die Para-Postion, ebenso ist 1,4 immer para, das iso bezieht sich auf den octylrest, also 1,4-Bis(2-ethylhexylphtalat) ist äquivalent zu 1,4-Bis-(diisooctyl)phthalat oder zu Diisooctylterephthalat und zu Bis(2-ethylhexyl)terephthalat --Dodecaeder (Diskussion) 16:46, 30. Jan. 2019 (CET)
Noch kurz zum Hintergrund dieser Frage. Ich hab gerade ein Bericht vorliegen in dem steht das Diisooctylphthalat = 1,4-Bis(2-ethylhexylphthalat) = CAS NO = 6422-86-2 sei. Da aber lt. Wikipedia Diisooctylphthalat = CAS:27554-26-3 ist scheint irgendwo ein Fehler zu sein. Was mir noch als Lösung einfällt ist, das Diisooctylphthalat ein Ausdruck ist der auf beide CAS-NO passt, da die Summenformel gleich ist. Dann müsste der Artikel Diisooctylphthalat nacht nach 1,2-Benzoldicarbonsäurediisooctylester bzw. 1,2Bis(2-ethylhexyl)terephthalat verschoben werden... oder? (Ich bin aber kein Chemiker - Ist mir nur aufgefallen das da was nicht stimmen kann) --Calle Cool (Diskussion) 09:55, 31. Jan. 2019 (CET)
- Wenn ich das richtig sehe, dann wäre der Unterschied ja "nur" die Position... --Calle Cool (Diskussion) 10:02, 31. Jan. 2019 (CET)
- Ich würde sagen, da ist dieser Bericht einfach falsch. Phthalsäure und Derivate sind immer 1,2-Benzoldicarbonsäuren. Wenn eine 1,4-Benzoldicarbonsäure (oder Derivate davon) gemeint sind, muss das Terephthalsäure genannt werden. Man kann natürlich auch auf die Benzoldicarbonsäuren-Bezeichnungen zurückgehen, ändert aber nichts daran, dass auch die Phthalsäure/Terephthalsäuren-Bezeichnungen eindeutig sind. 1,4-Bis(2-ethylhexylphthalat) ergibt übrigens schon von der Klammerung her keinen Sinn, da das ganze in der Klammer verdoppelt werden müsste und nirgendwo steht, woran nun das gedoppelte Strukturelement nun hängen soll. --Orci Disk 10:23, 31. Jan. 2019 (CET)
- ganz einfach: Man kann nach CAS-Nummern suchen: CAS 6422-86-2 ergibt Bis(2-ethylhexyl)terephthalat und CAS 27554-26-3 ergibt dessen Isomer Bis(2-ethylhexyl)phthalat. Das wäre das 1,2-substituierte Isomer, bzw. ortho.
- Also: 6422-86-2 ist der Ester der Terephthalsäure, 27554-26-3 der Ester der Phthalsäure. Da scheint Dein Bericht ungenau/falsch zu sein. --Elrond (Diskussion) 11:44, 31. Jan. 2019 (CET)
- Da ich gerade sowieso den SciFinder offen hatte, habe ich schnell mal geschaut. --Elrond (Diskussion) 11:46, 31. Jan. 2019 (CET)
- ganz einfach: Man kann nach CAS-Nummern suchen: CAS 6422-86-2 ergibt Bis(2-ethylhexyl)terephthalat und CAS 27554-26-3 ergibt dessen Isomer Bis(2-ethylhexyl)phthalat. Das wäre das 1,2-substituierte Isomer, bzw. ortho.
- Ich würde sagen, da ist dieser Bericht einfach falsch. Phthalsäure und Derivate sind immer 1,2-Benzoldicarbonsäuren. Wenn eine 1,4-Benzoldicarbonsäure (oder Derivate davon) gemeint sind, muss das Terephthalsäure genannt werden. Man kann natürlich auch auf die Benzoldicarbonsäuren-Bezeichnungen zurückgehen, ändert aber nichts daran, dass auch die Phthalsäure/Terephthalsäuren-Bezeichnungen eindeutig sind. 1,4-Bis(2-ethylhexylphthalat) ergibt übrigens schon von der Klammerung her keinen Sinn, da das ganze in der Klammer verdoppelt werden müsste und nirgendwo steht, woran nun das gedoppelte Strukturelement nun hängen soll. --Orci Disk 10:23, 31. Jan. 2019 (CET)
- Wenn ich das richtig sehe, dann wäre der Unterschied ja "nur" die Position... --Calle Cool (Diskussion) 10:02, 31. Jan. 2019 (CET)
Gleiche Summenformel, verschiedene Isomere, daher unterschiedliche CAS-Nummern.--Dodecaeder (Diskussion) 11:24, 31. Jan. 2019 (CET)
- Vielen Dank für euren Imput. Dann macht in dem Fall keine Weiterleitung sinn. Beim Bericht frag ich dann lieber nochmal nach bzw. warte noch auf einen zweiten aus einem anderen Labor. --Calle Cool (Diskussion) 19:38, 31. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Calle Cool (Diskussion) 10:48, 4. Feb. 2019 (CET)
WikiDACH vom 23.-24. März in Nürnberg

Liebe Mitarbeiter der Redaktion Chemie,
vom 23. bis 24. März findet das Barcamp für freies Wissen WikiDACH und der 17. Fotoworkshop in Nürnberg statt. Es ist eine Möglichkeit, sich zu treffen, sich auszutauschen, alte Ideen zu besprechen und neue Projekte auf den Weg zu bringen. Wie diese Veranstaltung aussieht, liegt ganz bei euch: Wir treffen uns Samstag und Sonntag in der Früh und planen gemeinsam den Tagesablauf. Alle sind eingeladen selbst einen Vortrag, eine Gesprächsrunde oder einen Workshop vorzuschlagen und anzubieten. Ob Neuling oder Urgestein - alle sind herzlich willkommen.
--Alice 04:43, 18. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 12:18, 8. Feb. 2019 (CET)
Die chemische Kategorisierung scheint unvollständig zu sein. Hat die Verbindung tatsächlich keine CAS-Nummer? Der Bildlink ist defekt. --Leyo 15:57, 21. Jan. 2019 (CET)
- Habe die Kats ergänzt; übrigens ist LSD kein Mutterkornalkaloid, auch seine Derivate nicht! Man würde es vergeblich im Mutterkorn suchen! Ebensowenig ist Heroin ein Opiumalkaloid. Ich sehe das Bild übrigens. --FK1954 (Diskussion) 15:56, 3. Feb. 2019 (CET)
- Die Strukturformel in der Chemobox wurde inzwischen ausgetauscht. Allerdings sollte dort eine Schwarzweiss-Bild rein. --Leyo 22:37, 3. Feb. 2019 (CET)
- Das Bild ist jetzt Schwarzweiss. Damit erledigt ? Rjh (Diskussion) 20:17, 19. Feb. 2019 (CET)
- Die Strukturformel in der Chemobox wurde inzwischen ausgetauscht. Allerdings sollte dort eine Schwarzweiss-Bild rein. --Leyo 22:37, 3. Feb. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 22:05, 19. Feb. 2019 (CET)
Nummerierung von Decahydronaphthalin


Hallo zusammen,
ich habe eine Frage zur Nummerierung von Decahydronaphthalin; und zwar wird das obere Bild rechts in diversen fremdsprachigen Artikeln zur Erläuterung der Von-Baeyer-Nomenklatur verwendet. Allerdings entspricht die Nummerierung gar nicht der Baeyer-Nomenklatur (am Brückenkopf müsste statt 9 eine 1 stehen, weiterhin statt der 1 eine 2 usw.).
Des Weiteren ist mir eine andere Nummerierungsweise mit Zahlen von 1 bis 8a bekannt, siehe unteres Bild.
Nun wollte ich etwas Ordnung hineinbringen, daher meine Fragen:
- Welche Art der Nummerierung zeigt das obere Bild? In der Historie sieht man, dass man sich schon seit längerer Zeit hinsichtlich der Nummerierung nicht einig ist.
- Welche Nummerierung (Baeyer oder 1-8a) ist die "richtige" für Decahydronaphthalin? Bzw. wann wird welche verwendet? (Chemdraw verwendet für Decahydronaphthalin / bicyclo[4.4.0]decan die Zählung 1-8a, für bicyclo[4.4.1]undecan hingegen die Baeyer-Zählweise)
- Hat Aromatizität auf die Nummerierung einen Einfluss? [ich dachte nein]
- Wo ist die zweite Nummerierungsvariante (1-8a) festgelegt / veröffentlicht? Hat sie einen Namen?
Liebe Grüße und danke im Voraus --Hbf878 (Diskussion) 16:19, 13. Jan. 2019 (CET)
Richtlininen zur Von-Baeyer-Nomenklatur:
Karl-Heinz Hellwich: Erweiterung und Revision des von-Baeyer-Systems zur Benennung polycyclischer Verbindungen (einschließlich bicyclischer Verbindungen). In: Angew. Chem. 2002, 114, 3423–3432, doi:10.1002/1521-3757(20020902)114:17<3423::AID-ANGE3423>3.0.CO;2-6. (offizielle deutsche Übersetzung der IUPAC-Veröffentlichung)
- Die Abbildungen zeigen zwei ganz unterschiedliche Strukturen, das untere zeigt Naphthalin, das, da aromatisch, planar ist und die obere Dekalin, das in Sesselkonformation vorliegt und als cis- und trans-Decalin vorhanden ist, auch als Bicyclo[4.4.0]decan bezeichnet wird. Grüße --Dodecaeder (Diskussion) 17:28, 13. Jan. 2019 (CET)
- Ja, das ist mir klar. Meine Frage war, ob Decahydronaphthalin wie Naphthalin nummeriert wird oder anders; und falls anders, warum. --Hbf878 (Diskussion) 18:59, 13. Jan. 2019 (CET)
- Auf jeden Fall beginnt man immer am Brückenkopf mit der Nummerierung.
- Ich füg mal einen link ein: [[4]] Grüße --Dodecaeder (Diskussion) 20:00, 13. Jan. 2019 (CET)
- Beide Beispiele widersprechen den IUPAC-Empfehlungen, da die Nummerierung gemäss diesen im Uhrzeigersinn erfolgt.
- Vielleicht helfen Rule A-22. Numbering bzw. Rule A-23. Hydrogenated Compounds. --Leyo 20:06, 13. Jan. 2019 (CET)
- Ja, das ist mir klar. Meine Frage war, ob Decahydronaphthalin wie Naphthalin nummeriert wird oder anders; und falls anders, warum. --Hbf878 (Diskussion) 18:59, 13. Jan. 2019 (CET)


- Vielen Dank für die Links. Für mich stellt sich die Situation folgendermaßen dar:
- Es gibt für polycylische Moleküle 2 Arten der Nummerierung.
- Handelt es sich um Moleküle, in denen mindestens 2 Ringe miteinander ortho-fused oder peri-fused (mir fällt gerade keine Übersetzung ein) sind, werden entsprechend Rule A-22. Numbering nummeriert (wie das Bild mit den blauen Zahlen, aber im Uhrzeigersinn); Position 1 befindet sich (grob abgekürzt) "oben rechts", aber nicht am Brückenkopf. Brücken werden benannt wie selbstständige Moleküle, die an 2 Stellen am "fusionierten" Grundgerüst angebracht sind.
- Handelt es sich um polyzyklische Moleküle ohne "fusionierte" Ringe, wird die von-Baeyer-Nomenklatur angewendet. Der höchstpriorisierte Brückenkopf erhält Nummer 1, dann wird erst der Hauptring nummeriert und anschließend die Brücken.
- Kommt im Molekül beides vor (also fused Ringe und Brücken mit mehr als 0 Atomen), wird der "fusionierte" Teil nach der ersten Regel nummeriert (Auslassung der Brückenköpfe), beim verbrückten Teil werden aber die Brückeköpfe mitgezählt (siehe Beispiel 3 rechts).
- Decahydronaphthalin könnte demnach auf 2 Arten nummeriert werden (Chemdraw akzeptiert beide Arten als Eingabe), aber die "fusionierte" Nummerierung sticht die Baeyer-Nummerierung aus (siehe großes Bild rechts).
- Aromatizität spielt keine Rolle für die Wahl der Nummerierungsmethode, allerdings erhalten gesättigte Kohlenstoffe in der fused-Nummerierung eine möglichst niedrige Nummer.
- Das obere Bild entspricht keiner IUPAC-Nummerierungsmethode.
- Danke für die schnelle Hilfe, ich werde in nächster Zeit die SVG-Version der oberen Grafik abändern entsprechend Regel A-22. --Hbf878 (Diskussion) 23:04, 13. Jan. 2019 (CET)
- @Leyo: Uhrzeigersinn oder nicht Uhrzeigersinn ist in dem Naphthalin-Beispiel egal, da durch 180°-Drehung ineinander überführbar. --Blaues-Monsterle (Diskussion) 13:12, 14. Jan. 2019 (CET)
- Sooo blöd bin ich nicht, dass mir dies nicht klar wäre. Dennoch gibt es Konventionen. --Leyo 14:09, 14. Jan. 2019 (CET)
- Die Frage, ob eine Nummerierung IUPAC-konform ist oder nicht, kann nicht davon abhängen, wie herum ich das Papier halte beziehungsweise von welcher Seite ich auf das Molekül schaue. Daher ist die Orientierung der Zeichnung vielleicht gewöhnungsbedürftig und nicht generalisierbar, die Nummerierung aber nicht falsch. --Blaues-Monsterle (Diskussion) 14:38, 14. Jan. 2019 (CET)
- Sooo blöd bin ich nicht, dass mir dies nicht klar wäre. Dennoch gibt es Konventionen. --Leyo 14:09, 14. Jan. 2019 (CET)
- @Leyo: Uhrzeigersinn oder nicht Uhrzeigersinn ist in dem Naphthalin-Beispiel egal, da durch 180°-Drehung ineinander überführbar. --Blaues-Monsterle (Diskussion) 13:12, 14. Jan. 2019 (CET)

Hallo Hbf878, die Frage war ja, wie die Nummerierung bei Decahydronaphthalin anzugeben ist. Entsprechend der 2013 veröffentlichten IUPAC-Nomenklatur gelten für die Darstellung anellierter Ringe (fused-rings), die Regel P-25 Fused and Briged Fused Systems:
- Für die Ausrichtung des Moleküls bei der Darstellung gilt Regel P-25.3.2.3: (a) maximale Anzahl an anellierten (ortho-fused) Ringen in einer horizontalen Reihe und (b) maximale Anzahl an Ringen in der oberen rechten Ecke.
- Für die Nummerierung gilt Regel P-25.3.3.1: Die Nummerierung der äußeren Ringe beginnt am obersten Ring. Wenn es mehrere oberste Ringe gibt, wird der Ring äußerst rechts gewählt. Die Nummerierung startet dann an dem nicht verbrückenden (non-fused) Atom dieses Ringes, welches am meisten gegen den Uhrzeiger steht. Die Nummerierung erfolgt dann im Uhrzeigersinn. Jedes verbrückende Skelettatom (fusion atom), erhält die gleiche Nummer, wie das vorherige nichtverbrückende (nonfusion) Skelettatom, gefolgt von einem Kleinbuchstaben.
Die korrekte Darstellung - in diesem Fall für Naphthalin - gem. dieser Regeln findet man rechts, Decahydronaphthalin ist entsprechend. Das entspricht im Wesentlichen Rule A-22. Numbering in der Nomenklatur aus 1979. Die Von-Baeyer-Nomenklatur gilt für Decahydronaphthalin nicht, da sie für verbrückte Moleküle verwendet wird. Gruß --Bert (Diskussion) 14:24, 20. Jan. 2019 (CET)

- Hallo Bert, danke für die Antwort. Ich habe etwas in Chemdraw rumgespielt und bemerkt, dass Chemdraw für einige anellierte Systeme trotzdem die von-Baeyer-Nomenklatur und -Nummerierung verwendet, und zwar wenn einer der anellierten Ringe ein 4- oder 3-Ring ist (siehe rechts). Wenn ein weiterer >4-Ring anneliert ist, wird allerdings wieder P-25 verwendet. Weißt du, warum das so ist?
- Andere Frage: Kann man irgendwo die neuesten IUPAC-Regeln kostenlos einsehen? Grüße, Hbf878 (Diskussion) 15:15, 20. Jan. 2019 (CET)
- So wie ich das sehe, ist in der aktuellen IUPAC Nomenklatur die o.g. Regel auch für annellierte Drei- und Vierringe (und nicht die Bayer-Nomenklatur) anzuwenden. Ich könnte mir aber vorstellen, dass früher auch die Bayer-Nomenklatur zulässig/empfohlen war. Eine kostenlose Version der IUPAC Regeln gibt's wohl nicht. Ich habe das Buch Nomenclature of Organic Chemistry - IUPAC Recommendations and Preferred Names 2013 mit > 1500 Seiten nach tagelanger Suche nach den Regeln im Netz irgendwann gekauft. Die Abschnitte, die Leyo von den 20004er Regeln oben verlinkt [5][6] hat, sind wahrscheinlich die aktuellsten im Netz. Die anderen o.g. Regeln, wie Rule A-22. Numbering Rule A-23. Hydrogenated Compounds stammen von 1979. Gruß --Bert (Diskussion) 16:10, 20. Jan. 2019 (CET)
- Auf S. 90 im Entwurf von 2004 steht:
- In the 1998 Recommendations (ref 4), the requirement that for application of fusion nomenclature at least two rings of five or members [sic!] must be present, contained in the 1979 Recommendations (ref 1), was removed. For selection of Preferred IUPAC Names, this requirement is reinstated here. However, in general nomenclature, the fusion system can be applied equally to smaller rings, as in cyclobutabenzene.
- Damit wäre die Benennung des Moleküls unten rechts im Gegensatz zu dem darüber im rechten Bild erklärt. Habe die Bildunterschrift entsprechend angepasst. Sollte diese "Erkenntnis" auch in Nomenklatur (Chemie) eingefügt werden, oder ist das egal, weil sich die Richtline nur auf den preferred IUPAC-Namen bezieht? --Hbf878 (Diskussion) 19:25, 20. Jan. 2019 (CET)
- Dekalin (Cyclo[4.4.0]decan) ist tatsächlich ein Spezialfall, je nachdem, ob man es den verbrückten Kohlenwasserstoffen oder den annellierten Systemen (Aromaten) zuordnet. Begründung: die beiden überbrückten C-Atome befinden sich beim Dekalin nebeneinander. Die WP(fr) ist da liberaler und lässt beide Zählweisen nebeneinander gelten. --Dodecaeder (Diskussion) 08:18, 21. Jan. 2019 (CET)
- Ich fände es nicht schlecht wenn wenigstens Nummerierung in einfachen Fällen von Ringsystemen hier im Wikipedia Artikel Nomenklatur (Chemie) oder Ablegern davon dargestellt werden könnte, auch wenn das in vollem Umfang wohl zu komplex ist (im Uhrzeigersinn hört ja wie man im Artikel nachlesen kann bei Sterane schon auf).--Claude J (Diskussion) 09:24, 25. Jan. 2019 (CET)
- Wenn Du bestimmte Abbildungen im Sinn hast, helfe ich dabei gerne, für einen genererellen Überblick kenne ich mich aber zu schlecht aus. Ansonsten könnte dieser Abschnitt von mir aus archiviert werden. --Hbf878 (Diskussion) 15:17, 12. Feb. 2019 (CET)
- Ich fände es nicht schlecht wenn wenigstens Nummerierung in einfachen Fällen von Ringsystemen hier im Wikipedia Artikel Nomenklatur (Chemie) oder Ablegern davon dargestellt werden könnte, auch wenn das in vollem Umfang wohl zu komplex ist (im Uhrzeigersinn hört ja wie man im Artikel nachlesen kann bei Sterane schon auf).--Claude J (Diskussion) 09:24, 25. Jan. 2019 (CET)
- Dekalin (Cyclo[4.4.0]decan) ist tatsächlich ein Spezialfall, je nachdem, ob man es den verbrückten Kohlenwasserstoffen oder den annellierten Systemen (Aromaten) zuordnet. Begründung: die beiden überbrückten C-Atome befinden sich beim Dekalin nebeneinander. Die WP(fr) ist da liberaler und lässt beide Zählweisen nebeneinander gelten. --Dodecaeder (Diskussion) 08:18, 21. Jan. 2019 (CET)
- Auf S. 90 im Entwurf von 2004 steht:
- So wie ich das sehe, ist in der aktuellen IUPAC Nomenklatur die o.g. Regel auch für annellierte Drei- und Vierringe (und nicht die Bayer-Nomenklatur) anzuwenden. Ich könnte mir aber vorstellen, dass früher auch die Bayer-Nomenklatur zulässig/empfohlen war. Eine kostenlose Version der IUPAC Regeln gibt's wohl nicht. Ich habe das Buch Nomenclature of Organic Chemistry - IUPAC Recommendations and Preferred Names 2013 mit > 1500 Seiten nach tagelanger Suche nach den Regeln im Netz irgendwann gekauft. Die Abschnitte, die Leyo von den 20004er Regeln oben verlinkt [5][6] hat, sind wahrscheinlich die aktuellsten im Netz. Die anderen o.g. Regeln, wie Rule A-22. Numbering Rule A-23. Hydrogenated Compounds stammen von 1979. Gruß --Bert (Diskussion) 16:10, 20. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Hbf878 (Diskussion) 15:20, 2. Mär. 2019 (CET)
Artikel zu Pd(PPh3)4 schreiben/übersetzen?
Hallo allerseits!
Nachdem ich in einem Buch mehrmals über die oben erwähnte Substanz gestolpert bin, habe ich festgestellt, dass es dazu in der deutschen Wikipedia keinen Artikel gibt, in der Englischen aber schon Tetrakis(triphenylphosphine)palladium(0). Ich hätte eigentlich Lust ihn zu übersetzen und bin mit dem Procedere des Übersetzungstools und den Chemieinfokästen einigermaßen vertraut, würde aber gerne fragen, ob
1) Die Substanz relevant genug ist und ob der Artikel doch schon in der deutschen Wikipedia existiert oder als Unterthema ausreichend beleuchtet ist,
2) Wie der Artikel zu nennen wäre: Tetrakistriphenylphosphan-palladium? Wobei ich mir nicht sicher bin, was die 0 hinten bedeutet...
3) Jemand bereit wäre, den Artikel später, wenn es denn soweit ist, auf meiner Benutzerunterseite durchzulesen, bevor er in den ANR zieht.
Liebe Grüße, --Lesendes Okapi (Diskussion) 21:21, 17. Jan. 2019 (CET)
- Hallo Lesendes Okapi, denk dran, dass du den Artikel vor dem Übersetzen importierst (WP:Imp). Grüße --Dodecaeder (Diskussion) 21:33, 17. Jan. 2019 (CET)
- Zu den drei Punkten: die Substanz ist wie jede andere mit CAS-Nummer relevant für einen eigenen Artikel, s. WP:RLC#Relevanzkriterien für Chemie-Artikel. Der Name wäre fast wie der Englische: Tetrakis(triphenylphosphin)palladium(0). Die 0 ist übrigens die Ladung des Zentralatomes. Durchlesen sollte kein Problem sein. Viele Grüße --Orci Disk 21:39, 17. Jan. 2019 (CET)
- übrigens: der Katalysator wird verwendet bei der Suzuki-Reaktion, der Stille-Kupplung und der Heck-Reaktion. Grüße--Dodecaeder (Diskussion) 09:32, 18. Jan. 2019 (CET)
- Noch eine Anmerkung zum Namen: IUPAC kennt eigentlich nur Phosphan, Phosphin sollte eigentlich nicht mehr verwendet werden, eine entsprechende Weiterleitung von der Phosphin- zur Phosphan-Variante ist aber dennoch sinnvoll. – Sivizius (Diskussion) 00:43, 26. Feb. 2019 (CET)
- Zu den drei Punkten: die Substanz ist wie jede andere mit CAS-Nummer relevant für einen eigenen Artikel, s. WP:RLC#Relevanzkriterien für Chemie-Artikel. Der Name wäre fast wie der Englische: Tetrakis(triphenylphosphin)palladium(0). Die 0 ist übrigens die Ladung des Zentralatomes. Durchlesen sollte kein Problem sein. Viele Grüße --Orci Disk 21:39, 17. Jan. 2019 (CET)
- Hallo Lesendes Okapi, denk dran, dass du den Artikel vor dem Übersetzen importierst (WP:Imp). Grüße --Dodecaeder (Diskussion) 21:33, 17. Jan. 2019 (CET)
@Lesendes Okapi: Reichen dir diese Antworten aus? --Leyo 10:24, 25. Feb. 2019 (CET)
- Ja, vielen lieben Dank für die Antworten!
- Ich habe bereits mit der Übersetzung angefangen und dachte, ich wäre paar Tage später fertig und könnte mich hier direkt mit einem Link zum Artikelentwurf zurückmelden, aber wie immer kam das RL dazwischen :)
- Der Abschnitt kann archiviert werden, ich werde ihn zu gegebener Zeit wieder aus dem Archiv fischen um zu gucken wem ich den Artikel zum Lesen schicken wollte. LG, --Lesendes Okapi (Diskussion) 20:20, 25. Feb. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 22:24, 2. Mär. 2019 (CET)
JWBE hat den gröbsten Bock zwar behoben, aber die Kategorisierung ist noch unvollständig und – trotz Grösse des Moleküls – ist wohl eine Chemobox sinnvoll. --Leyo 23:04, 9. Jan. 2019 (CET)
- Moin, moin, hier kann IMHO auch mal auf die Chemobox verzichtet werden. MfG --Jü (Diskussion) 10:58, 15. Jan. 2019 (CET)
- Kats sind drin. --Orci Disk 16:21, 21. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 12:27, 8. Mär. 2019 (CET)
Chemische Kategorisierung fehlt, unvollständige GefStKz. --Leyo 23:38, 4. Jan. 2019 (CET)
- Sollte jetzt passen.--Mabschaaf 08:44, 5. Jan. 2019 (CET)
- OMPA ("Schradan") hat kein Strukturelement, das die tiefbraune Farbe erklären könnte... Beim Siedepunkt fehlt der Druck. Dass Isoniazid und Iproniazid antagonistisch wirken sollen, leuchtet mir nicht im Geringsten ein. Ein wirklich wirksamer Antagonist wäre Atropin, weiterhin würde man zu Regenerierung der blockierten Acetylcholinesterase Obidoxim und ähnliche Stoffe einsetzen. --FK1954 (Diskussion) 12:29, 5. Jan. 2019 (CET)
- Nur aus Interesse: Welche Strukturelemente könnten denn eine tiefbraune Farbe erklären?
- Soll in der BKS ein Eintrag und die Abkürzung im Artikel ergänzt werden?
- Ein Zulassungs-Abschnitt fehlt noch (Beispiel). --Leyo 23:28, 5. Jan. 2019 (CET)
- Nun ja, der reine Stoff muss farblos sein. Weiterhin: Phenole und aromatische Amine werden gern braun. Sowas haben wir hier nicht drin... --FK1954 (Diskussion) 03:13, 6. Jan. 2019 (CET)
- @FK1954: Wie in der zitierten Quelle genannt, wirken Isoniazid und Iproniazid als Antagonisten von Schradan, indem sie Inhibitoren der Oxidasen in der Leber sind. Leider fand ich vorerst keine Informationen zum Metabolismus des Schradans in Insekten, in Säugetieren und Pflanzen entsteht Hydroxymethylschradan als Stoffwechselprodukt, welches wesentlicher toxischer als Schradan ist (siehe eingeschränkte Vorschau in der Google-Buchsuche). Zur Zulassung und späterem Verschwinden von Schradan fand ich leider kaum Literatur, es ist in der PPDB nur vermerkt:
- UK LERAP status No UK approval for use as a pesticide under EC Regulation 1107/2009
- Formulation and application details No longer available.
- Nun ja, der reine Stoff muss farblos sein. Weiterhin: Phenole und aromatische Amine werden gern braun. Sowas haben wir hier nicht drin... --FK1954 (Diskussion) 03:13, 6. Jan. 2019 (CET)
- OMPA ("Schradan") hat kein Strukturelement, das die tiefbraune Farbe erklären könnte... Beim Siedepunkt fehlt der Druck. Dass Isoniazid und Iproniazid antagonistisch wirken sollen, leuchtet mir nicht im Geringsten ein. Ein wirklich wirksamer Antagonist wäre Atropin, weiterhin würde man zu Regenerierung der blockierten Acetylcholinesterase Obidoxim und ähnliche Stoffe einsetzen. --FK1954 (Diskussion) 12:29, 5. Jan. 2019 (CET)
- was nicht sehr hilfreich ist…--Speedpera (Diskussion) 09:18, 7. Jan. 2019 (CET)
- Achso, danke für die Erläuterung. Man müsste die Hydrazide aber VOR Kontakt mit Schradan einnehmen. Wenn sich die Giftwirkung erstmal bemerkbar macht, nützen die nichts mehr. Dann ist Atropin bzw. Obidoxim angesagt.--FK1954 (Diskussion) 09:46, 7. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Ghilt (Diskussion) 10:16, 11. Mär. 2019 (CET)
Hier wäre die Kategorie:Polycyclischer aromatischer Kohlenwasserstoff passend, oder? --Leyo 17:50, 7. Jan. 2019 (CET)
- Zur Kategoriefrage: ja, die PAK-Kat ist die richtige, ist korrigiert. --Orci Disk 11:01, 8. Jan. 2019 (CET)
Äh, das ist nicht das Molekül, das Williams 2011 erwähnt [7] ! In dem Video hier [1:10] zeichnet zwar jemand einen Gleichgewichtspfeile zwischen allen möglichen Isomeren mit der Methylengruppe an unterschiedlichen Stellen [8], aber das schreit nach Erklärung! Gruß, --Maxus96 (Diskussion) 21:13, 7. Jan. 2019 (CET)
- Siehe Kommentar von Antony Williams ganz unten: „The tautomer drawn here was originally labeled as Olympicene. Later on microscopy imaging detected a symmetric tautomer and we labeled that as Olympicene for the enormous press coverage“.
- Entsprechend wäre wohl CID 10977566 (statt CID 14008926) passend. --Leyo 11:33, 8. Jan. 2019 (CET)
Kann jemand herausfinden, ob die in der französischen Wikipedia erwähnte CAS Nummer 191-32-2 richtig ist? Rjh (Diskussion) 07:08, 8. Jan. 2019 (CET)
- Laut Reaxys ist die CAS-Nummer 191-33-3.--Steffen 962 (Diskussion) 10:28, 8. Jan. 2019 (CET)
- Für welche Verbindung steht denn die (sehr ähnliche) CAS-Nr. 191-32-2 aus dem franz. Artikel? --Leyo 11:11, 8. Jan. 2019 (CET)
- ...2H-Benzo(cd)pyren, also CH2-Funktion an anderer Position (siehe Reaxys).--Steffen 962 (Diskussion) 14:34, 8. Jan. 2019 (CET)
- Für welche Verbindung steht denn die (sehr ähnliche) CAS-Nr. 191-32-2 aus dem franz. Artikel? --Leyo 11:11, 8. Jan. 2019 (CET)

- Und die Methylen-Gruppe kann nach Belieben (Tautomerie) zwischen den verschiedenen Positionen umherwandern? Wow. --Maxus96 (Diskussion) 23:37, 8. Jan. 2019 (CET)
- Ich habe hier, wie oben angefragt, nur die in Reaxys angegebene Zuordnung der CAS-Nummern und Strukturen wiedergegeben. Mit der Tautomerie habe ich mich nicht tiefer beschäftigt. Das findet sich möglicherweise in der Originalliteratur.--Steffen 962 (Diskussion) 00:12, 9. Jan. 2019 (CET)
- @Maxus96: Das hört sich bei dir so an, als würde eine ganze Methylengruppe wandern müssen, aber tatsächlich ist es nur ein einzelnes Proton. Was keine Aussage darüber trifft, ob das der Wirklichkeit entspricht. --Blaues-Monsterle (Diskussion) 00:34, 9. Jan. 2019 (CET)
- Hä? Wenn ein Wasserstoff-Atom (bitte sei genau wenn du schon so unterwegs bist ;-)) wandert, dann wandert die *Position* der Methylen-Gruppe mit. Das ist effektiv das gleiche. --Maxus96 (Diskussion) 22:27, 9. Jan. 2019 (CET)
- Ja, es hatte sich bei dir nur so angehört, als würde ein kompletter von einem Lokanten an einen anderen wechseln. --Blaues-Monsterle (Diskussion) 10:50, 10. Jan. 2019 (CET)
- Hä? Wenn ein Wasserstoff-Atom (bitte sei genau wenn du schon so unterwegs bist ;-)) wandert, dann wandert die *Position* der Methylen-Gruppe mit. Das ist effektiv das gleiche. --Maxus96 (Diskussion) 22:27, 9. Jan. 2019 (CET)
- @Maxus96: Das hört sich bei dir so an, als würde eine ganze Methylengruppe wandern müssen, aber tatsächlich ist es nur ein einzelnes Proton. Was keine Aussage darüber trifft, ob das der Wirklichkeit entspricht. --Blaues-Monsterle (Diskussion) 00:34, 9. Jan. 2019 (CET)
- Ich habe hier, wie oben angefragt, nur die in Reaxys angegebene Zuordnung der CAS-Nummern und Strukturen wiedergegeben. Mit der Tautomerie habe ich mich nicht tiefer beschäftigt. Das findet sich möglicherweise in der Originalliteratur.--Steffen 962 (Diskussion) 00:12, 9. Jan. 2019 (CET)
- Und die Methylen-Gruppe kann nach Belieben (Tautomerie) zwischen den verschiedenen Positionen umherwandern? Wow. --Maxus96 (Diskussion) 23:37, 8. Jan. 2019 (CET)
Mit dieser PubChem-Korrektur können wir hier schliessen, oder? --Leyo 13:26, 11. Mär. 2019 (CET)
- Äh, nein, damit hast Du Kategorie:Wikipedia:Wikidata-Wartung:PubChem abweichend geworfen. Fassen wir doch mal zusammen: Es gibt laut obigen Angaben
- aber nur ein Datenobjekt auf Wikidata, 2H-Benzo[cd]pyren (Q2025856), und das verknüpft CAS 191-33-3 mit PubChem 14008926 und zumindest in der engl. Beschreibung mit 2H-Benzo(cd)pyren. Das müssten wir schon sauber auflösen...--Mabschaaf 17:25, 11. Mär. 2019 (CET)
- Du hast meinen Bearbeitungskommentar übersehen. Wikidata habe ich bewusst noch nicht angepasst, da ich abwarten wollte, ob meine PubChem-Änderung ggf. nicht als korrekt angeschaut wird. Du hattest ja kürzlich bei Wikidata eine andere (oben als inkorrekt charakterisierte) CID eingetragen. --Leyo 22:07, 11. Mär. 2019 (CET)
- Jetzt müsste alles passen.--Mabschaaf 22:05, 12. Mär. 2019 (CET)
- OK, ich habe im einen Item noch die ChemSpider-ID und den InChIKey korrigiert. --Leyo 22:45, 12. Mär. 2019 (CET)
- Jetzt müsste alles passen.--Mabschaaf 22:05, 12. Mär. 2019 (CET)
- Du hast meinen Bearbeitungskommentar übersehen. Wikidata habe ich bewusst noch nicht angepasst, da ich abwarten wollte, ob meine PubChem-Änderung ggf. nicht als korrekt angeschaut wird. Du hattest ja kürzlich bei Wikidata eine andere (oben als inkorrekt charakterisierte) CID eingetragen. --Leyo 22:07, 11. Mär. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 22:45, 12. Mär. 2019 (CET)
Wäre eine Weiterleitung auf Kreosot, wo Anthracenöl in der Infobox aufgeführt wird, sinnvoll? Oder wäre ein eigener Artikel zweckmässiger? --Leyo 16:27, 7. Jan. 2019 (CET) PS. EU-Jahresimport/-herstellung 10'000–100'000 Tonnen.
- Es gibt den Artikel Carbolineum, der u.a. das Anthracenöl beschreibt. Grüße --Dodecaeder (Diskussion) 16:41, 7. Jan. 2019 (CET)
Hm, das wäre auch eine Möglichkeit.Unter SVHC sind übrigens fünf verschiedene Anthracenöle aufgeführt. --Leyo 15:36, 9. Jan. 2019 (CET)- Laut Carbolineum#Herstellung wird Carbolineum aus Anthracenöl hergestellt, ist also nicht identisch … In Kreosot steht „Anthracenöl (Grünöl)“. Letzteres ist aber eine Weiterleitung auf Mitteldestillat, wo der Begriff Anthracenöl nicht vorkommt. Vorschläge? --Leyo 10:34, 25. Feb. 2019 (CET)
- Im Prinzip ist reines Anthracen ein kritalliner weißer Feststoff, der sublimiert. Als Öl liegt eigentlich nur das verunreinigte Rohprodunkt vor. --Dodecaeder (Diskussion) 12:42, 25. Feb. 2019 (CET)
Es ist ein Produkt der Steinkohlenteerdestillation und könnte dort als Fraktion näher beschrieben werden. Es besteht hauptsächlich aus Phenanthren, Anthracen, Carbazol und weiteren hochsiedenden Verbindungen. Der Artikel ist allerdings ziemlich kurz. --Mister Pommeroy (Diskussion) 18:50, 20. Mär. 2019 (CET)
- Das hört sich sinnvoll an. Könntest du dies tun? --Leyo 10:10, 9. Apr. 2019 (CEST)
- Ja, kein Problem, kann ich demnächst mal tun. --Mister Pommeroy (Diskussion) 19:12, 9. Apr. 2019 (CEST)
- Archivierung dieses Abschnittes wurde gewünscht von: Mister Pommeroy (Diskussion) 22:32, 11. Apr. 2019 (CEST)
Neu hier und eine Nachfrage
Hallo erstmal, hab Änderungsideen zu zwei Artikeln Diskussion:Kettenpolymerisation im Abschnitt genereller Artikelaufbau und Diskussion:Controlled Free Radical Polymerization im Abschnitt lebende Polymerisation beschrieben. Da es jetzt keinen Reaktionen auf die Vorschläge gab, jetzt meine Frage: Kann ich das einfach so ändern (Die Änderung im letzteren Artikel beinhaltet auch den Titel) oder wie genau funktioniert das genau? Vielen Dank! --Lehvaros (Diskussion) 21:38, 4. Jan. 2019 (CET)
- ++! Vor dem Verschieben sollte man alerdings imo mal ernsthaft über ein deutsches Lemma nachdenken. Gruß, und willkommen! --Maxus96 (Diskussion) 21:44, 4. Jan. 2019 (CET)
- Danke für die Antwort! Wo wird so ein "Nachdenken" über einen deutschen Titel am besten betrieben?--Lehvaros (Diskussion) 21:52, 4. Jan. 2019 (CET)
- Gibt es in der Fachliteratur schon einen dt. Namen? Grüße von unterwegs, --Ghilt (Diskussion) 13:20, 5. Jan. 2019 (CET)
- Für reversible-deactivation radical polymerization habe ich bisher keine Entsprechung gefunden. Stattdessen wird Kontrollierte radikalische Polymerisation (CRP) verwendet, was nicht der präferierten IUPAC-Empfehlung entspricht aber auch akzeptiert wird und im deutschen Sprachgebrauch verbreitet zu sein scheint. Ich würde deshalb Kontrollierte radikalische Polymerisation (CRP) als neuen Titel vorschlagen. --Lehvaros (Diskussion) 16:13, 5. Jan. 2019 (CET)
- Ggf. kann man auch (mehrere) Weiterleitungen anlegen. Ich bin schon zu lange aus dem Thema raus und hatte mit kontrollierten und lebenden Polymerisationen eh nur am Rande zu tun, bin also mit der Terminologie nicht allzu vertraut. --Elrond (Diskussion) 17:35, 5. Jan. 2019 (CET)
- Für reversible-deactivation radical polymerization habe ich bisher keine Entsprechung gefunden. Stattdessen wird Kontrollierte radikalische Polymerisation (CRP) verwendet, was nicht der präferierten IUPAC-Empfehlung entspricht aber auch akzeptiert wird und im deutschen Sprachgebrauch verbreitet zu sein scheint. Ich würde deshalb Kontrollierte radikalische Polymerisation (CRP) als neuen Titel vorschlagen. --Lehvaros (Diskussion) 16:13, 5. Jan. 2019 (CET)
- Gibt es in der Fachliteratur schon einen dt. Namen? Grüße von unterwegs, --Ghilt (Diskussion) 13:20, 5. Jan. 2019 (CET)
- Danke für die Antwort! Wo wird so ein "Nachdenken" über einen deutschen Titel am besten betrieben?--Lehvaros (Diskussion) 21:52, 4. Jan. 2019 (CET)
@Lehvaros, Maxus96, Ghilt, Elrond: Mögt ihr eure Diskussion unter Diskussion:Kettenpolymerisation und Diskussion:Controlled Free Radical Polymerization weiterführen, so dass der Abschnitt hier geschlossen werden kann? --Leyo 13:00, 8. Mär. 2019 (CET)
- Von mir aus gerne, --Ghilt (Diskussion) 15:27, 8. Mär. 2019 (CET)
- Ja klar --Lehvaros (Diskussion) 17:04, 14. Mär. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: --Mabschaaf 19:46, 13. Jun. 2019 (CEST)
könnte da mal bitte ein Sachkundiger gegenlesen? Zwei Sätze, von denen der letzte recht wenig Sinn ergibt. --Schnabeltassentier (Diskussion) 08:28, 24. Jan. 2019 (CET)
- Mehr und genaueres mit Beispielen wäre da natürlich gut, aber Sinn ergeben die beiden Sätze. --Orci Disk 09:32, 24. Jan. 2019 (CET)
- Hab mal etwas Senf dazu gegeben. --Elrond (Diskussion) 20:45, 24. Jan. 2019 (CET)
Allenfalls könnte man noch einen Link auf den Goldbook-Eintrag ergänzen. --Leyo 12:17, 8. Feb. 2019 (CET)
@Kreuz Elf: Kannst du als Ersteller dieses Artikels noch etwas beitragen, damit wir diesen Knacknuss-Abschnitt archivieren können? --Leyo 00:52, 25. Jun. 2019 (CEST)
- Vielen Dank für die Anfrage, aber ich denke mal da gibt es nicht mehr viel zu zu sagen. Habe das damals mehr oder weniger aus dem Koltzenburg übertragen und so wie der Artikel jetzt ist, gefällt er mir schon ganz gut. Hoffe ihr könnt mit dieser Antwort etwas anfangen.--5.147.245.82 21:23, 25. Jun. 2019 (CEST)
@Schnabeltassentier, Elrond, Orci: Kann man diese Knacknuss als geknackt ansehen? --Leyo 00:12, 6. Jul. 2019 (CEST)
- Knacks. (= ja)--Elrond (Diskussion) 00:21, 6. Jul. 2019 (CEST)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 21:28, 7. Jul. 2019 (CEST)
Hat jemand Zugang zur Onlineversion der Roten Liste?
Im Artikel Wortlänge stand einst:
- So verzeichnet die „Rote Liste“ unter anderen die Bezeichnung „(6R,7R)-7-[(Z)-2-(2-Amino-4-thiazolyl)-2-methoxyiminoglyoxylamido]-3-{[(2,5-dihydro-6-hydroxy-2-methyl-5-oxo-1,2,4-triazin-3-yl)thio]methyl]}-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carbonsäure“ für ein Antibiotikum (Kurzbezeichnung „Ceftriaxon“).
Redonebird hat
- „(6R,7R)-7-[(Z)-2-(2-Amino-4-thiazolyl)-2-methoxyiminoglyoxylamido]-3-{[(2,5-dihydro-6-hydroxy-2-methyl-5-oxo-1,2,4-triazin-3-yl)thio]methyl]}-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carbonsäure“
durch
- „(6R,7R)-7-{[(2Z)-2-(2-Amino-1,3-thiazol-4-yl)-2-(methoxyimino)acetyl]amino}-3-{[(2-methyl-5,6-dioxo-1,2,5,6-tetrahydro-1,2,4-triazin-3-yl)sulfanyl]methyl}-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carbonsäure“
ersetzt, aber in der Roten Liste stand das so nicht, nehme ich an. Wie sieht es aktuell aus, kann das jemand nachsehen? -- IvanP (Diskussion) 20:36, 16. Jan. 2019 (CET)
- In der Printversion der "roten Liste" von 2018 ist der Name nach wie vor wie oben angegeben, die Version von Redonebird ist der Name, den auch Pubchem verwendet, und der IUPAC-conform ist, jetzt hätte ich noch einen dritten Vorschlag, nämlich aus der ECHA-Liste:
- (6R,7R)-7-[(2Z)-2-(2-amino-1,3-thiazol-4-yl)-2-(methoxyimino)acetamido]-3-{[(6-hydroxy-2-methyl-5-oxo-2,5-dihydro-1,2,4-triazin-3-yl)sulfanyl]methyl}-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid
oder
- (6R,7R)-7-[[(2Z)-2-(2-amino-1,3-thiazol-4-yl)-2-methoxyiminoacetyl]amino]-3-[(2-methyl-5,6-dioxo-1H-1,2,4-triazin-3-yl)sulfanylmethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid
- Das wären jetzt die international verbindlichen Namen (engl.). Grüße--Dodecaeder (Diskussion) 21:38, 16. Jan. 2019 (CET)
- Hallo Dodecaeder, bei der obigen Version scheint mir allerdings die Klammerung schief zu sein, da ist nämlich eine zusätzliche schließende eckige Klammer direkt nach „thio]methyl“ (zuvor mit runder Klammer direkt danach zitiert, was aber auch nicht passt), steht das wirklich so in der Roten Liste? Danke und beste Grüße! -- IvanP (Diskussion) 22:03, 16. Jan. 2019 (CET)
- exakte Übereinstimmung, auch bei der Klammerung. --Dodecaeder (Diskussion) 22:55, 16. Jan. 2019 (CET) Mit Lesebrrille genauer betrachtet ist wirklich in der "Roten Liste" eine Klammer zuviel, und der Fehler wurde übernommen.--Dodecaeder (Diskussion) 16:36, 19. Jan. 2019 (CET)
- Ich habe, aber in der Fachinformation zu einem Ceftriaxonpräparat bin ich nicht auf die Bandwurmbezeichnung gestoßen. Geht auch kürzer (nach Römpp): 7-[2-(2-Amino-4-thiazolyl)-2-methoxyiminoacetamido]-3-{[(2,5-dihydro-6-hydroxy-2-methyl-5-oxo-as-triazin-3-yl)thio]methyl}-3-cephem-4-Carbonsäure. Setzt voraus, dass man weiß was Cephem ist... --FK1954 (Diskussion) 11:00, 4. Feb. 2019 (CET)
- Hallo Dodecaeder, bei der obigen Version scheint mir allerdings die Klammerung schief zu sein, da ist nämlich eine zusätzliche schließende eckige Klammer direkt nach „thio]methyl“ (zuvor mit runder Klammer direkt danach zitiert, was aber auch nicht passt), steht das wirklich so in der Roten Liste? Danke und beste Grüße! -- IvanP (Diskussion) 22:03, 16. Jan. 2019 (CET)
Habe den Namen aus der Roten Liste [9], der dem IUPAC-Namen entspricht, eingetragen. Sollte nun erledigt sein. --Benff 18:38, 16. Dez. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Benff 18:38, 16. Dez. 2019 (CET)
Hinweis auf Vorgang in der en-WP
Ein Man-on-a-Mission entfernt gegenwärtig in der engl. WP alle Weblinks/Einzelnachweise auf verschiedene Websites, die auch lokal in diversen Artikeln zitiert werden:
- insource:/alanwood\.net\/pesticides/ (persönliche Website des Chairs von ISO/TC 81 (Common names for pesticides and other agrochemicals))
- insource:/pesticideinfo\.org/ (vom Pesticide Action Network geführte Datenbank mit Quellenangaben zu den Daten)
- insource:/ewg\.org/
Die Diskussionen dazu sind unter en:Wikipedia talk:WikiProject Chemistry#Mass removals bzw. en:Wikipedia:Reliable sources/Noticeboard#Compendium of Pesticide Common Names zu finden. IMHO ist das generelle Entfernen falsch. Falls ihr anderer Meinung sein solltest, so müsste man ggf. für die betroffenen Artikel Alternativbelege suchen. --Leyo 01:08, 25. Jan. 2019 (CET)
- Meine Meinung dazu ist, daß durch die Löschung viel mehr Schaden als Nutzen angerichtet wird. Ich glaube der Mensch hat nicht begriffen, wofür Quellenangaben sind. Sie sollen eben dazu dienen die Zuverlässigkeit einer Quelle selbst einschätzen zu können. Durch die stupide Entfernung der Quellenangabe nimmt man dem Leser diese Möglichkeit. Gegen die Ersetzung von Quellen (falls es bessere gibt) habe ich nichts. In der deutschen WP sehe ich aber keinen Bedarf dafür.Rjh (Diskussion) 07:44, 25. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: --JWBE (Diskussion) 22:31, 21. Dez. 2019 (CET)
Schematische Einteilung der Stoffe
hallo, Joachim Schnitter (Diskussion • Beiträge • hochgeladene Dateien • SBL-Log • Sperr-Logbuch • globale Beiträge • SUL • Logbuch) hat einwände zur von mir erstellen vorlage geäußert: spezial:diff/183488320/183488320
ich selber bin nicht vom fach und habe lediglich die grafik als vorlage genommen und einen verlinkten stammbaum erstellt
deshalb stelle ich das thema hier zur diskussion
„Die Gliederung der homogenen Gemische ist meiner Ansicht nach nicht korrekt. Hier werden im Grunde homogene feste, flüssige und gasförmige Gemische gegeneinander gestellt, sind aber falsch bezeichnet.
Es gibt bei Raumtemperatur homogene und heterogene feste Legierungen, und einige flüssige gibt es auch. Die meisten Legierungen sind fest und heterogen. Die Einordnung unter den homogenen Gemischen ist somit falsch. Da es auch intermetallische Verbindungen mit metallischem Charakter gibt (z. B. die Laves-Phasen), die man ebenfalls zu den Legierungen zählen kann, ist die Einordnung bei den Gemischen insgesamt falsch. (Die Bezeichnung "Legierung" von spätlat. legare = mischen bezieht sich auf den Herstellungsprozess, nicht auf den resultierenden Zustand, bedeutet also nicht Gemisch.)
Demgegenüber fehlen die metallischen Verbindungen auf der linken Seite des Diagramms unter "Verbindung". Dort fehlen auch Verbindungen mit gemischten Bindungen. z. B. Natriumacetat, in denen gleichzeitig molekulare/kovalente und Ionenbindungen vorliegen. Koordinative Bindungen spielen in der Praxis auch noch eine Rolle.
Ich schlage daher folgende Korrekturen vor: Zu den ionischen und molekularen Verbindungen werden die metallischen Verbindungen und Verbindungen mit mehreren Bindungstypen hinzugefügt. Die homogenen Gemische werden in feste, flüssige und gasförmige Gemische unterteilt. Die Legierungen werden insgesamt aus dem Diagramm entfernt.
Das Diagramm möchte ich als tendenziell unverträglich mit dem Stand der Wissenschaften bezeichnen. Es mag im Schulunterricht helfen, im Studium lernt man so viele Sonderfälle kennen, dass man schnell die Unvollständigkeit der Darstellung erkennt. Die Verwendung des Diagramms sollte m. E. zum Niveau des verwendenden Artikels oder Artikelabschnitts passen.“
--Mrmw (Diskussion) 12:52, 26. Jan. 2019 (CET)
- Kommentar: Ich möchte mir kein Urteil zu diesem Statement erlauben, aber dieses Schema steht zu Beginn jedes einführenden Lehrbuchs für Chemie. Man darf es nicht mit Phasendiagrammen verwechseln, die zusätzliche Parameter wie Druck und Temperatur berücksichtigen und daher komplizierter sind. (Man bezieht sich hier auf Raumtemperatur und Normaldruck, also Standardbedingungen.)
Worum geht es? Dafür braucht man erst mal eine Begriffsklärung:
- Homogen: ist a) ein Reinstoff oder eine Verbindung b) eine Mischung ohne Phasengrenze
- Heterogen: ist ein Stoffgemisch aus mehreren Reinstoffen oder Verbindungen mit mindestens einer Phasengrenze
Was ist Sinn und Zweck des Schemas? Um einen groben Überblick zu vermitteln, ist das Schema sicherlich gut.
Ohne Frage gibt es Spezialfälle, was jedoch nicht bedeutet, dass die Grafik deswegen falsch oder sinnlos ist.
Grüße von--Dodecaeder (Diskussion) 11:23, 30. Jan. 2019 (CET)
- P.S.: Intermetallische Phasen wie Laves-Phasen oder Zintl-Phasen oder Hume-Rothery-Phasen oder auch Mischkristalle lassen sich sicher eher an Schmelzdiagrammen/Phasendiagrammen erklären und dabei spielt auch die Bindungsart eine Rolle. Dabei handelt es sich jedoch um ein Spezialgebiet der anorganischen Chemie, das unter anderem beim Zonenschmelzverfahren zur Gewinnung von Reinstoffen und Einkristallen wichtig ist. Diese Phasen beziehen sich auf unterschiedliche Gitterstrukturen einer metallischen Verbindung, bspw. im Kupfer-Zink -Gemisch, dabei wechseln sich bspw. ein kubisch flächenzentriertes, ein kubisch raumzentriertes und ein hexagonales Gitter ab. --Dodecaeder (Diskussion) 13:28, 30. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: --JWBE (Diskussion) 18:30, 21. Dez. 2019 (CET)
Mikrobrownsche Bewegung und makrobrownsche Bewegung als Abgrenzung zu Brownsche Bewegung
Leider kommt es in Wikipedia-Artikeln zu Polymerverhalten (aber auch außerhalb des Projekts) immer wieder zu Verwechslung der Brownschen Bewegung, wie sie im dortigen Artikel beschrieben ist (eben als unregelmäßige Bewegung von Partikeln in Fluiden), mit den thermisch induzierten Bewegungen innerhalb von Polymermolekülen (ich kenne die Begriffe zumindest von da): a) mikrobrownsche B. im Falle der Bewegung von Kettensegmenten (also INTRAmolekulare Rotationen und Schwingungen von Backbone und Seitenketten) und b) makrobrownsche Bewegung im Falle der Bewegung ganzer Makromoleküle (also INTERmolekulare rotatorische und translatorische Bewegungen). Der Unterschied ist m. E. größer, als es die sprachliche Nähe vermuten lässt. Daher könnte es Sinn machen, dafür eigene Artikel anzulegen. Oder sollten besser Unterkapitel im Artikel "Brownschen Bewegung" erstellt werden? --Blutgretchen (Diskussion) 13:37, 30. Jan. 2019 (CET)
- Fern davon ein Experte auf diesem Gebiet zu sein stelle ich mir vor, dass zwei Kapitel im oben genannten Artikel anschaulicher/übersichtlicher sind, zumindest für mich als Laien. --Elrond (Diskussion) 15:26, 30. Jan. 2019 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: --JWBE (Diskussion) 18:31, 21. Dez. 2019 (CET)
Dort wird die Strukturformel von Lithiumtetraborat diskutiert. Erstellt worden war sie von Nothingserious, der gegenwärtig leider inaktiv ist. Mag sich das ein Anorganiker anschauen? --Leyo 21:38, 21. Jan. 2019 (CET)
- Ich kann da zwar nicht helfen, habe aber ein Bild [10] gefunden.Rjh (Diskussion) 22:55, 21. Jan. 2019 (CET)
- Im engl. Artikel wurde die Strukturformel ersetzt. Vielleicht können wir ein Bild von dort übernehmen. --Leyo 10:04, 22. Jan. 2019 (CET)
- @Orci, Bert.Kilanowski, Andif1: Was meint ihr als Anorganiker dazu? --Leyo 23:55, 26. Jan. 2019 (CET)
- M.e. haben Smokefoot und Ed da Recht, es gibt keine B-O-Doppelbindungen in Boraten, das sind Ketten oder Ringe. --Orci Disk 09:33, 27. Jan. 2019 (CET)
- Die Formel mit Doppelbindungen ist Unsinn. Eine Übernahme der gegenwärtigen Abbildung der Kristallstruktur halte ich aber auch nicht für sinnvoll (das Kettenfragment schon, die Gesamtstruktur nicht). Was soll der Laie auf dem Bild erkennen? Es gibt viele Grenzfälle für die Einbindung eines Bildes der Kristallstruktur, dieser Fall ist für mich aber deutlich jenseits der Grenze. --Andif1 (Diskussion) 10:20, 27. Jan. 2019 (CET)
- M.e. haben Smokefoot und Ed da Recht, es gibt keine B-O-Doppelbindungen in Boraten, das sind Ketten oder Ringe. --Orci Disk 09:33, 27. Jan. 2019 (CET)

- Das Anion hat die nebenstehende bicyclische Struktur. Die gleiche Löschdiskussion gibt es gerade auch für Ammoniumtetraborate. Gruß --Bert (Diskussion) 13:38, 27. Jan. 2019 (CET)
- Können beim Bild rechts ggf. die H+ durch Li+ ersetzt werden oder sollte das Strukturformel-Feld besser ausgeblendet werden? --Leyo 00:02, 28. Jan. 2019 (CET)
- Nur die H+ ersetzen reicht nicht aus, es müssten auch noch die H-Atome im Anion durch gestrichelte Linien o.ä. ausgetauscht werden, da dort keine Abschluss-H-Atome sind, sondern Bindungen zum nächsten Borat-Ring (das ist auch bei diesem Bild problematisch, wenn man ein Hydrat haben möchte, bräuchte man noch mehr freies Wasser da es keine Dihydrate, sondern Penta- oder Decahydrate sind). --Orci Disk 00:31, 28. Jan. 2019 (CET)
- Nach Greenwood/Earnshaw (zumindest in meiner zugegebenermaßen schon etwas älteren Fassung) liegt das Anion bei anwesendem Kristallwasser in der rechts gezeichneten Form vor. Für das Decahydrat (Borax) wird dort auch als korrektere Form Na2[B4O5(OH)4] • 8 H2O empfohlen. Da wir Kristallwaser in der Regel nicht mit einzeichnen, könnten wir diese Bilder nmM im Prinzip schon nehmen. Das Problem ist (a) dass bei zunehmender Entwässerung die Tetraboratanionen unter Wasserabgabe polymerisieren und (b) dass das Lithiumtetraborat nur die wasserfreie Substanz behandelt, Natriumtetraborat aber wasserfrei bis Decahydrat. Dann müssten wir genau genommen für jede Form nun eine eigene Struktur zeichnen. Gruß --Bert (Diskussion) 00:53, 28. Jan. 2019 (CET)
- Bei Lithiumtetraborat gibt es wohl gar keine Hydrate, da braucht man auf jeden Fall eine wasserfreie Struktur (entweder gezeichnetes Bild oder Kristallstruktur). Ansonsten würde ich in die Box auch die wasserfreie Struktur stellen, wenn man noch welche von Hydraten haben möchte, können die dann auch in den Text. --Orci Disk 01:04, 28. Jan. 2019 (CET)
- Nach Greenwood/Earnshaw (zumindest in meiner zugegebenermaßen schon etwas älteren Fassung) liegt das Anion bei anwesendem Kristallwasser in der rechts gezeichneten Form vor. Für das Decahydrat (Borax) wird dort auch als korrektere Form Na2[B4O5(OH)4] • 8 H2O empfohlen. Da wir Kristallwaser in der Regel nicht mit einzeichnen, könnten wir diese Bilder nmM im Prinzip schon nehmen. Das Problem ist (a) dass bei zunehmender Entwässerung die Tetraboratanionen unter Wasserabgabe polymerisieren und (b) dass das Lithiumtetraborat nur die wasserfreie Substanz behandelt, Natriumtetraborat aber wasserfrei bis Decahydrat. Dann müssten wir genau genommen für jede Form nun eine eigene Struktur zeichnen. Gruß --Bert (Diskussion) 00:53, 28. Jan. 2019 (CET)
- Nur die H+ ersetzen reicht nicht aus, es müssten auch noch die H-Atome im Anion durch gestrichelte Linien o.ä. ausgetauscht werden, da dort keine Abschluss-H-Atome sind, sondern Bindungen zum nächsten Borat-Ring (das ist auch bei diesem Bild problematisch, wenn man ein Hydrat haben möchte, bräuchte man noch mehr freies Wasser da es keine Dihydrate, sondern Penta- oder Decahydrate sind). --Orci Disk 00:31, 28. Jan. 2019 (CET)
- Können beim Bild rechts ggf. die H+ durch Li+ ersetzt werden oder sollte das Strukturformel-Feld besser ausgeblendet werden? --Leyo 00:02, 28. Jan. 2019 (CET)
- Römpp erwähnt ein Lithiumtetraborat-Pentahydrat, Schmp 930 °C wasserfrei. Ein Teil des Wassers steckt im Tetraborat-Anion... Ein wasserfreies Tetraborat-Anion kann es also nicht geben. --FK1954 (Diskussion) 11:24, 4. Feb. 2019 (CET)
- @FK1954:Es gibt zwei Kristallstrukturbestimmungen von wasserfreiem Lithiumtetraborat.--Andif1 (Diskussion) 11:22, 7. Feb. 2019 (CET)
- Das Anion hat die nebenstehende bicyclische Struktur. Die gleiche Löschdiskussion gibt es gerade auch für Ammoniumtetraborate. Gruß --Bert (Diskussion) 13:38, 27. Jan. 2019 (CET)

- Mit der auf en:wikipedia abgebildeten Kette habe ich allerdings ein Problem. Es mag sein, dass ich gewaltig auf der Leitung stehe, aber ich sehe da die Zusammensetzung B4O8. Da müssen Brücken zu benachbarten Gruppen fehlen. Ich schaue mir die Struktur so schnell wie möglich an.--Andif1 (Diskussion) 11:33, 7. Feb. 2019 (CET)
- Richtig, es fehlen Brücken. Laut HoWi sind diese Doppelringe über O-Atome mit benachbarten Doppelringen verbrückt. Damit ergibt sich ein Raumnetz. --FK1954 (Diskussion) 11:53, 7. Feb. 2019 (CET)
- Stimmt. Ich halte eine entsprechend angepasste Strichformel für am sinnvollsten.--Andif1 (Diskussion) 21:11, 16. Feb. 2019 (CET)
- @Andif1, FK1954: Mag jemand diese Struktur zeichnen? Falls es eine korrekte Abbildung gibt, kann ansonsten auch ich diese nachzeichnen. --Leyo 10:12, 9. Apr. 2019 (CEST)
- Das ist bei 3D-polymeren Strukturen nicht trivial. Ich habe keinen Zugang zu Chemdraw und bin auch nicht in der Verwendung ähnlicher Programme geübt. Man könnte die Abbildung in der Box dahingehend modifizieren, dass man die H-Atome entfernt und durch „freie“ Bindungen ersetzt um den polymeren Charakter zu zeigen. Eine Abbildung der kompletten Elementarzelle anzufertigen, wäre kein Problem; allerdings ist die Struktur so komplex, dass darauf praktisch nichts zu erkennen ist. Dass das Anion aus trigonal-planaren BO3- und tetraedrischen BO4-Einheiten besteht, könnte man auch im Text beschreiben. --Andif1 (Diskussion) 15:55, 9. Apr. 2019 (CEST)
- OK, ich mache ASAP einen Entwurf. --Leyo 16:19, 9. Apr. 2019 (CEST)
- @Leyo: Wie ist hier der aktuelle Stand? --Ameisenigel (Diskussion) LI 21:28, 12. Jun. 2021 (CEST)
- OK, ich mache ASAP einen Entwurf. --Leyo 16:19, 9. Apr. 2019 (CEST)
- Das ist bei 3D-polymeren Strukturen nicht trivial. Ich habe keinen Zugang zu Chemdraw und bin auch nicht in der Verwendung ähnlicher Programme geübt. Man könnte die Abbildung in der Box dahingehend modifizieren, dass man die H-Atome entfernt und durch „freie“ Bindungen ersetzt um den polymeren Charakter zu zeigen. Eine Abbildung der kompletten Elementarzelle anzufertigen, wäre kein Problem; allerdings ist die Struktur so komplex, dass darauf praktisch nichts zu erkennen ist. Dass das Anion aus trigonal-planaren BO3- und tetraedrischen BO4-Einheiten besteht, könnte man auch im Text beschreiben. --Andif1 (Diskussion) 15:55, 9. Apr. 2019 (CEST)
- @Andif1, FK1954: Mag jemand diese Struktur zeichnen? Falls es eine korrekte Abbildung gibt, kann ansonsten auch ich diese nachzeichnen. --Leyo 10:12, 9. Apr. 2019 (CEST)
- Stimmt. Ich halte eine entsprechend angepasste Strichformel für am sinnvollsten.--Andif1 (Diskussion) 21:11, 16. Feb. 2019 (CET)

- Sorry, dass es sooo lange gedauert hat! Ich habe mal zwei Entwürfe gemacht. @Orci, Andif1, FK1954: Rückmeldungen (welche Variante?) bzw. ggf. Anpassungswünsche sind erwünscht. --Leyo 23:22, 19. Jun. 2021 (CEST)
- Spontan finde ich die zweite Alternative übersichtlicher. --Andif1 (Diskussion) 09:56, 18. Dez. 2021 (CET)
- Danke für die Rückmeldung! Ich habe die SVG-Grafik auf jene Alternative zugeschnitten und sie in den Artikel eingefügt. --Leyo 00:50, 18. Mär. 2022 (CET)
- Spontan finde ich die zweite Alternative übersichtlicher. --Andif1 (Diskussion) 09:56, 18. Dez. 2021 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: Leyo 00:50, 18. Mär. 2022 (CET)
Geometrie von R–Mg–X
Ist bei Grignard-Verbindungen R–Mg–X gewinkelt oder linear? Bei den Strukturformeln in der Kategorie:Magnesiumorganische Verbindung ist die Geometrie uneinheitlich gezeichnet (sofern Mg–X nicht verkürzt angegeben ist). --Leyo 21:33, 20. Jan. 2019 (CET)
- Ist das eine akademische Frage, wie das nackte Molekül aussieht? In der Literatur, wie Elschenbroich: Organometallchemie oder Astruc: Organometallic Chemistry and Catalyst findet man, dass Grignard Reagenzien (oft) als Dimere oder z. B. in Et2O oder THF als solvatisierte Monomere, Dimere, Polymere vorliegen. Dort ist das Mg dann z. B. tetraedrisch koordiniert. Gruß --Bert (Diskussion) 23:03, 20. Jan. 2019 (CET)
- Mir geht's um die Chemobox-Strukturformeln der Artikel in der genannten Kategorie. --Leyo 23:13, 20. Jan. 2019 (CET)
- Weit mehr Bauchweh machen mir die Formeln, in denen zwischen Mg und dem Halogen eine kovalente Bindung gezeichnet ist. Werde ich bei Gelegenheit ändern. --Elrond (Diskussion) 10:01, 21. Jan. 2019 (CET)
- Dann müsste aber die Geometrie auch korrekt sein … --Leyo 10:42, 21. Jan. 2019 (CET)
- Das ist, wie Bert schon schrieb, nicht ganz trivial. In Lösung und auch im Kristall (https://onlinelibrary.wiley.com/doi/epdf/10.1002/ange.19870990727) liegen zumeist Dimere vor, deren Formen und Zusammensetzungen stark vom Lösemittel und der Konzentration in der Lösung abhängen (siehe u.a. Schlenk-Gleichgewicht). Die Formeln in den Boxen sollten eher schematisch gesehen werden. --Elrond (Diskussion) 11:09, 21. Jan. 2019 (CET)
- Dann müsste aber die Geometrie auch korrekt sein … --Leyo 10:42, 21. Jan. 2019 (CET)
- Weit mehr Bauchweh machen mir die Formeln, in denen zwischen Mg und dem Halogen eine kovalente Bindung gezeichnet ist. Werde ich bei Gelegenheit ändern. --Elrond (Diskussion) 10:01, 21. Jan. 2019 (CET)
- Mir geht's um die Chemobox-Strukturformeln der Artikel in der genannten Kategorie. --Leyo 23:13, 20. Jan. 2019 (CET)
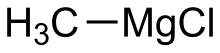
- Am besten wäre es wohl, in den Chemboxen beides gleichzeitig zu korrigieren: wenn die kovalente Bindung zwischen Mg und X entfällt, wären wir bei einer Zeichnung wie der von Methylmagnesiumchlorid, womit sich die Frage ob die Verbindung linear oder gewinkelt ist, dort ebenfalls erübrigt. Eine kovalente Bindung zu zeichnen halte ich aber nicht generell für falsch. Sie wird inbesondere dann verwendet, wenn es sich um das diskrete Molekül, deren Dimere oder solvatisierte Form handelt und da ist die Verwendung nmM durchaus vertretbar. Gruß --Bert (Diskussion) 17:48, 21. Jan. 2019 (CET)
- Moin, moin, bevorzugen sollten wir für Grignard-Verbindungen die Schreibweise R–MgX, akzeptabel wäre auch RMgX, nicht verwenden sollten wir R–Mg–X. MfG --Jü (Diskussion) 12:20, 22. Jan. 2019 (CET)
- +1 R–Mg–X geht nicht. Viele Grüße --JWBE (Diskussion) 23:30, 27. Jan. 2019 (CET)
- Nun, dann müssten wohl die Strukturformeln in Ethylmagnesiumchlorid, Methylmagnesiumbromid, Phenylmagnesiumchlorid und Dibutylmagnesium ersetzt oder angepasst werden. --Leyo 23:51, 27. Jan. 2019 (CET)
- DIbutylmagnesium ist OK, das sind zwei kovalente Bindungen zum C. Die anderen werde ich bei Gelegenheit ändern. Mal gucken, was Commons da bietet, sonst ist es schnell selbst gezeichnet. --10:18, 28. Jan. 2019 (CET)
- Ok, aber ist denn C–Mg–C tatsächlich gewinkelt oder vielleicht doch linear (wie z.B. C–Hg–C)? --Leyo 21:21, 28. Jan. 2019 (CET)
- Die Formeln sind wie schon geschrieben eher schematisch, denn wenn man es halbwegs korrekt haben will, müsste man zumindest die Dimere zeichnen, besser noch die Etherkomplexe oder noch besser die diversen Gleichgewichte. Dann also m.E. besser schematisch. --Elrond (Diskussion) 21:46, 28. Jan. 2019 (CET)
- Ich bezog mich nur aufs Dibutylmagnesium. Liegt dieses denn auch als Dimer vor? Sigma-Adrich zeigt übrigens eine gewinkelte Stukturformel, die ECHA eine lineare. --Leyo 22:28, 28. Jan. 2019 (CET)
- Die Formeln sind wie schon geschrieben eher schematisch, denn wenn man es halbwegs korrekt haben will, müsste man zumindest die Dimere zeichnen, besser noch die Etherkomplexe oder noch besser die diversen Gleichgewichte. Dann also m.E. besser schematisch. --Elrond (Diskussion) 21:46, 28. Jan. 2019 (CET)
- Ok, aber ist denn C–Mg–C tatsächlich gewinkelt oder vielleicht doch linear (wie z.B. C–Hg–C)? --Leyo 21:21, 28. Jan. 2019 (CET)
- DIbutylmagnesium ist OK, das sind zwei kovalente Bindungen zum C. Die anderen werde ich bei Gelegenheit ändern. Mal gucken, was Commons da bietet, sonst ist es schnell selbst gezeichnet. --10:18, 28. Jan. 2019 (CET)
- Nun, dann müssten wohl die Strukturformeln in Ethylmagnesiumchlorid, Methylmagnesiumbromid, Phenylmagnesiumchlorid und Dibutylmagnesium ersetzt oder angepasst werden. --Leyo 23:51, 27. Jan. 2019 (CET)
- +1 R–Mg–X geht nicht. Viele Grüße --JWBE (Diskussion) 23:30, 27. Jan. 2019 (CET)
- Moin, moin, bevorzugen sollten wir für Grignard-Verbindungen die Schreibweise R–MgX, akzeptabel wäre auch RMgX, nicht verwenden sollten wir R–Mg–X. MfG --Jü (Diskussion) 12:20, 22. Jan. 2019 (CET)
- Am besten wäre es wohl, in den Chemboxen beides gleichzeitig zu korrigieren: wenn die kovalente Bindung zwischen Mg und X entfällt, wären wir bei einer Zeichnung wie der von Methylmagnesiumchlorid, womit sich die Frage ob die Verbindung linear oder gewinkelt ist, dort ebenfalls erübrigt. Eine kovalente Bindung zu zeichnen halte ich aber nicht generell für falsch. Sie wird inbesondere dann verwendet, wenn es sich um das diskrete Molekül, deren Dimere oder solvatisierte Form handelt und da ist die Verwendung nmM durchaus vertretbar. Gruß --Bert (Diskussion) 17:48, 21. Jan. 2019 (CET)
- Ich fang mal wieder links an. Ein Übersichtsartikel über die Strukturen diverser Metallorganyle findet man hier. Gruß Bert
- Ich habe leider keinen Vollzugriff. Steht dort etwas zur Geometrie von Dialkylmagnesiumverbindungen? --Leyo 23:34, 29. Jan. 2019 (CET)
- Schau mal in deine E-mails. Gruß --Bert (Diskussion) 00:03, 30. Jan. 2019 (CET)
- Danke. Hm, gemäss Kapitel 5.1 müsste es wohl analog zu Dimethylmagnesium als polymere Struktur gezeichnet werden, oder? --Leyo 00:32, 31. Jan. 2019 (CET) PS. Es fragt sich, ob sogar die Infobox Polymer passend wäre.
- Dimethylmagnesium ist in Kohlenwasserstoffen so gut wie unlöslich, Dibutylmagnesium ist in Aromaten und Aliphaten recht gut löslich (Solubility: moderately sol (<1.3 M) aliphatic and aromatic hydrocarbons; highly sol ethereal solvents; reacts exothermically with water and protic solvents. Encyclopedia of Reagents for Organic Synthesis Dibutylmagnesium Terry L. Rathman First published: 15 April 2001 https://doi.org/10.1002/047084289X.rd063), was gegen eine polymere Struktur spricht. Genaueres hab ich aber auf die Schnelle nicht gefunden, für solche Suchstrategien hab ich im SciFinder zu wenig Erfahrung. --Elrond (Diskussion) 11:20, 31. Jan. 2019 (CET)
- Danke. Hm, gemäss Kapitel 5.1 müsste es wohl analog zu Dimethylmagnesium als polymere Struktur gezeichnet werden, oder? --Leyo 00:32, 31. Jan. 2019 (CET) PS. Es fragt sich, ob sogar die Infobox Polymer passend wäre.
- Schau mal in deine E-mails. Gruß --Bert (Diskussion) 00:03, 30. Jan. 2019 (CET)
- Ich habe leider keinen Vollzugriff. Steht dort etwas zur Geometrie von Dialkylmagnesiumverbindungen? --Leyo 23:34, 29. Jan. 2019 (CET)
Unter den oben genannten Vorgaben bedarf der Artikel Grignard-Verbindungen auch einer Überarbeitung --Elrond (Diskussion) 17:55, 4. Feb. 2019 (CET)
- Insbesondere wird im Artikel auf den Bindungscharakter zwischen Magnesium und dem Halogen nicht eingegangen. Der Artikel Schlenkgleichgewicht damit dann auch. Insbesondere auch die polymeren Strukturen einerseits und Reaktion mit Dioxan andererseits. Siehe Organometallchemie Elschenbroich, wobei interessanterweise in meiner Fassung dieser auch kovalente Bindungen zeichnet. – Sivizius (Diskussion) 12:04, 7. Feb. 2019 (CET)
@Elrond, Sivizius: Könntet ihr die vorgeschlagenen Änderungen übernehmen? --Leyo 10:03, 9. Apr. 2019 (CEST)
- Dann stelle ich mal zum Artikel noch zwei Fragen: bekommt das Mg im Abschnitt Bildung wirklich ein "Elektronenoktett", oder soll da nicht lieber Richtung Komplexchemie verlinkt werden? Und bei Eigenschaften wird 35 % Ionencharakter angegeben - das muss sich doch auf eine konkrete Verbindung beziehen und kann gar nicht allgemein sein. Wie kommt die Zahl außerdem zustande, das klingt nach einer Rechnung (und dann: welcher?)? Ich würde die Zahl rausschmeißen, da sie nicht allgemein ist und nicht eingeordnet ist. Oder hat jemand Literatur dazu, woran das ausgeführt werden könnte?--!nnovativ (Diskussion) 09:16, 12. Jun. 2019 (CEST)
- Die betreffende Textstelle stammt vom inaktiven Nescius. Hat jemand Zugiff auf das zitierte Buch? --Leyo 00:22, 10. Nov. 2022 (CET)
Bezüglich der Darstellung scheint Einigkeit zu herrschen. Ich habe diese bei einschlägigen Artikeln noch mal geprüft. Daher sollte das jetzt passen. --Anagkai (Diskussion) 18:15, 4. Jul. 2024 (CEST)
- Archivierung dieses Abschnittes wurde gewünscht von: --Anagkai (Diskussion) 18:15, 4. Jul. 2024 (CEST)
