Benutzer:Orci/Namensreaktionen/H
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion | |||||
| Zoltan G. Hajos, David Parrish, Ulrich Eder, Gerhard Sauer, Rudolf Wiechert | 1971 | Trikenone, Prolin | Prolin-katalysierte enantioselektiven Michael-Addition, innermolekulare Aldolreaktion unter Cyclisierung | bicyclische chirale Ketole | [1][2] |

| |||||
| Haller-Bauer-Reaktion | |||||
| A. Haller, Ed. Bauer | 1909 | Nichtenolisierbare Ketone, Natriumamid | nukleophiler Angriff des Amides, Spaltung der C-C-Bindung | Carbonsäureamide | [3] |

| |||||
| Hammick-Reaktion | |||||
| Dalziel Hammick | 1937 | Picolinsäure, Carbonylverbindung | Abspaltung von CO2 in der Hitze und Carbenbildung, nukleophiler Angrif auf Carbonylverbindung unter Alkoholatbildung, intramolekulare Protonenumlagerung | 2-Pyridin-Alkohole | [4] |

| |||||
| Hansley-Prelog-Acyloin-Kondensation | |||||
| V. L. Hansley, Vladimir Prelog 193 | 1935 | Dicarbonsäurediester, Natrium | intramolekulare Acyloin-Kondensation | cyclischen Acyloine | [5] |

| |||||
| Hanaoka–Wrobel-Chinolizidin-Synthese | |||||
| Miyoji Hanaoka, J.T. Wrobel | 1971/74 | Isopelletierin, aromatische Aldehyde, Base | Kondensation | Chinolizidin | [6][7] |
| Hantzschsche Dihydropyridinsynthese | |||||
| Arthur Hantzsch | 1881 | β-Ketocarbonylverbindung, Aldehyd, Ammoniak oder primäres Amin | Knoevenagel-Reaktion von β-Ketocarbonylverbindung und Ammoniak zum Enamin, Bildung einer ungesättigten Carbonylverbindung aus Carbonylverbindung und Aldehyd, Michael-Addition | Dihydropyridine | [8] |

| |||||
| Hantzschsche Pyrrolsynthese | |||||
| Arthur Hantzsch | 1890 | β-Ketoester, Amin, α-Halogenketon | Bildung eines Enamins, nukleophiles Substitution des Halogens, Ringschluss | Pyrrol-Derivate | [9] |
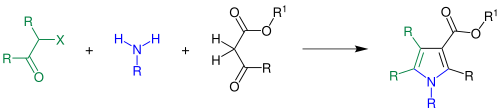
| |||||
| Hantzschsche Thiazolsynthese | |||||
| Arthur Hantzsch | 1887 | Thioamide, α-halogenierte Ketone/Aldehyde, Base | Kondensation | Thiazole | [10] |

| |||||
| Harries-Ozonolyse | |||||
| Carl Dietrich Harries | 1905 | Alkene, Ozon | 1,3-Dipolare Cycloaddition, Bildung des Sekundärozonides, Hydrolyse | Ketone | [11] |
| Hashimi-Phenolsynthese | |||||
| Stephen K. Hashmi | 2000 | ω-Alkynylfurane, Gold(III)-chlorid (Katalystor) | Cycloisomerisierung | Phenole | [12] |

| |||||
| Hass-Bender-Oxidation | |||||
| Henry B. Hass, Myron L. Bender | 1949 | Benzylhalogenide, 2-Nitropropan | Oxidation | Benzaldehyde | [13] |

| |||||
| Hassner-Ghera-Little-Ringschlussreaktion | |||||
| Alfred Hassner, Eugene Ghera, Daniel Little | 1980/90 | aktivierte Methylene, Alkene, Lithiumdiisopropylamid | Michael-Addition, Ringschluss | drei bis siebenteilige Ringe | [14][15] |
| Hauser-Annelierung | |||||
| Frank M. Hauser | 1977 | aromatische Sulfone/Sulfoxide, Michael-Akzeptoren, Lithiumdiisopropylamid | Michael-Addition, Dieckmann-Kondensation, Eliminierung | Hydroxynaphthalene | [16] |

| |||||
| Hauser-Beak-Ortholithiierung | |||||
| Charles Hauser, Peter Beak | 1969/77 | Benzamide, n-Butyllithium, CO2, tert-Butyllithium, Halogenalkane | Deprotonierung des Amids, Addition von CO2, ortho-Lithiierung des Aromaten, Substitution | ortho-Alkylbenzamide | [17][18] |
| Haworth-Methylierung | |||||
| Walter Norman Haworth | 1915 | Monosaccharide, Dimethylsulfat, Natriumhydroxid | Methylierung | methylierte Monosaccharide | [19] |
| Haworth-Phenantrensynthese | |||||
| Robert Downs Haworth | 1932 | Naphthalin, Bernsteinsäureanhydrid | Friedels-Craft-Acylierung, Clemmensen-Reduktion, Ringschluss, Clemmensen-Reduktion, Aromatisierung | Phenanthren | [20] |
| Hayashi-Miyaura-Reaktion | |||||
| Hideharu Hayashi, Norio Miyaura | 1997 | Boronsäuren, Enone, chiraler Rhodium-Katalysator | 1,4-Addition | Bildung einer C-C-Bindung | [21] |
| Hayashi-Umlagerung | |||||
| Mosuke Hayashi | 1927 | ortho-Benzoylbenzoesäuren, Schwefelsäure | Umlagerung | Isomere | [22] |

| |||||
| Hayashi-Uozumi-Hydrosilylierung | |||||
| Yasuhiro Uozumi, Tamio Hayashi | 1991 | Alkene, Trichlorsilan, chiraler Pd-Katalysator, Wasserstoffperoxid | assymetrische Hydrosilylierung, Oxidation | enantioselektive Alkohole | [23] |
| Hay-Kupplung | |||||
| Allan S. Hay | 1962 | terminale Alkine, Kupfer(I)-chlorid, TMEDA | Glaser-Kupplung | 1,3-Diine | [24] |
| Heathcock-Aldol-Synthese | |||||
| Heck-Reaktion | |||||
| Richard F. Heck | 1972 | Alkene, organische Halogenide, Palladium-Katalysator | Kreuzkupplung | Bildung einer C-C-Bindung zwischen Alken und zweiter Verbindung | [25] |
| Hegedus-Indolsynthese | |||||
| Louis S. Hegedus | 1976 | ortho-Allylaniline, Palladium(II)-Salz-Katalysator | Bildung eines Amin-Alken-Palladiumkomplexes, Ringschluss | Indole | [26] |
| Heine-Reaktion | |||||
| Harold W. Heine | 1959 | Aziridine, Natriumiodid | Isomerisierung | Oxazole | [27] |

| |||||
| Helferich-Methode | |||||
| Burckhardt Helferich | 1933 | acetylierte Zucker, Phenol, Zinkchlorid/Eisen(III)-chlorid (Katalysator) | Glycosidierung | phenol-glycosidierter Zucker | [28] |

| |||||
| Helferich-Glykosylierung | |||||
| Burckhardt Helferich | 1956 | Glycosylbromide, Alkohole, Quecksilbercyanid | nucleophile Substitution | O-Glycoside | [29] |
| Hell-Volhard-Zelinsky-Reaktion | |||||
| Carl Magnus von Hell, Jacob Volhard, Nikolai Dmitrijewitsch Selinski | 1881/1887 | Carbonsäuren, Brom, Phosphortribromid | Bildung des Carbonsäurebromides, Enolisierung, Reaktion mit Brom, Hydrolyse | α-halogenisierten Carbonsäuren/-ester | [30][31][32] |

| |||||
| Helmchen-Synthese | |||||
| Günter Helmchen | 1983 | Carbonsäuren, Helmchen-Auxiliar, Base, Bromorganyle | Veresterung, Enol-Bildung, nukleophile Substitution | enantioselektive Carbonsäuren/Alkohole | [33] |
| Hemetsberger-Indol-Synthese | |||||
| Helfried Hemetsberger | 1969 | 2-Azidozimtsäureester | thermische Umlagerung | Indol-2-carbonsäureester | [34] |

| |||||
| Henkel-Reaktion | |||||
| Bernhard Raecke (benannt nach Henkel) | 1952 | Alkalisalze aromatischer Carbonsäuren oder Dicarbonsäuren, CO2, Cadmium oder Zink (Katalysator) | thermische Umlagerung oder Disproportionierung | Terephthalsäure | [35] |

| |||||
| Henry-Reaktion | |||||
| Louis Henry | 1895 | Nitroalkan, Carbonylverbindung | aldol-artige Reaktion | β-Nitroalkohole | [36] |

| |||||
| Herbst-Engel-Transaminierung | |||||
| Robert M. Herbst, L. L. Engel | 1934 | α-Aminosäure, α-Ketosäure | Transaminierung | neue Aminosäure, Aldehyd | [37] |

| |||||
| Heron-Umlagerung | |||||
| Stephen A. Glover (benannt nach Heron Island) | 1994 | substituierte Amide, Amin | Umlagerung | Carbonsäureester, Diimin | [38] |

| |||||
| Herrmann-Beller-Reaktion | |||||
| Wolfgang A. Herrmann, Matthias Beller | 1995 | Norbornadien, terminale Alkine, Palladacyclen (Katalysator) | Addition | exo-5-Alkynylbicyclo[2.2.1]hept-2-ene | [39] |
| Herz-Reaktion | |||||
| Richard Herz | 1914 | aromatische Amine, Schwefelmonochlorid | Bildung des Herz-Salzes, Hydrolyse | ortho-Aminothiophenole | [40] |

| |||||
| Hetero-Diels-Alder-Reaktion | |||||
| Thomas L. Gresham, Thomas R. Steadman (bennant nach Otto Diels, Kurt Alder) | 1949 | Ketone/Aldehyde/Imine/Thioketone, α,β-ungesättigten Carbonylverbindung | [4+2]-Cycloaddition | Sechsring-Heterocyclen | [41] |

| |||||
| Heumann Indigo-Prozess | |||||
| Karl Heumann | 1890 | Anilin/Anthranilsäure, Chloressigsäure, Kaliumhydroxid, Sauerstoff | Bildung von N-Phenylglycin bzw. Phenylglycin-o-carbonsäure, Cyclisierung, Oxidation | Indigo | [42] |

| |||||
| Heyns-Umlagerung | |||||
| Kurt Heyns | 1952 | α-Hydroxyimine | Umlagerung | α-Ketoamine | [43] |
| Hiebersche Basenreaktion | |||||
| Walter Hieber | 1931 | Metallcarbonyle, Nucleophile | nucleophiler Angriff am CO, Abspaltung von CO2 | Metallcarbonylhydride | [44] |
|
| |||||
| Hilbert-Johnson-Reaktion | |||||
| Treat B. Johnson, Guido E. Hilbert | 1929 | 2,4-Dialkoxypyrimidine, halogenierte Zucker | nukleophile Substitution | Pyrimidinglycoside | [45] |
| Himbert-Reaktion | |||||
| Gerhard Himbert | 1982 | Allencarboxanilide/-phenylester | intramolekulare Diels-Alder-Reaktion | Bicyclo[2.2.2]octadiene | [46] |
| Hinsberg-Oxindolsynthese | |||||
| Oscar Hinsberg | 1888 | Sekundäre Arylamine, Glyoxalnatriumbisulfit | Oxindole | [47] | |
| Hinsberg-Reaktion | |||||
| Oscar Hinsberg | 1890 | Amine, Benzolsulfonsäurechlorid | Reaktion von Schwefel und Amin, Abspaltung von Chlorid | je nach Art des Amins unterschiedlich lösliches Sulfonsäureamid | [48] |

| |||||
| Hinsberg-Sulfonsynthese | |||||
| Oscar Hinsberg | 1894 | Chinone, Sulfinsäuren | elektrophile aromatische Substitution | Sulfonchinonderivate | [49] |
| Hinsberg-Thiophensynthese | |||||
| Oscar Hinsberg | 1910 | Diketone, Thioglutarsäurediester, Base | Lactonbildung, Ringschluss, Aromatisierung | Thiophene | [50] |

| |||||
| Hirao-Kreuzkupplung | |||||
| Toshikazu Hirao | 1981 | Dialkylphosphite, Halogenaromaten, Palladium-Katalysator | Kreuzkupplung | Phosphonate | [51] |
| Hiyama-Denmark-Kreuzkupplung | |||||
| Tamejiro Hiyama, Scott Denmark | 2008 | Vinyl- oder Arylhalogenide, Organosilanole, Palladiium-Katalysator, Base | Kreuzkupplung | C-C-Bindungen | [52] |

| |||||
| Hiyama-Heathcock-Allylierung | |||||
| Tamejiro Hiyama, Clayton H. Heathcock | 1977 | Allylhalogenide, Aldehyde/Ketone, Chrom(II)-chlorid (Kat.) | Kupplungsreaktion | anti-Homoallylalkohole | [53][54] |
| Hiyama-Kreuzkupplung | |||||
| Tamejiro Hiyama | 1988 | Alkyl-/Aryl-/Alkenylhalogenide, Organosilane, Palladium-Katalysator, Fluorid | Kreuzkupplung | C-C-Bindungen | [55] |
| Hoch-Campbell-Aziridinsynthese | |||||
| Joseph Hoch, Kenneth N. Campbell | 1934/39 | Oxime, Grignard-Verbindungen | Deprotonierung, Nitren-Bildung, Cyclisierung, Addition, Hydrolyse | Aziridine | [56][57] |

| |||||
| Hocksche Spaltung | |||||
| Heinrich Hock | 1944 | Hydroperoxide, Säure | Umlagerung | Carbonyl- und Hydroxyverbindung | [58] |
| Hofer-Moest-Reaktion | |||||
| Hans Werner Hofer, M. Moest | 1902 | aliphatische Carbonsäuren | elektrolytische Decarboxylierung | Alkohole | [59] |

| |||||
| Hofmann-Eliminierung | |||||
| August Wilhelm von Hofmann | 1851 | Amine, Methyliodid, Silber(I)-oxid | Alkylierung zur Quartären Ammoniumverbindung, Eliminierung | Alkene | [60] |

| |||||
| Hofmann-Isonitrilsynthese | |||||
| August Wilhelm von Hofmann | 1868 | primäre Amine, Chloroform, Base | nucleophile Substitution, Deprotonierung, Eliminierung | Isonitrile | [61] |

| |||||
| Hofmann-Löffler-Freytag-Reaktion | |||||
| August Wilhelm von Hofmann, Karl Löffler, Curt Freytag | 1885/1909 | N-Halogenamine, Säure, Base | Cyclisierung | cyclische Amine | [62][63] |

| |||||
| Hofmann-Martius-Umlagerung | |||||
| August Wilhelm von Hofmann, Carl Alexander von Martius | 1871 | N-alkylierte Aniline, Säure | Umlagerung | ortho- und para-alkylierte Aniline | [64] |
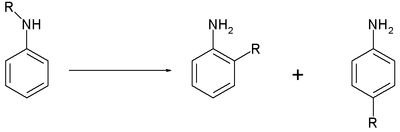
| |||||
| Hofmann-Sand-Reaktion | |||||
| K. A. Hofmann, Julius Sand | 1900 | Alkene, Quecksilberacetat, Natriumborhydrid, Natronlauge | Anlagerung des Quecksilberacetats, Reduktion | Alkohole | [65] |

| |||||
| Hofmann-Umlagerung | |||||
| August Wilhelm von Hofmann | 1881 | Säureamide, Brom, Base | Bildung eines N-Bromamides, Deprotonierung, Abspaltung von Bromid, Umlagerung, Abspaltung von CO2 | Amine | [66] |

| |||||
| Holleman-Pinakolsynthese | |||||
| Arnold F. Holleman | 1906 | Aldehyde/Ketone, Magnesiumamalgam/Titanocendichlorid | reduktive radikalische Kupplung | Pinakole | [67] |
| Hooker-Reaktion | |||||
| Samuel Cox Hooker | 1936 | 2-Hydroxy-3-alkyl-(oder alkenyl)-1,4-benzochinon, Kaliumpermanganat | Oxidation | Vertausch von Hydroxy- und Alkylgruppe, diese enthält eine Methylengruppe weniger | [68] |

| |||||
| Horenstein-Pählicke-Reaktion | |||||
| Heinrich Horenstein, Herrmann Pählicke | 1938 | Carbonsäure, halogenierte tertiäre Amine | nucleophile Substitution | Carbonsäureester | [69] |

| |||||
| Horner-Wadsworth-Emmons-Reaktion | |||||
| Leopold Horner, William S. Wadsworth, William D. Emmons | 1958 | Aldehyde/Ketone, organische Phosphonate, Base | Wittig-artige Reaktion | stereoselektive (E)-Alkene | [70][71] |

| |||||
| Houben-Fischer-Synthese | |||||
| Josef Houben, Walter Fischer | 1929 | Trichlormethylarylketimine, Base | Hydrolyse | aromatische Nitrile | [72] |
| Houben-Hoesch-Synthese | |||||
| Josef Houben, Kurt Hoesch | 1915/1926 | elektronenreiche Aromaten, Nitrile, Lewis-Säure, Chlorwasserstoff | elektrophile aromatische Substitution | acylierte Aromaten | [73][74] |

| |||||
| Houdry-Crackingprozess | |||||
| Eugene Houdry | 1934 | Schweröl, Ton-Katalysator | thermische Spaltung | leichtere Benzinfraktionen | [75] |
| Hosomi-Sakurai-Reaktion | |||||
| Akíra Hosomi, Hideki Sakurai | 1976 | Carbonylverbindung, nucleophiles allylisches Silan, Lewis-Säure | grignard-ähnliche Reaktion | je nach Carbonylverbindung unterschiedliche Alkohole | [76] |
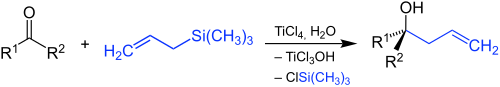
| |||||
| Huisgen-Pyrrolsynthese | |||||
| Rolf Huisgen | 1960 | α-Aminosäuren, Carbonsäuren, Alkine | Kondensation und Ringschluss zum Münchnon, [3+2]-Cycloaddition, CO2-Abspaltung | Pyrrole | [77] |

| |||||
| Huisgen-Tetrazolumlagerung | |||||
| Rolf Huisgen | 1958 | C-substituierte Tetrazole, Carbonsäurechloride | Umlagerung | 2,5-disubstituierte 1,3,4-Oxdiazole | [78] |
| Hunsdiecker-Borodin-Reaktion (Hunsdiecker-Reaktion) | |||||
| Heinz Hunsdiecker, Claire Hunsdiecker, Alexander Borodin | 1861/1939 | Silber-, Quecksilber- oder Thalliumcarbonsäuresalze, Halogene (Cl2, Br2, I2) | Bildung eines Hypohalogenites, Decarboxylierung, Radikalrekombination | Alkylhalogenide | [79][80] |

| |||||
| Hunsdiecker-Kondensation | |||||
| Heinz Hunsdiecker | 1942 | γ-Diketone, Base | intermolekulare Kondensation | Cyclopentenone | [81] |

| |||||
| Hurd-Mori-1,2,3-Thiadiazolsynthese | |||||
| Charles Hurd, Raymond Mori | 1955 | N-acylierte Hydrazone, Thionylchlorid | Cyclisierung | Thiadiazole | [82] |
Quellen
[Bearbeiten | Quelltext bearbeiten]- ↑ Patent DE2102623: Asymmetrische Synthese polycyclischer organischer Verbindungen. Veröffentlicht am 29. Juli 1971, Erfinder: Z. G. Hajos, D. R. Parrish.
- ↑ Ulrich Eder, Gerhard Sauer, Rudolf Wiechert: New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures. In: Angewandte Chemie. International Edition in English. Band 10, 1971, S. 496–497, doi:10.1002/anie.197104961.
- ↑ A. Haller, Ed. Bauer: Sur un mode de préparation général des acidiques trialcoylacédiques. In: Comptes Rendus. 148, 1909, S. 127-132 (Volltext bei Gallica).
- ↑ P. Dyson, D. Ll. Hammick: 362. Experiments on the mechanism of decarboxylation. Part I. Decomposition of quinaldinic and isoquinaldinic acids in the presence of compounds containing carbonyl groups. In: Journal of the Chemical Society (Resumed). 1937, S. 1724, doi:10.1039/JR9370001724.
- ↑ V. L. Hansley: The Preparation of High Molecular Weight Acyloins. In: Journal of the American Chemical Society. 57, 1935, S. 2303, doi:10.1021/ja01314a076.
- ↑ Miyoji Hanaoka, Nobuo Ogawa, Yoshio Arata: Synthesis of (.+-.)-desmethyldecaline.. In: Chemical and Pharmaceutical Bulletin. 1974, Band 22, Nummer 8, S. 1945–1946 doi:10.1248/cpb.22.1945.
- ↑ J.T. Wrobel: In: Rocz. Chem. 1971, 45, S. 705.
- ↑ A. Hantzsch: Condensationsprodukte aus Aldehydammoniak und ketonartigen Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 1637–1638, doi:10.1002/cber.18810140214.
- ↑ A. Hantzsch: Neue Bildungsweise von Pyrrolderivaten. In: Berichte der deutschen chemischen Gesellschaft. 23, 1890, S. 1474–1476, doi:10.1002/cber.189002301243.
- ↑ A. Hantzsch, James H. Weber: Ueber Verbindungen des Thiazols (Pyridins der Thiophenreihe). In: Berichte der Deutschen Chemischen Gesellschaft. 1887, Band 20, Nummer 2, S. 3118–3132 doi:10.1002/cber.188702002200.
- ↑ C. Harries: Ueber die Einwirkung des Ozons auf organische Verbindungen. In: Justus Liebig's Annalen der Chemie. 343, 1905, S. 311–344, doi:10.1002/jlac.19053430209.
- ↑ Stephen K. Hashmi, T.M. Frost, Jan W. Bats: Highly Selective Gold-Catalyzed Arene Synthesis. In: Journal of the American Chemical Society. 2000, Band 122, Nummer 46, S. 11553–11554 doi:10.1021/ja005570d.
- ↑ H. B. Hass, Myron L. Bender: The Reaction of Benzyl Halides with the Sodium Salt of 2-Nitropropane. A General Synthesis of Substituted Benzaldehydes. In: Journal of the American Chemical Society. 71, 1949, S. 1767, doi:10.1021/ja01173a066.
- ↑ Eugene Ghera, Tamar Yechezkel, Alfred Hassner: A new diastereoselective 3+2 annulation approach to five-membered carbocycles. In: Tetrahedron letters. 1990, Band 31, Nummer 25, S. 3653–3656 doi:10.1016/S0040-4039(00)94468-X.
- ↑ R. Daniel Little, James Dawson: MIRC (ichael nitiated ing losure) Reactions Formation of Three, Five, Six and Seven Membered Rings. In: Tetrahedron letters. 1980, Band 21, Nummer 27, S. 2609–2612 doi:10.1016/S0040-4039(00)92818-1.
- ↑ Frank M. Hauser, Richard P. Rhee: New synthetic strategy for the preparation of linear phenolic natural products. In: Journal of the American Chemical Society. 1977, Band 99, Nummer 13, S. 4533–4534 doi:10.1021/ja00455a069.
- ↑ Chung‐Ling Mao, I. T. Barnish, Charles R. Hauser: Synthesis of phthalimidines. Acid-catalyzed cyclodehydration versus cyclodeamination of γ-hydroxyamides obtained from dilithio-N-substituted benzamides and ketones. In: Journal of Heterocyclic Chemistry. 1969, Band 6, Nummer 4, S. 475–482 doi:10.1002/jhet.5570060405.
- ↑ Peter Beak, Roger A. Brown: The ortho lithiation of tertiary benzamides. In: The Journal of Organic Chemistry. 1977, Band 42, Nummer 10, S. 1823–1824 doi:10.1021/jo00430a042.
- ↑ Walter Norman Haworth: III.- new method of preparing alkylated sugars. In: Journal of the Chemical Society, Transactions. 107, 1915, S. 8, doi:10.1039/CT9150700008.
- ↑ Robert Downs Haworth: 145. Syntheses of alkylphenanthrenes. Part I. 1-, 2-, 3-, and 4-Methylphenanthrenes. In: Journal of the Chemical Society (Resumed). 1932, S. 1125, doi:10.1039/JR9320001125.
- ↑ Masaaki Sakai, Hideharu Hayashi, Norio Miyaura: Rhodium-Catalyzed Conjugate Addition of Aryl- or 1-Alkenylboronic Acids to Enones. In: Organometallics. 1997, Band 16, Nummer 20, S. 4229–4231 doi:10.1021/om9705113.
- ↑ Mosuke Hayashi: CCCXXXVI.- new isomerism of halogenohydroxybenzoyltoluic acids. In: Journal of the Chemical Society (Resumed). 1927, S. 2516, doi:10.1039/JR9270002516.
- ↑ Yasuhiro Uozumi, Tamio Hayashi: Catalytic asymmetric synthesis of optically active 2-alkanols via hydrosilylation of 1-alkenes with a chiral monophosphine-palladium catalyst. In: Journal of the American Chemical Society. 1991, Band 113, Nummer 26, S. 9887–9888 doi:10.1021/ja00026a044.
- ↑ Allan S. Hay: Oxidative Coupling of Acetylenes. II1. In: Journal of organic chemistry. 1962, Band 27, Nummer 9, S. 3320–3321 doi:10.1021/jo01056a511.
- ↑ R. F. Heck, J. P. Nolley: Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides. In: The Journal of Organic Chemistry. 37, 1972, S. 2320–2322, doi:10.1021/jo00979a024.
- ↑ L. S. Hegedus, G. F. Allen, E. L. Waterman: Palladium assisted intramolecular amination of olefins. A new synthesis of indoles. In: Journal of the American Chemical Society. 98, 1976, S. 2674–2676, doi:10.1021/ja00425a051.
- ↑ Harold W. Heine, Mary Emma Fetter, Elva Mae Nicholson: The Isomerization of Some 1-Aroylaziridines. II. In: J. Am. Chem. Soc. 81, 9, 1959, S. 2202–2204, doi:10.1021/ja01518a048.
- ↑ Burckhardt Helferich, Ernst Schmitz-Hillebrecht: Eine neue Methode zur Synthese von Glykosiden der Phenole. In: Berichte der deutschen chemischen Gesellschaft. 66, 3, 1933, S. 378-383, doi:10.1002/cber.19330660313.
- ↑ Burckhardt Helferich, K. Weis: Zur Synthese von Glucosiden und von nicht‐reduzierenden Disacchariden. In: Chemische Berichte. 1956, Band 89, Nummer 2, S. 314–321 doi:10.1002/cber.19560890220.
- ↑ Carl Hell: Ueber eine neue Bromirungsmethode organischer Säuren. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 891–893, doi:10.1002/cber.188101401187.
- ↑ J. Volhard: 4) Ueber Darstellung α-bromirter Säuren. In: Justus Liebig's Annalen der Chemie. 242, 1887, S. 141–163, doi:10.1002/jlac.18872420107.
- ↑ Nicolaus Zelinsky: Ueber eine bequeme Darstellungsweise von α-Brompropionsäureester. In: Berichte der deutschen chemischen Gesellschaft. 20, 1887, S. 2026–2026, doi:10.1002/cber.188702001452.
- ↑ Günter Helmchen, Roland Schmierer: A total synthesis of enentiomerically pure vitamin e side chain using a chiral propionate synthon. In: Tetrahedron Letters. 1983, Band 24, Nummer 12, S. 1235–1238 doi:10.1016/S0040-4039(00)81623-8.
- ↑ H. Hemetsberger, D. Knittel, H. Weidmann: Synthese von α-Azidozimtsäureestern. In: Monatshefte für Chemie. 100, 1969, S. 1599, doi:10.1007/BF00900176.
- ↑ Patent DE936036: Verfahren zur Herstellung von Terephthalsaeure. Angemeldet am 22. November 1952, veröffentlicht am 1. Dezember 1955, Anmelder: Henkel & Cie GmbH, Erfinder: Bernhard Raecke.
- ↑ Louis Henry: Formation synthétique d'alcools nitrés. In: Comptes Rendus. 120, 1895, S. 1265-1268 (Volltext bei gallica).
- ↑ Robert M. Herbst, L. L. Engel: A reaction between α-ketonic acids and α-amino acids. In: Journal of Biological Chemistry, 1934, 107, S. 505-512 (Volltext).
- ↑ Stephen A. Glover, Gerard P. Hammond, Antonio M. Bonin: A Comparison of the Reactivity and Mutagenicity of N-(Benzoyloxy)-N-(benzyloxy)benzamides. In: The Journal of Organic Chemistry. 63, 1998, S. 9684, doi:10.1021/jo980863z.
- ↑ Wolfgang A. Herrmann, Christoph Broßmer, Karl Öfele, Claus‐Peter Reisinger, Thomas Priermeier, Matthias Beller, Hartmut Fischer: Palladacyclen als strukturell definierte Katalysatoren für die Heck‐Olefinierung von Chlor‐ und Bromarenen. In: Angewandte Chemie. 1995, Band 107, Nummer 17, S. 1989–1992 doi:10.1002/ange.19951071708.
- ↑ Patent DE360690: Verfahren zur Darstellung von schwefel- und stickstoffhaltigen Kondensationsprodukten der aromatischen Reih. Veröffentlicht am Dezember 1914.04, Erfinder: Richard Herz.
- ↑ Thomas L. Gresham, Thomas R. Steadman: A Diels--Alder Type Reaction with Formaldehyde. In: Journal of the American Chemical Society. 71, 1949, S. 737, doi:10.1021/ja01170a101.
- ↑ Karl Heumann: Synthese des Indigos mittelst Phenylglycin. In: Journal für praktische Chemie. 1890, Band 42, Nummer 1, S. 520 doi:10.1002/prac.18900420148.
- ↑ Kurt Heyns, W. Koch: Notizen: Über die Bildung eines Aminozuckers aus d-Fructose und Ammoniak. In: Zeitschrift für Naturforschung. B, A journal of chemical sciences. 1952, Band 7, Nummer 8, S. 486–488 doi:10.1515/znb-1952-0812.
- ↑ W. Hieber, Fritz Leutert: Zur Kenntnis des koordinativ gebundenen Kohlenoxyds: Bildung von Eisencarbonylwasserstoff. In: Naturwissenschaften. 1931, Band 19, Nummer 17, S. 360–361 doi:10.1007/BF01522286.
- ↑ T. B. Johnson, G. E. Hilbert: The synthesis of pyrimidine-glycosides. In: Science. 69, 1929, S. 579, doi:10.1126/science.69.1796.579.
- ↑ Gerhard Himbert, Lothar Henn: Intramolekulare Diels-Alder-Reaktion von Allencarboxaniliden. In: Angewandte Chemie. 2006, Band 94, Nummer 8, S. 631–632 doi:10.1002/ange.19820940806.
- ↑ O. Hinsberg: Ueber die Einwirkung der Natriumbisulfitverbindung des Glyoxals auf aromatische Monamine. In: Berichte der deutschen chemischen Gesellschaft. 21, 1888, S. 110, doi:10.1002/cber.18880210122.
- ↑ O. Hinsberg: Ueber die Bildung von Säureestern und Säureamiden bei Gegenwart von Wasser und Alkali. In: Berichte der deutschen chemischen Gesellschaft. 23, 1890, S. 2962, doi:10.1002/cber.189002302215.
- ↑ O. Hinsberg: Ueber einige Diphenylsulfonderivate. In: Berichte der deutschen chemischen Gesellschaft. 27, 1894, S. 3259, doi:10.1002/cber.189402703118.
- ↑ O. Hinsberg: Synthetische Versuche mit Thiodiglykolsäureester. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 901, doi:10.1002/cber.191004301153.
- ↑ Toshikazu Hirao, Toshio Masunaga, Yoshiki Ohshiro, Toshio Agawa: A Novel Synthesis of Dialkyl Arenephosphonates. In: Synthesis. 1981, Band 1981, Nummer 01, S. 56–57 doi:10.1055/s-1981-29335.
- ↑ Scott E. Denmark, Christopher S. Regens: Palladium-Catalyzed Cross-Coupling Reactions of Organosilanols and Their Salts: Practical Alternatives to Boron- and Tin-Based Methods. In: Accounts of Chemical Research. 41, 2008, S. 1486, doi:10.1021/ar800037p.
- ↑ Yoshitaka Okude, S. Hirano, Tamejiro Hiyama, Hitosi Nozaki: Grignard-type carbonyl addition of allyl halides by means of chromous salt. A chemospecific synthesis of homoallyl alcohols. In: Journal of the American Chemical Society. 1977, Band 99, Nummer 9, S. 3179–3181 doi:10.1021/ja00451a061.
- ↑ Charles T. Buse, Clayton H. Heathcock: Acyclic stereoselection. III. Synthesis of threo-3-hydroxy-2-methylcarboxylic acids. In: Tetrahedron letters. 1978, Band 19, Nummer 19, S. 1685–1688 doi:10.1016/S0040-4039(01)94640-4.
- ↑ Yasuo Hatanaka, Tamejiro Hiyama: Cross-coupling of organosilanes with organic halides mediated by a palladium catalyst and tris(diethylamino)sulfonium difluorotrimethylsilicate. In: The Journal of Organic Chemistry. 53, 1988, S. 918, doi:10.1021/jo00239a056.
- ↑ Joseph Hoch: Action des organomagnésiens sur les cétoximes. In: Comptes rendus de l’Académie des sciences. Nr. 198, 1934, S. 1865 (Digitalisat auf Gallica).
- ↑ Kenneth N. Campbell, James F. McKenna: The action of grignard reagents on oximes. I. The action of phenylmagnesium bromide on mixed ketoximes. In: The Journal of Organic Chemistry. 04, 1939, S. 198, doi:10.1021/jo01214a012.
- ↑ Heinrich Hock, Shon Lang: Autoxydation von Kohlenwasserstoffen, IX. Mitteil.: Über Peroxyde von Benzol-Derivaten. In: Berichte der deutschen chemischen Gesellschaft. 77, 1944, S. 257, doi:10.1002/cber.19440770321.
- ↑ Hans Werner Hofer, M. Moest: Ueber die Bildung von Alkoholen bei der Elektrolyse fettsaurer Salze. In: Justus Liebigs Annalen der Chemie. 1902, Band 323, Nummer 3, S. 284–323 doi:10.1002/jlac.19023230304.
- ↑ Aug. Wilk. von Hofmann: Beiträge zur Kenntniss der flüchtigen organischen Basen. In: Annalen der Chemie und Pharmacie. 78, 1851, S. 253, doi:10.1002/jlac.18510780302.
- ↑ A. W. Hfmann: Ueber eine neue Reihe von Homologen der Cyanwasserstoffsäure. In: Justus Liebigs Annalen der Chemie. 1868, Band 146, Nummer 1, S. 107–119 doi:10.1002/jlac.18681460106.
- ↑ A. W. Hofmann: Zur Kenntniss der Coniin-Gruppe. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 5, doi:10.1002/cber.18850180103.
- ↑ Karl Löffler, Curt Freytag: Über eine neue Bildungsweise von N-alkylierten Pyrrolidinen. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 3427, doi:10.1002/cber.19090420377.
- ↑ A. W. Hofmann: Methylirung der Phenylgruppe im Anilin. In: Berichte der deutschen chemischen Gesellschaft. 4, 1871, S. 742, doi:10.1002/cber.18710040271.
- ↑ K. A. Hofmann, Julius Sand: Ueber das Verhalten von Mercurisalzen gegen Olefine. In: Berichte der deutschen chemischen Gesellschaft. 33, 1900, S. 1340, doi:10.1002/cber.190003301231.
- ↑ A. W. Hofmann: Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 2725, doi:10.1002/cber.188101402242.
- ↑ A. F. Holleman: Note sur la préparation de la pinacone. In: Recueil des travaux chimiques des Pays-Bas et de la Belgique. 1906, Band 25, Nummer 6, S. 206–207 doi:10.1002/recl.19060250603.
- ↑ Samuel C. Hooker: On the Oxidation of 2-Hydroxy-1,4-naphthoquinone Derivatives with Alkaline Potassium Permanganate. In: Journal of the American Chemical Society. 58, 1936, S. 1174, doi:10.1021/ja01298a030.
- ↑ Heinrich Horenstein, Herrmann Pählicke: Über eine neue Umlagerungsreaktion und ihre Anwendung zur Darstellung von Estern der Aminoalkohole. In: Berichte der deutschen chemischen Gesellschaft. 71, 1938, S. 1644, doi:10.1002/cber.19380710820.
- ↑ Leopold Horner, Hellmut Hoffmann, Hans G. Wippel: Phosphororganische Verbindungen, XIII. Darstellung von Phosphinsäuren aus Phosphinoxyden. In: Chemische Berichte. 91, 1958, S. 64, doi:10.1002/cber.19580910114.
- ↑ William S. Wadsworth, William D. Emmons: The Utility of Phosphonate Carbanions in Olefin Synthesis. In: Journal of the American Chemical Society. 83, 1961, S. 1733, doi:10.1021/ja01468a042.
- ↑ J. Houben, Walter Fischer: Über die Kernkondensation von Phenolen und Phenoläthern mit Nitrilen zu Phenol- und Phenoläther-ketimiden und -ketonen. IV.: Synthesen mit Phenol, o- und m-Kresol, p-Kresol-methyläther und p-Kresol. In: Journal für Praktische Chemie. 123, 1929, S. 262, doi:10.1002/prac.19291230117.
- ↑ Kurt Hoesch: Eine neue Synthese aromatischer Ketone. I. Darstellung einiger Phenol-ketone. In: Berichte der deutschen chemischen Gesellschaft. 48, 1915, S. 1122, doi:10.1002/cber.191504801156.
- ↑ J. Houben: Über die Kern-Kondensation von Phenolen und Phenol-äthern mit Nitrilen zu Phenol- und Phenol-äther-Ketimiden und -Ketonen (I.). In: Berichte der deutschen chemischen Gesellschaft. 59, 1926, S. 2878, doi:10.1002/cber.19260591135.
- ↑ Patent US1957648: Process and apparatus for the treatment of heavy oils and the like for the conversion thereof into lighter products. Veröffentlicht am 8. Mai 1934, Erfinder: Eugene Houdry.
- ↑ Akíra Hosomi, Hideki Sakurai: Syntheses of γ,δ-unsaturated alcohols from allylsilanes and carbonyl compounds in the presence of titanium tetrachloride. In: Tetrahedron Letters. 17, 1976, S. 1295, doi:10.1016/S0040-4039(00)78044-0.
- ↑ Rolf Huisgen, Erich Laschtuvka: Eine neue Synthese von Derivaten des Pyrrols. In: Chemische Berichte. 1960, Band 93, Nummer 1, S. 65–81 doi:10.1002/cber.19600930113.
- ↑ Rolf Huisgen, Jürgen Sauer, Hans Jürgen Sturm: Acylierung 5‐substitutierter Tetrazole zu 1.3.4‐Oxdiazolen. In: Angewandte Chemie. 1958, Band 70, Nummer 9, S. 272–273 doi:10.1002/ange.19580700918.
- ↑ A. Borodin: Ueber Bromvaleriansäure und Brombuttersäure. In: Annalen der Chemie und Pharmacie. 119, 1861, S. 121, doi:10.1002/jlac.18611190113.
- ↑ Patent US2176181: Method of manufacturing organic chlorine and bromine derivatives. Veröffentlicht am 17. Oktober 1939, Erfinder: Claire Hunsdiecker, E. Vogt, Heinz Hunsdiecker.
- ↑ Heinz Hunsdiecker: Über das Verhalten der γ‐Diketone, I. Mitteilung. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1942, Band 75, Nummer 5, S. 447–454 doi:10.1002/cber.19420750502.
- ↑ Charles D. Hurd, Raymond I. Mori: On Acylhydrazones and 1,2,3-Thiadiazoles. In: Journal of the American Chemical Society. 77, 1955, S. 5359, doi:10.1021/ja01625a047.
![{\displaystyle {\ce {Fe(CO)5{}+NaOH->Na[Fe(CO)4COOH]->[{\text{+ NaOH}}]Na[HFe(CO)4]{}+NaHCO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/27dd6b6f879f83df867d01c7e09fb16c1f3eea5f)
![{\displaystyle {\ce {Na[HFe(CO)4] + H+ -> H2[Fe(CO)4] + Na+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f17639f9bbce8d6c18e9fac9a6e002edb4f0d35)